非金属元素及其化合物[下学期]
图片预览
文档简介
专题10 非金属元素及其化合物 贺大连 2007-4-6
[知识体系和复习重点]
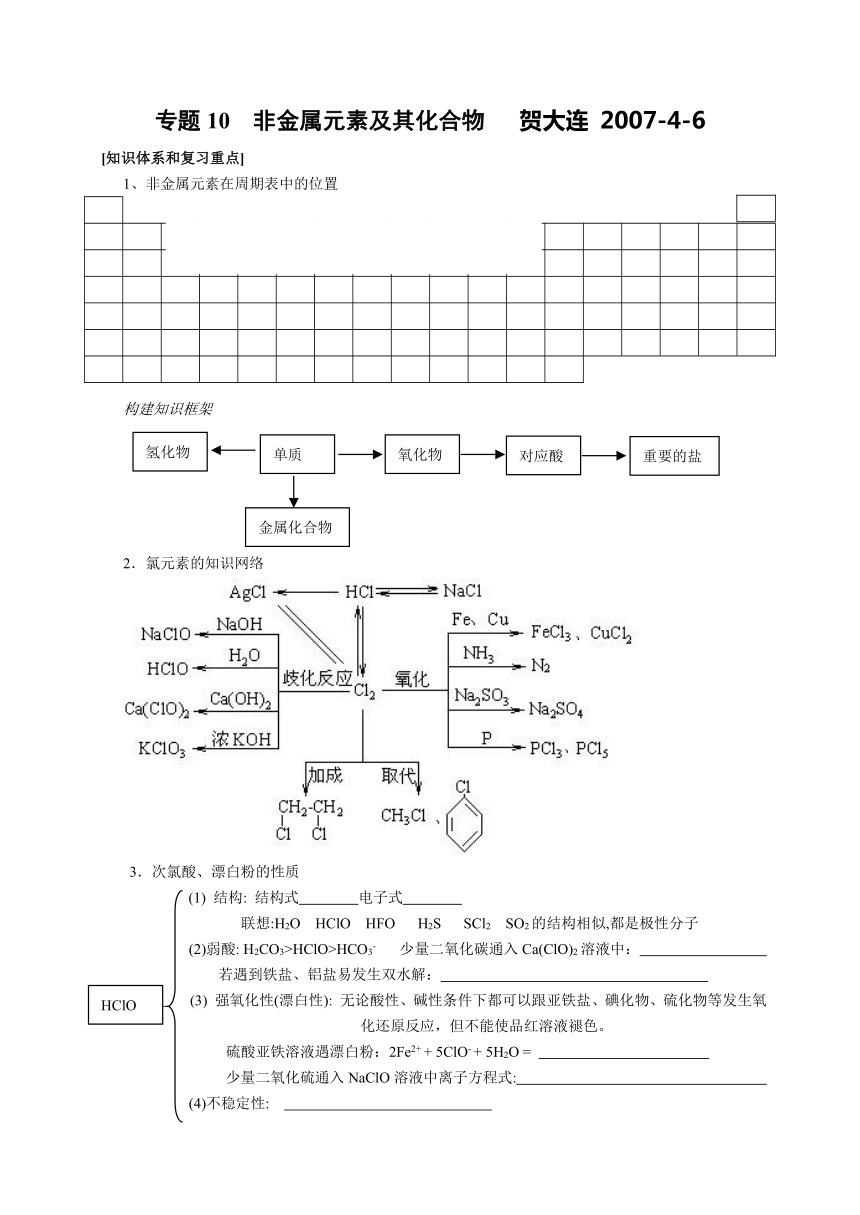
1、非金属元素在周期表中的位置
构建知识框架
2.氯元素的知识网络
3.次氯酸、漂白粉的性质
(1) 结构: 结构式 电子式
联想:H2O HClO HFO H2S SCl2 SO2的结构相似,都是极性分子
(2)弱酸: H2CO3>HClO>HCO3- 少量二氧化碳通入Ca(ClO)2溶液中:
若遇到铁盐、铝盐易发生双水解:
(3) 强氧化性(漂白性): 无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。
硫酸亚铁溶液遇漂白粉:2Fe2+ + 5ClO- + 5H2O =
少量二氧化硫通入NaClO溶液中离子方程式:
(4)不稳定性:
漂白粉: 漂白精: 84消毒液:
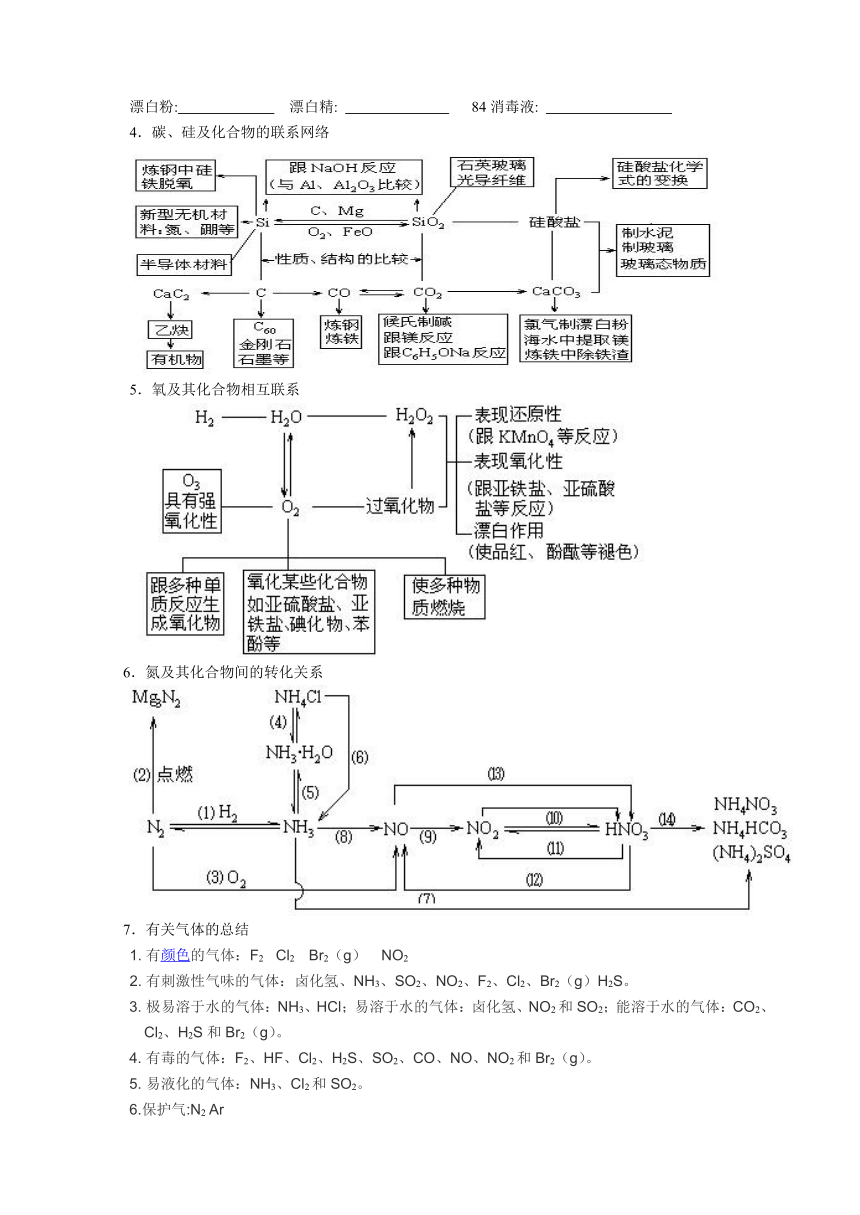
4.碳、硅及化合物的联系网络
5.氧及其化合物相互联系
6.氮及其化合物间的转化关系
7.有关气体的总结
1. 有颜色 ( http: / / action. / click / click.php ads_id=413&site_id=6235007045035559&click=1&url=http%3A / / www.sony. / electronics / bravia2006 / bravia_index.asp&v=0&k=%u989C%u8272&s=http%3A / / www. / viewthread_4460.html&rn=886081" \o "" \t "_blank )的气体:F2 Cl2 Br2(g) NO2
2. 有刺激性气味的气体:卤化氢、NH3、SO2、NO2、F2、Cl2、Br2(g)H2S。
3. 极易溶于水的气体:NH3、HCl;易溶于水的气体:卤化氢、NO2和SO2;能溶于水的气体:CO2、Cl2、H2S和Br2(g)。
4. 有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO、NO2和Br2(g)。
5. 易液化的气体:NH3、Cl2和SO2。
6.保护气:N2 Ar
(选择题答案写在题号前)班级 姓名 学号
1.以下说法中能证明无色透明液体是纯净水的是 ( )
A.测得该液体pH=7 B.电解该液体得到氢气和氧气,且其体积比为2:1
C.向其中投入金属钠,钠于液面上迅速游动,并发出丝丝声
D.在l.0l×105Pa压强下测得沸点为373.15K
2.在一种酸性溶液中,存在NO3-、I一、Cl一、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此推断溶液中 ( )
A.一定有碘离子,不能确定是否含有氯离子 B.一定含有硝酸根离子
C.一定含有碘离子、氯离子、硝酸根离子 D.不含铁离子和硝酸根离子
3、向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
4.2003年10月15日,我国成功发射“神舟五号”载人飞船,飞船以铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应:
2NH4ClO4 N2↑+4H2O↑+Cl2+2O2↑;△H<0。下列有关叙述不正确的是( )
A.该反应属于分解反应、氧化还原反应、放热反应
B.上述反应瞬间能产生大量高温气体推动飞船飞行
C.从能量变化上说,主要是化学能转变为热能和动能
D.在反应中NH4ClO4仅起到氧化剂作用
5.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
A.NH3、NO2、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2
6.将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
A.CO2 B.NH3 C. C12 D.H2S
7、关于非金属元素N、O、Cl、P的叙述,正确的是
A.在通常情况下其单质均为气体 B.其单质均由双原子分子构成
C.都属于主族元素 D.每种元素仅生成一种氢化物
8、R和Y都是非金属元素,其酸根离子RO与YO的电子数相等,则下列说法正确的是
A.R和Y的阴离子具有相同的电子层结构 B. RO与YO对应的酸都是强电解质
C. RO与YO只可能被还原,不可能被氧化 D. R和Y是位于同周期相邻主族的元素
9.下列关系图中,A是一种正盐,D的 相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题:(1)A是__________,Y是__________,Z是___________。
(2)当X是强碱时,E是 ____________,当X是强酸,E是__________。
(3)写出A与X反应的离子方程式:①______________________;②________________。
10、A、B、C、D、E、F六种物质的相互转化关系如下图所示:
注:所有反应条件及部分产物未标出,其中反应①是置换
反应。⑴若A、D、F都是非金属单质,且A、D所含元素同
主族,A、F所含元素同周期,则反应
①的化学方程式是 ,
反应④发生的条件是 。
⑵若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行的,则反应②的离子方程式是 ;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
⑶若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生, A、D相遇有白烟生成, 则C的电子式是__ __,反应③的化学方程式是 ___。
⑷若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是 ____ 。
11、 超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。①上述反应的化学方程式为 ;②该样品中的A1N的质量分数为 。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,A1N不跟O2反应)。该样品中含杂质炭 g。
金属化合物
氢化物
单质
氧化物
对应酸
重要的盐
HClO
A
B
C
D
E
F
F
F
①
②
③
④
[知识体系和复习重点]
1、非金属元素在周期表中的位置
构建知识框架
2.氯元素的知识网络
3.次氯酸、漂白粉的性质
(1) 结构: 结构式 电子式
联想:H2O HClO HFO H2S SCl2 SO2的结构相似,都是极性分子
(2)弱酸: H2CO3>HClO>HCO3- 少量二氧化碳通入Ca(ClO)2溶液中:
若遇到铁盐、铝盐易发生双水解:
(3) 强氧化性(漂白性): 无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。
硫酸亚铁溶液遇漂白粉:2Fe2+ + 5ClO- + 5H2O =
少量二氧化硫通入NaClO溶液中离子方程式:
(4)不稳定性:
漂白粉: 漂白精: 84消毒液:
4.碳、硅及化合物的联系网络
5.氧及其化合物相互联系
6.氮及其化合物间的转化关系
7.有关气体的总结
1. 有颜色 ( http: / / action. / click / click.php ads_id=413&site_id=6235007045035559&click=1&url=http%3A / / www.sony. / electronics / bravia2006 / bravia_index.asp&v=0&k=%u989C%u8272&s=http%3A / / www. / viewthread_4460.html&rn=886081" \o "" \t "_blank )的气体:F2 Cl2 Br2(g) NO2
2. 有刺激性气味的气体:卤化氢、NH3、SO2、NO2、F2、Cl2、Br2(g)H2S。
3. 极易溶于水的气体:NH3、HCl;易溶于水的气体:卤化氢、NO2和SO2;能溶于水的气体:CO2、Cl2、H2S和Br2(g)。
4. 有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO、NO2和Br2(g)。
5. 易液化的气体:NH3、Cl2和SO2。
6.保护气:N2 Ar
(选择题答案写在题号前)班级 姓名 学号
1.以下说法中能证明无色透明液体是纯净水的是 ( )
A.测得该液体pH=7 B.电解该液体得到氢气和氧气,且其体积比为2:1
C.向其中投入金属钠,钠于液面上迅速游动,并发出丝丝声
D.在l.0l×105Pa压强下测得沸点为373.15K
2.在一种酸性溶液中,存在NO3-、I一、Cl一、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此推断溶液中 ( )
A.一定有碘离子,不能确定是否含有氯离子 B.一定含有硝酸根离子
C.一定含有碘离子、氯离子、硝酸根离子 D.不含铁离子和硝酸根离子
3、向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
4.2003年10月15日,我国成功发射“神舟五号”载人飞船,飞船以铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应:
2NH4ClO4 N2↑+4H2O↑+Cl2+2O2↑;△H<0。下列有关叙述不正确的是( )
A.该反应属于分解反应、氧化还原反应、放热反应
B.上述反应瞬间能产生大量高温气体推动飞船飞行
C.从能量变化上说,主要是化学能转变为热能和动能
D.在反应中NH4ClO4仅起到氧化剂作用
5.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
A.NH3、NO2、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2
6.将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
A.CO2 B.NH3 C. C12 D.H2S
7、关于非金属元素N、O、Cl、P的叙述,正确的是
A.在通常情况下其单质均为气体 B.其单质均由双原子分子构成
C.都属于主族元素 D.每种元素仅生成一种氢化物
8、R和Y都是非金属元素,其酸根离子RO与YO的电子数相等,则下列说法正确的是
A.R和Y的阴离子具有相同的电子层结构 B. RO与YO对应的酸都是强电解质
C. RO与YO只可能被还原,不可能被氧化 D. R和Y是位于同周期相邻主族的元素
9.下列关系图中,A是一种正盐,D的 相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题:(1)A是__________,Y是__________,Z是___________。
(2)当X是强碱时,E是 ____________,当X是强酸,E是__________。
(3)写出A与X反应的离子方程式:①______________________;②________________。
10、A、B、C、D、E、F六种物质的相互转化关系如下图所示:
注:所有反应条件及部分产物未标出,其中反应①是置换
反应。⑴若A、D、F都是非金属单质,且A、D所含元素同
主族,A、F所含元素同周期,则反应
①的化学方程式是 ,
反应④发生的条件是 。
⑵若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行的,则反应②的离子方程式是 ;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
⑶若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生, A、D相遇有白烟生成, 则C的电子式是__ __,反应③的化学方程式是 ___。
⑷若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是 ____ 。
11、 超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。①上述反应的化学方程式为 ;②该样品中的A1N的质量分数为 。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,A1N不跟O2反应)。该样品中含杂质炭 g。
金属化合物
氢化物
单质
氧化物
对应酸
重要的盐
HClO
A
B
C
D
E
F
F
F
①
②
③
④
同课章节目录
