高三化学复习教案(27)第八章《氮族元素》[下学期]
文档属性
| 名称 | 高三化学复习教案(27)第八章《氮族元素》[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 34.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-03 00:00:00 | ||
图片预览


文档简介
PAGE
第八章《氮族元素》高三化学复习教案(二)
【教学内容】
氨 铵盐
【教学目标】
1.认识氨分子的结构,记住氨的物理性质。
2.掌握氨的化学性质,初步掌握氨水显弱碱性的原因。
3.掌握实验室制取氨的反应原理,仪器装置、收集、检验及干燥方法。
4.了解铵盐的组成,掌握铵盐的部分物理性质和化学性质。
5.掌握铵离子的检验方法。
6.了解氨、铵盐的用途。
【知识讲解】
一、氨(NH3)
1.氨分子的结构
电子式H N H,结构式H—N—H,呈三角锥形,键盘107o18′,极性分子。
2.物理性质
无色,而有刺激气味的气体,比空气轻,极易溶于水,易液化。氨水的浓度越大,密度越小。
说明:氨极易溶于水,可做喷泉实验,该实验成败的关键:①装置必须密闭 ②仪器必须
干燥 ③气体尽量集满。在标准状况下进行该实验。氨气的体积即为溶液的体积,
其。
3.化学性质
氨分子中氮原子上还有一对孤对电子,易接受质子。因此水合能力较强易与H+反应即
与酸反应。氨气中氮元素为-3价即氮的最低价态。因此在一定条件能被氧气。
(1)氨跟水的反应
NH3+H2O NH3·H2O NH+4 +OH-
氨气溶于水大部分与水作用生成了NH3·H2O,而NH3·H2O 只有少数发了电离而生成NH+4和OH-,因此冷却浓氨水可析出NH3·H2O晶体。在氨的水溶液中存在的分子有:H2O、NH3、NH3·H2O,存在的离子有NH+4 、OH-、H+(极少量是由水电离而产生的),因此氨水是混合物。液氨不导电,而氨水能导电。
氨水中主要成分是NH3·H2O,但溶质是NH3,因此表示浓度均以NH3表示。
氨气能使湿润的红色石蕊试纸变蓝(检验氨气方法之一)。
(2)氨跟酸的反应
酸溶液均有吸收NH3而生成铵盐。
NH3+HCl=NH4Cl
NH3+H2S=NH4HS 2NH3+H2 S=(NH4)2S
NH3+HNO3=NH4NO3 2NH3+H2SO4=(NH4)2SO4
NH3+CO2+H2O=NH4HCO3 2NH3+CO2 催化剂 CO(NH2)2 + H2O
xNH3+H3PO4=(NH4)XH3-XPO4 (x为小于等于3 的整数)
在书写离子方程式时要注意区分氨气与氨水如:在盐酸中通NH3,离子方程式为
NH3+H+=NH+4,而在氨水中滴加盐酸,则离子方程式为H++ NH3·H2O=NH+4+H2O
氨气在空气中与卤化氢相遇时产生白烟,可作为检验氨气的一种方法。用两根玻璃棒分别蘸取浓氨水和浓挥发性酸,而后两根玻璃棒接近(不要接触),均会观察到产生白烟的现象。
(3)氨跟氧气反应
4NH3+5O2 Pt 4NO+6H2O+Q(Q>0)
催化剂用铂,氧化铁均可。
(4)其它反应
氨在纯氧中可燃烧生成氮气,反应方程式为:4NH3+3O2 点燃 2N2+6H2O,氨在氯气中
6e
可反应,反应方程式为2NH3+3CL2 N2+6HCL ,如氨气过量反应方程式为:
6e
8NH3+3CL2 N2+6NH4Cl.
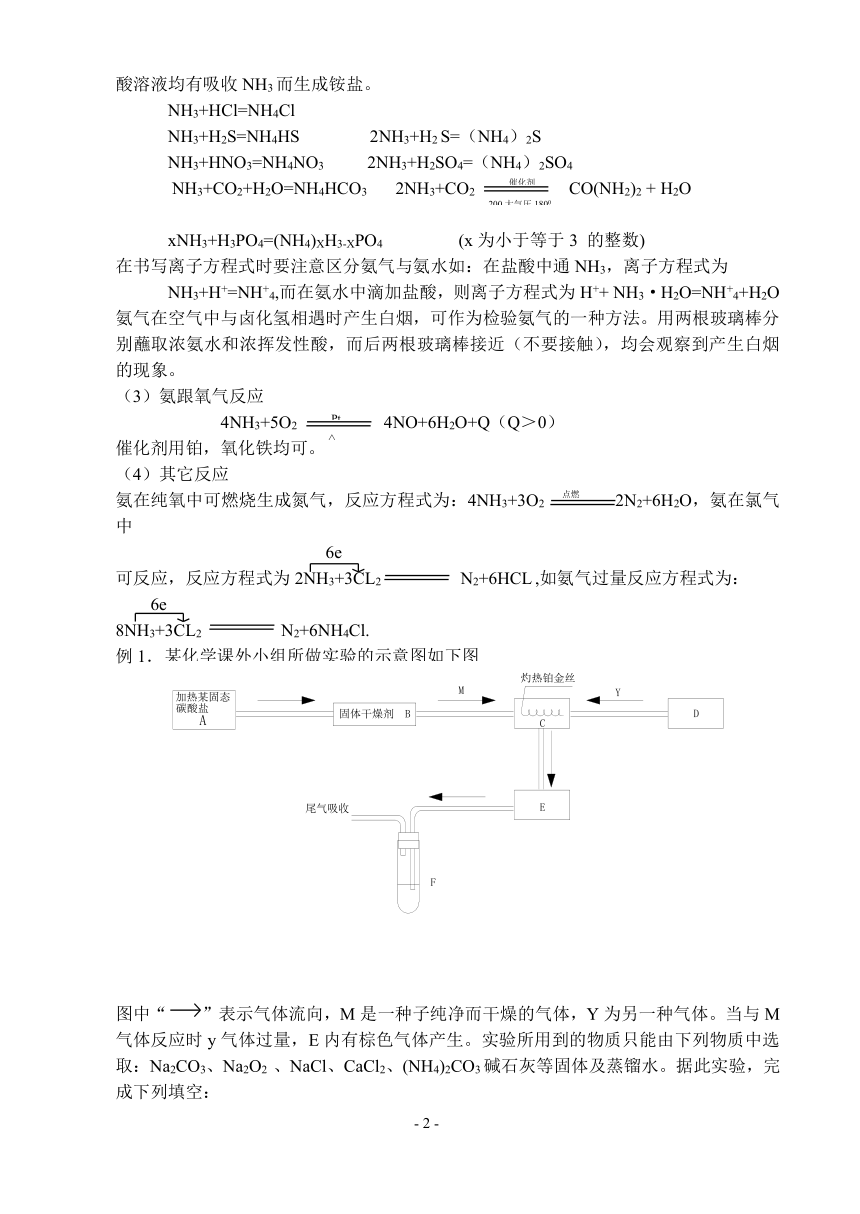
例1. 某化学课外小组所做实验的示意图如下图
图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
(1) A中所用装置的主要仪器有
(2)B中所选的干燥剂是 ,作用是 。
(3)C中发生的主要反应的化学方程式是
(4)制取y气体的D装置所用的主要仪器是
制取y的化学方程式是 。
(1) 当F中为紫色石蕊试液时,见到的现象是 主要反应方程式为 、 。
解析:解此题抓住两点:①产生C(或E)气体的条件为Pt丝红热②E内有红棕色即为NO2,得知M为NH 3,y为O2,C中有NO、NO2、H2O(g)等。
答案:(1)大试管,铁架台(附铁夹),酒精灯,单孔塞和玻璃管。
(2) 碱石灰,既除去水蒸气又除去CO2.
(3)4NH3+5O2 Pt 4NO+6H2O (气)
(4)平底烧瓶,分液漏斗,胶塞 ,导管(用锥形瓶代替平底烧瓶也可)
2Na2O2 +2H2O = 4NaOH + O 2
(5)紫色石蕊试液变红,3NO2+H2O=2HNO3+NO,HNO3=H++NO –3。
例2. 在室温时有50ml的混合气体,它们可能由HCl、NH3、CO2、NO组成。将这些混合气体通过浓H2SO4后体积减少为35ml ,再通过过量的过氧化钠气体体积又减少为20ml,最后将气体通过水,充分反应后只剩下10ml 气体。(所有气体体积在同温同压下测定)求:
1 混合气体由哪些气体组成?它们的各占多少毫升?
2 最后剩余气体是什么气体?
解析:50ml混合气体通过浓H2SO4体积减少为35ml,则NH3体积为50ml-35ml=15ml。由此确定无HCl。由题意可知还有CO2和NO。设含CO2为xml,NO为yml,若最后10ml为NO,则由:3NO2+H2O=2HNO3+NO可知需NO 2为30ml>20ml,不合题意,若最后10ml为O2,则由4NO+3O2+2H2O=4HNO3可知ymlNO需消耗ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O 2为ml, 解得
则NH3为15ml,CO2为29ml,NO为6ml
答案:①混合气体由29mlCO2,15mlNH3,6mlNO组成。②剩余气体为O2,其体积为10ml.
二、氨气制法
1. 工业制法其反应方程式:
N2+3H2 高温、高压2NH3
2. 实验室制法
1 药品:铵盐(氯化铵)与消石灰固体混合加热
②反应方程式:2NH4Cl +Ca(OH)2 ? CaCl2+2NH3 +2H 2O ↑
③装置:固体 加热 气体,同于实验室用KClO3和MnO2固体混合加热制O2装置
④干燥:常用碱石灰作干燥剂,不能用酸性干燥剂如浓H2SO4、P2O5等。
⑤收集:只能用向下排空气法。
⑥验满:用湿润的红色石蕊试纸放在试管口,也可用玻璃棒蘸有浓氨水,靠近试管口。
⑦注意:a.棉花的作用为防止气体对流,提高收集氨气的速率和纯度。b.不使用NaOH的原因是加热时NaOH碱性强,容易腐蚀试管。消石灰碱性相对弱,且比较疏松,氨气容易逸出。c.制取干燥氨气也不能用CaCl2作干燥剂,原因是CaCl2和NH3加合生成CaCl2·8NH3。
例3 在密闭容器中,放入碳酸铵和氢氧化钠固体共Ag,将容器加热至200℃,经充分反应后,排出其中气体,冷却后称得剩余固体的质量为Bg,问容器内碳酸铵和氢氧化钠各多少克?
解析:可能发生如下反应:
(NH4)2CO2 + 2NaOH === 2NH3↑+ 2H2O + Na2CO3 ………①
(NH4)2CO3 === 2NH3↑+ CO2↑+ H2O↑……………………②
在加热过程中应首先发生反应①,只有当(NH4)2CO3过量时才能继续发生反应②。并由以上反应可以看出,NaOH过量时减重少,残留固体只有两种情况。一当(NH4)2CO3正好作用或过量时残留物为Na2CO3,二当NaOH过量时残留物为Na2CO3和NaOH的混合物,下面分别讨论。
10据反应(NH4)2CO3 + 2NaOH === Na2CO3 + 2NH3↑+ 2H2O↑
96 80
176 106 34 36
A B
当A/B=176/106即A=B时,两者恰好反应
20当NaOH过量时,即A>B时,根据减少质量确定(NH4)2CO3质量
30当(NH4)2CO3过量,即A答案:(1)当(NH4)2CO3过量或正好作用时
(2)当NaOH过量时,
三、铵盐的性质
1. 铵盐都是晶体,都易溶于水
2. 铵盐受热分解
NH4Cl === NH3↑+ HCl↑ (现象类似“升华”)
NH4HCO3 === NH3↑+ H2O + CO2↑
(NH4)2CO3 === 2NH3↑+ CO2↑+ H2O↑
(NH4)3PO4 === 3NH3↑+ H3PO4
(NH4)2SO4 === 2NH3 + H2SO4 (温度不可过高)
NH4NO3受热也分解,但产物较复杂。
一些不稳定的无氧酸铵盐的受热分解:
2NH4I △ 2NH3↑+H2↑+I2
NH4HS △ NH3↑+H2↑+S
(NH4)2S △ 2HN3↑+H2↑+S
3.铵盐跟碱的反应
固态铵盐与固态的强碱混和加热或研磨可起反应放出氨气。例如:(NH4)2SO4+2NaOH △ Na2SO4+2NH3↑+2H2O,实验室里就利用这样的反应来制取氨,同时也可以利用这个性质来检验铵离子的存在。
氨盐和氢氧化钠在溶液中反应、加热或不加热时书写离子方程式不同:
NH4++OH- △ NH3↑+H2O
NH4++OH-=NO3·H2O
检验溶液中的NH4+,可采取加碱(OH-)、加热、用湿润红色石蕊试纸检验产生的气体的操作方法。
【能力训练】
一、选择题:
1.下列气体中最易液化的是
A.N2 B.O2 C.NH3 D.H2
2.既能用浓硫酸,又能用碱石灰干燥的气体是
A.Cl2 B.SO2 C.NO D.NH3
3.下列物质中既能与稀硫酸反应,又能与烧碱溶液反应的是
A.NH4Cl B.NH4HS C.NaHCO3 D.FeS
4.下列各组物质的空间构型完全不同的是
A.NH3和H3O+ B.NH4+和CH4
C.CO2和SiO2 D.金刚石和晶体硅
5.下列各组气体,在通常条件下能稳定共存的是
A.NH3、O2、HCl B.N2、H2、HCl
C.CO2、NO、O2 D.H2S、O2、SO2
6.某混合气体可能有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象),氢氧化钡溶液(有浑浊现象)。浓H2SO4、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气体中一定有
A.HCl、CO2、H2 B.CO、H2、H2O
C.CO、H2、NH3 D.HCl、CO、H2O
7.氨水中含氮的微粒最多的是
A.NH3 B.NH3·H2O C.NH4+ D.OH-
8.下列混合物可用加热方法分离的是
A.碘和氯化铵 B.硫酸钾和氯酸钾
C.氯化铵和硫酸钡 D.碳酸氢钠和碳酸氢铵
9.限用一种试剂,经过一次性实验就能鉴别Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,应选用
A.AgNO3溶液 B.NaOH溶液
C.Ba(OH)2溶液 D.盐酸
10.下列各组离子在水溶液中能大量共存的是
A.CO32-、H+、HCO3-、Ca2+ B.NH4+、OH-、Ba2+、NO3-
C.I-、ClO-、NO3-、H+ D.SO32-、SO42-、Na+、OH-
二、填空
11.A.B.C三种气体,A为无色,在一定条件下A能与O2反应生成B;B不溶于水,它能与O2反应生成C;A.C气体均溶于水,其水溶液分别呈碱性与酸性。推断。A 、C 。
12.将aL含(NH4)2SO4与NH4NO3的混合液平均分成两份,向一份中加入b mol烧碱,加热恰好将其中NH3全部赶出,向另一份中加入BaCl2溶液完全反应。消耗c mol BaCl2,原溶液中NO3-的物质的量浓度为 。
三、计算
13.350体积(标准状况)的氨气溶解在1体积的水里,求这种氨水的质量分数和物质的量浓度。(该氨水的密度为0.924g/mL)
【能力训练答案】
1、 选择题
1、C 2、C 3、B C 4、C 5、B 6、A 7、B
8、C 9、C 10、D
2、 填空
11、NH3、NO2
12、
3、 计算
13、
△
催化剂
△
△
200大气压1800
H
H
△
△
△
△
△
PAGE
- 1 -
第八章《氮族元素》高三化学复习教案(二)
【教学内容】
氨 铵盐
【教学目标】
1.认识氨分子的结构,记住氨的物理性质。
2.掌握氨的化学性质,初步掌握氨水显弱碱性的原因。
3.掌握实验室制取氨的反应原理,仪器装置、收集、检验及干燥方法。
4.了解铵盐的组成,掌握铵盐的部分物理性质和化学性质。
5.掌握铵离子的检验方法。
6.了解氨、铵盐的用途。
【知识讲解】
一、氨(NH3)
1.氨分子的结构
电子式H N H,结构式H—N—H,呈三角锥形,键盘107o18′,极性分子。
2.物理性质
无色,而有刺激气味的气体,比空气轻,极易溶于水,易液化。氨水的浓度越大,密度越小。
说明:氨极易溶于水,可做喷泉实验,该实验成败的关键:①装置必须密闭 ②仪器必须
干燥 ③气体尽量集满。在标准状况下进行该实验。氨气的体积即为溶液的体积,
其。
3.化学性质
氨分子中氮原子上还有一对孤对电子,易接受质子。因此水合能力较强易与H+反应即
与酸反应。氨气中氮元素为-3价即氮的最低价态。因此在一定条件能被氧气。
(1)氨跟水的反应
NH3+H2O NH3·H2O NH+4 +OH-
氨气溶于水大部分与水作用生成了NH3·H2O,而NH3·H2O 只有少数发了电离而生成NH+4和OH-,因此冷却浓氨水可析出NH3·H2O晶体。在氨的水溶液中存在的分子有:H2O、NH3、NH3·H2O,存在的离子有NH+4 、OH-、H+(极少量是由水电离而产生的),因此氨水是混合物。液氨不导电,而氨水能导电。
氨水中主要成分是NH3·H2O,但溶质是NH3,因此表示浓度均以NH3表示。
氨气能使湿润的红色石蕊试纸变蓝(检验氨气方法之一)。
(2)氨跟酸的反应
酸溶液均有吸收NH3而生成铵盐。
NH3+HCl=NH4Cl
NH3+H2S=NH4HS 2NH3+H2 S=(NH4)2S
NH3+HNO3=NH4NO3 2NH3+H2SO4=(NH4)2SO4
NH3+CO2+H2O=NH4HCO3 2NH3+CO2 催化剂 CO(NH2)2 + H2O
xNH3+H3PO4=(NH4)XH3-XPO4 (x为小于等于3 的整数)
在书写离子方程式时要注意区分氨气与氨水如:在盐酸中通NH3,离子方程式为
NH3+H+=NH+4,而在氨水中滴加盐酸,则离子方程式为H++ NH3·H2O=NH+4+H2O
氨气在空气中与卤化氢相遇时产生白烟,可作为检验氨气的一种方法。用两根玻璃棒分别蘸取浓氨水和浓挥发性酸,而后两根玻璃棒接近(不要接触),均会观察到产生白烟的现象。
(3)氨跟氧气反应
4NH3+5O2 Pt 4NO+6H2O+Q(Q>0)
催化剂用铂,氧化铁均可。
(4)其它反应
氨在纯氧中可燃烧生成氮气,反应方程式为:4NH3+3O2 点燃 2N2+6H2O,氨在氯气中
6e
可反应,反应方程式为2NH3+3CL2 N2+6HCL ,如氨气过量反应方程式为:
6e
8NH3+3CL2 N2+6NH4Cl.
例1. 某化学课外小组所做实验的示意图如下图
图中“ ”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
(1) A中所用装置的主要仪器有
(2)B中所选的干燥剂是 ,作用是 。
(3)C中发生的主要反应的化学方程式是
(4)制取y气体的D装置所用的主要仪器是
制取y的化学方程式是 。
(1) 当F中为紫色石蕊试液时,见到的现象是 主要反应方程式为 、 。
解析:解此题抓住两点:①产生C(或E)气体的条件为Pt丝红热②E内有红棕色即为NO2,得知M为NH 3,y为O2,C中有NO、NO2、H2O(g)等。
答案:(1)大试管,铁架台(附铁夹),酒精灯,单孔塞和玻璃管。
(2) 碱石灰,既除去水蒸气又除去CO2.
(3)4NH3+5O2 Pt 4NO+6H2O (气)
(4)平底烧瓶,分液漏斗,胶塞 ,导管(用锥形瓶代替平底烧瓶也可)
2Na2O2 +2H2O = 4NaOH + O 2
(5)紫色石蕊试液变红,3NO2+H2O=2HNO3+NO,HNO3=H++NO –3。
例2. 在室温时有50ml的混合气体,它们可能由HCl、NH3、CO2、NO组成。将这些混合气体通过浓H2SO4后体积减少为35ml ,再通过过量的过氧化钠气体体积又减少为20ml,最后将气体通过水,充分反应后只剩下10ml 气体。(所有气体体积在同温同压下测定)求:
1 混合气体由哪些气体组成?它们的各占多少毫升?
2 最后剩余气体是什么气体?
解析:50ml混合气体通过浓H2SO4体积减少为35ml,则NH3体积为50ml-35ml=15ml。由此确定无HCl。由题意可知还有CO2和NO。设含CO2为xml,NO为yml,若最后10ml为NO,则由:3NO2+H2O=2HNO3+NO可知需NO 2为30ml>20ml,不合题意,若最后10ml为O2,则由4NO+3O2+2H2O=4HNO3可知ymlNO需消耗ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O 2为ml, 解得
则NH3为15ml,CO2为29ml,NO为6ml
答案:①混合气体由29mlCO2,15mlNH3,6mlNO组成。②剩余气体为O2,其体积为10ml.
二、氨气制法
1. 工业制法其反应方程式:
N2+3H2 高温、高压2NH3
2. 实验室制法
1 药品:铵盐(氯化铵)与消石灰固体混合加热
②反应方程式:2NH4Cl +Ca(OH)2 ? CaCl2+2NH3 +2H 2O ↑
③装置:固体 加热 气体,同于实验室用KClO3和MnO2固体混合加热制O2装置
④干燥:常用碱石灰作干燥剂,不能用酸性干燥剂如浓H2SO4、P2O5等。
⑤收集:只能用向下排空气法。
⑥验满:用湿润的红色石蕊试纸放在试管口,也可用玻璃棒蘸有浓氨水,靠近试管口。
⑦注意:a.棉花的作用为防止气体对流,提高收集氨气的速率和纯度。b.不使用NaOH的原因是加热时NaOH碱性强,容易腐蚀试管。消石灰碱性相对弱,且比较疏松,氨气容易逸出。c.制取干燥氨气也不能用CaCl2作干燥剂,原因是CaCl2和NH3加合生成CaCl2·8NH3。
例3 在密闭容器中,放入碳酸铵和氢氧化钠固体共Ag,将容器加热至200℃,经充分反应后,排出其中气体,冷却后称得剩余固体的质量为Bg,问容器内碳酸铵和氢氧化钠各多少克?
解析:可能发生如下反应:
(NH4)2CO2 + 2NaOH === 2NH3↑+ 2H2O + Na2CO3 ………①
(NH4)2CO3 === 2NH3↑+ CO2↑+ H2O↑……………………②
在加热过程中应首先发生反应①,只有当(NH4)2CO3过量时才能继续发生反应②。并由以上反应可以看出,NaOH过量时减重少,残留固体只有两种情况。一当(NH4)2CO3正好作用或过量时残留物为Na2CO3,二当NaOH过量时残留物为Na2CO3和NaOH的混合物,下面分别讨论。
10据反应(NH4)2CO3 + 2NaOH === Na2CO3 + 2NH3↑+ 2H2O↑
96 80
176 106 34 36
A B
当A/B=176/106即A=B时,两者恰好反应
20当NaOH过量时,即A>B时,根据减少质量确定(NH4)2CO3质量
30当(NH4)2CO3过量,即A
(2)当NaOH过量时,
三、铵盐的性质
1. 铵盐都是晶体,都易溶于水
2. 铵盐受热分解
NH4Cl === NH3↑+ HCl↑ (现象类似“升华”)
NH4HCO3 === NH3↑+ H2O + CO2↑
(NH4)2CO3 === 2NH3↑+ CO2↑+ H2O↑
(NH4)3PO4 === 3NH3↑+ H3PO4
(NH4)2SO4 === 2NH3 + H2SO4 (温度不可过高)
NH4NO3受热也分解,但产物较复杂。
一些不稳定的无氧酸铵盐的受热分解:
2NH4I △ 2NH3↑+H2↑+I2
NH4HS △ NH3↑+H2↑+S
(NH4)2S △ 2HN3↑+H2↑+S
3.铵盐跟碱的反应
固态铵盐与固态的强碱混和加热或研磨可起反应放出氨气。例如:(NH4)2SO4+2NaOH △ Na2SO4+2NH3↑+2H2O,实验室里就利用这样的反应来制取氨,同时也可以利用这个性质来检验铵离子的存在。
氨盐和氢氧化钠在溶液中反应、加热或不加热时书写离子方程式不同:
NH4++OH- △ NH3↑+H2O
NH4++OH-=NO3·H2O
检验溶液中的NH4+,可采取加碱(OH-)、加热、用湿润红色石蕊试纸检验产生的气体的操作方法。
【能力训练】
一、选择题:
1.下列气体中最易液化的是
A.N2 B.O2 C.NH3 D.H2
2.既能用浓硫酸,又能用碱石灰干燥的气体是
A.Cl2 B.SO2 C.NO D.NH3
3.下列物质中既能与稀硫酸反应,又能与烧碱溶液反应的是
A.NH4Cl B.NH4HS C.NaHCO3 D.FeS
4.下列各组物质的空间构型完全不同的是
A.NH3和H3O+ B.NH4+和CH4
C.CO2和SiO2 D.金刚石和晶体硅
5.下列各组气体,在通常条件下能稳定共存的是
A.NH3、O2、HCl B.N2、H2、HCl
C.CO2、NO、O2 D.H2S、O2、SO2
6.某混合气体可能有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象),氢氧化钡溶液(有浑浊现象)。浓H2SO4、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气体中一定有
A.HCl、CO2、H2 B.CO、H2、H2O
C.CO、H2、NH3 D.HCl、CO、H2O
7.氨水中含氮的微粒最多的是
A.NH3 B.NH3·H2O C.NH4+ D.OH-
8.下列混合物可用加热方法分离的是
A.碘和氯化铵 B.硫酸钾和氯酸钾
C.氯化铵和硫酸钡 D.碳酸氢钠和碳酸氢铵
9.限用一种试剂,经过一次性实验就能鉴别Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,应选用
A.AgNO3溶液 B.NaOH溶液
C.Ba(OH)2溶液 D.盐酸
10.下列各组离子在水溶液中能大量共存的是
A.CO32-、H+、HCO3-、Ca2+ B.NH4+、OH-、Ba2+、NO3-
C.I-、ClO-、NO3-、H+ D.SO32-、SO42-、Na+、OH-
二、填空
11.A.B.C三种气体,A为无色,在一定条件下A能与O2反应生成B;B不溶于水,它能与O2反应生成C;A.C气体均溶于水,其水溶液分别呈碱性与酸性。推断。A 、C 。
12.将aL含(NH4)2SO4与NH4NO3的混合液平均分成两份,向一份中加入b mol烧碱,加热恰好将其中NH3全部赶出,向另一份中加入BaCl2溶液完全反应。消耗c mol BaCl2,原溶液中NO3-的物质的量浓度为 。
三、计算
13.350体积(标准状况)的氨气溶解在1体积的水里,求这种氨水的质量分数和物质的量浓度。(该氨水的密度为0.924g/mL)
【能力训练答案】
1、 选择题
1、C 2、C 3、B C 4、C 5、B 6、A 7、B
8、C 9、C 10、D
2、 填空
11、NH3、NO2
12、
3、 计算
13、
△
催化剂
△
△
200大气压1800
H
H
△
△
△
△
△
PAGE
- 1 -
同课章节目录
