高考化学试题.doc[上学期]
图片预览


文档简介
高考化学能力测试题
山东省广饶第一中学257300杨会平
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Fe 56 Cu 64
第Ⅰ卷(选择题,共72分)
一.选择题(本题包括18小题,每小题4分,每小题只有一个答案)
1.我国城市环境中的大气污染物主要是()
A.CO、Cl、N、酸雨 B.SO、CO、NO、烟尘
C.NH、CO、NO 、雾 D.HCl、SO、N、粉尘
2.关于氢键的下列说法中正确的是()
A.每个水分子内含有两个氢键 B.在水蒸气、水和冰中都含有氢键
C.分子间能形成氢键使物质的熔点和沸点升高 D.HF的稳定性很强,是因为其分子间能形成氢键
3.如图是某种有机物分子的球棍模型图。图中的“棍”代表
单键或双键,不同大小的“球”代表不同的短周期元素的原
子.对该有机物的叙述不正确是()
A.该有机物可能的分子式为CHCl
B.该有机物分子中一定有碳碳双键 C.该有机物分子中的所有
原子在一个平面上 D.该有机物可以由乙炔和氯化氢加成反应得到
4.在下列物质的溶液中分别加入一定量的NaO固体,不会出现浑浊现象的是()
A.饱和硫化氢溶液B.饱和氯化钙溶液C.碳酸氢钙溶液D.亚硫酸钠溶液
5.下列各组化合物中,不论以何种比例混合,只要总质量不变,完全燃烧消耗O的质量和生成HO和CO的质量均不变的是()
A.CH、CH B.CH、CH
C.HCHO、CHCOOH D.CH、CH
6.下列说法正确的是()
A.微粒半径:Na>Mg>O>F B.密度:浓硫酸>氨水>水>煤油
C.熔沸点:金刚石>晶体硅>SiC>SiCl D.稳定性:HF>HO>NH>CH
7.已知某溶液中滴加酚酞试液显红色,其中能大量存在的离子是()
A.NH、Ba、AlO、Cl B.SO、NO、Fe、Al
C. Cl、SO、Na、K D.Na、K、HCO、Cl
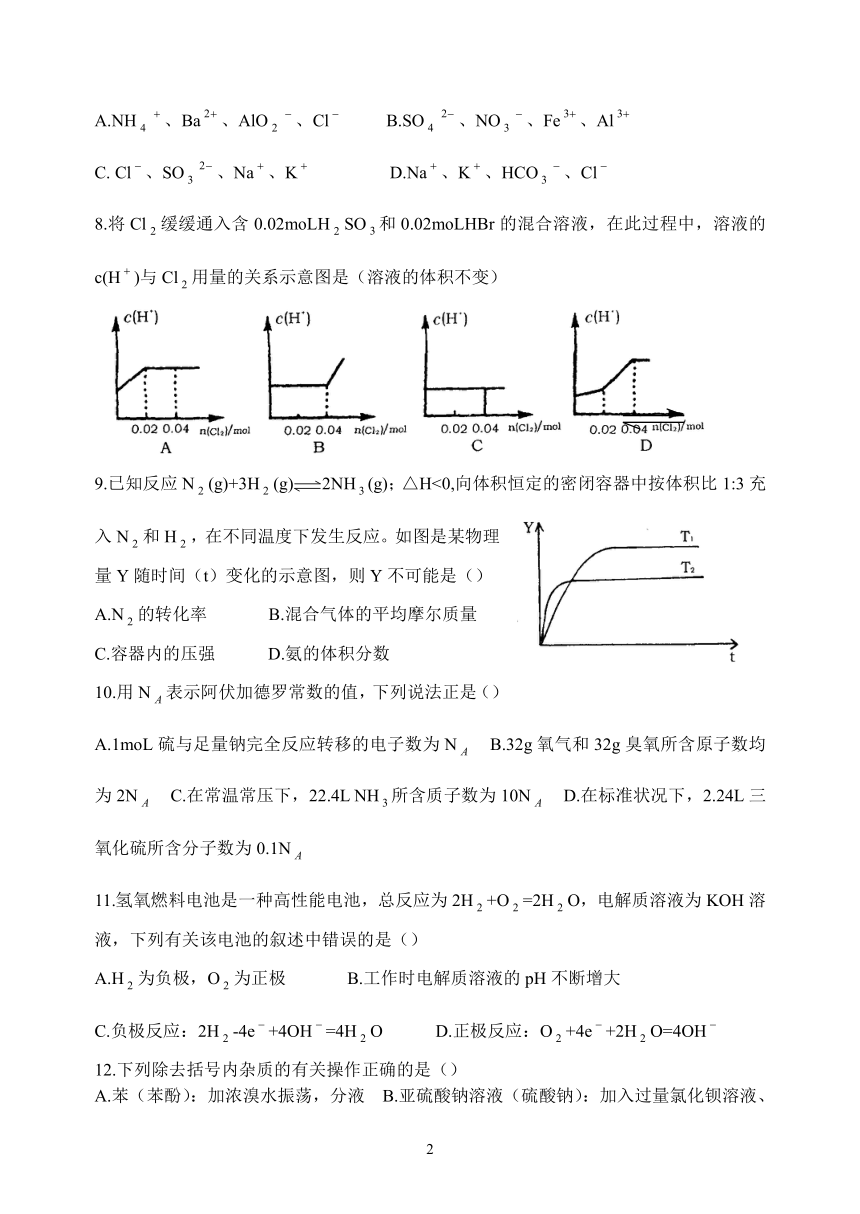
8.将Cl缓缓通入含0.02moLHSO和0.02moLHBr的混合溶液,在此过程中,溶液的c(H)与Cl用量的关系示意图是(溶液的体积不变)
9.已知反应N(g)+3H(g)2NH(g);△H<0,向体积恒定的密闭容器中按体积比1:3充入N和H,在不同温度下发生反应。如图是某物理量Y随时间(t)变化的示意图,则Y不可能是()
A.N的转化率 B.混合气体的平均摩尔质量
C.容器内的压强 D.氨的体积分数
10.用N表示阿伏加德罗常数的值,下列说法正是()
A.1moL硫与足量钠完全反应转移的电子数为N B.32g氧气和32g臭氧所含原子数均为2N C.在常温常压下,22.4L NH所含质子数为10N D.在标准状况下,2.24L三氧化硫所含分子数为0.1N
11.氢氧燃料电池是一种高性能电池,总反应为2H+O=2HO,电解质溶液为KOH溶液,下列有关该电池的叙述中错误的是()
A.H为负极,O为正极 B.工作时电解质溶液的pH不断增大
C.负极反应:2H-4e+4OH=4HO D.正极反应:O+4e+2HO=4OH
12.下列除去括号内杂质的有关操作正确的是()
A.苯(苯酚):加浓溴水振荡,分液 B.亚硫酸钠溶液(硫酸钠):加入过量氯化钡溶液、过滤 C.肥皂液(甘油):加食盐颗粒,过滤 D.乙酸乙酯(乙酸):加NaOH溶液,蒸馏
13.下列反应的离子方程式中正确的是()
A.钠和冷水:Na+2HO=Na+2OH+H B.向Ca(ClO)溶液中通入SO:Ca+2ClO+SO+HO=CaSO↓+2HClO C.碳酸钙中加入盐酸:CO+2H=CO↑+HO D.氯化铝溶液中加入过量氨水:Al+3NH·HO=Al(OH)↓+3NH
14.下列说法或表示方法中正确的是()
A.等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 B.氢气的燃烧热为285.8kJ·moL,则氢气燃烧的热化学方程式为2H(g)+O(g)=2HO(l);△H=-285.8kJ·moL C.Ba(OH)·8HO(s)+2NHCl(s)=BaCl(s)+2NH(g)+10 HO(l);△H<0 D.已知中和热为57.3kJ·moL,若将含0.5moLHSO的浓溶液与含1moLNaOH的溶液混合,放出的热量大于57.3kJ
15.CH=CH—CH—CH(OH)—COOH在不同条件下可能发生以下不同类型的反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚。其中与—OH有关的反应是()
A.③④⑤ B.①④⑥ C.①③④ D.②③④⑤
16.有机物甲是一种包含有一个六元环结构的化合物,其分子式为CHO,在酸性条件下可以发生水解,且水解产物只有一种,则甲的可能结构有()
A.3种 B.4种 C.5种 D.6种
17.将amLNO、bmLNO、xmLO混合于同一集气瓶内,把集气瓶倒立在水中,充分反应后瓶内气体全部溶解,则x对a、b的函数关系式x=f(a,b)是()
A.(a+b)∕2 B.(2a+b)∕3 C.(3a+b)∕4 D.(4a+b)∕5
18.已知在100mL硫酸、硫酸亚铁、硫酸铁的混合溶液中,各阳离子的物质的量浓度相等,硫酸根离子的浓度为6mol·L,则此溶液可溶解铁粉为()
A.5.6g B.11.2g C.33.6g D.10.6g
第Ⅱ卷(非选择题,共78分)
二.实验题(本题包括2小题,共24分)
19.(11分)在75℃左右,用HgSO做催化剂,乙炔可水化为乙醛。但HgSO遇到某些特定物质常会发生催化剂中毒而失去催化作用,HS就是其中的一种。现有块状电石、浓硫酸、水、NaOH溶液、CuSO溶液、氧化汞粉末六种物质,
试用乙炔水化法制取并验证乙醛(装置如图)。请回答以下问题:
(1)实验开始时,仪器A中盛放电石,B中应装入_____,其作用是_________。
(2)仪器D中盛放水,其作用是______________。
(3)蒸馏烧瓶C中应放入氧化汞和另外两种试剂,若将三者分别直接加入,请写出加入物质的先后顺序(包括氧化汞):_________________;将HgO加入C中的操作方法是___________。
(4)装置图中,对C的加热方式应是___________。
(5)检验乙醛已制出的操作、现象是____________________________________________。
检验乙醛的化学方程式是____________________________________。
20.(13分)高一教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论:第一,有氧气生成,第二,____________。NaO跟水反应的化学方程式是_________________,其中还原剂是___________,氧化剂是______________。
(2)某研究性学习小组拟用右图所示装置(气密性良好)进行实验,
以证明上述结论。用以验证第一条结论的实验方法是:___________;
用以验证第二条结论的实验方法是:_______________。
(3)该小组同学提出用定量的方法探究NaO跟水反应后的溶液中是否含有HO,其实验方法为:称取2.6g NaO固体,使之与足量的水反应,测量产生氧气的体积并与理论值比较,即可得出结论。
①测量气体体积时,必须待试管和量筒内
的气体都冷却至室温时进行,应选用如图装置中的(忽略导管在量筒中所占的体积)______________(填序号),理由是___________________________________。②若在标准状况下测量气体的体积,应选用的量筒的大小规格为___________(选填100mL、200mL、500mL、1000mL)。
三.无机题(本题包括2小题,共16分)
21.(6分)A、B、C、D、E五种微粒(分子或离子),它们都分别含有10个电子,已知它们有如下转化关系:(1)A+ C→D+E↑ (2)B+C→2D
写出(1)的离子方程式___________________________________。
写出(2)的离子方程式___________________________________。
22(10分)某二元酸(化学式用HA表示)在水中的电离方程式是HA=H+HA、
HAH+A回答下列问题:
(1)NaA溶液显_______(填酸性、中性、碱性)。原因是(用离子方程式表示)_____________________________。
(2)在0.1mol·L的NaA溶液中,下列微粒浓度关系不正确的是_______。
A.c(A)+c(HA)+c(HA)=0.1mol·L
B.c(H)=c(OH)+c(HA)
C.c(Na)+c(H)=c(OH)+c(HA)+2c(A)
D.c(Na)=2c(A)+2c(HA)
(3)已知0.1mol·LNaHA溶液的pH=2,则0.1mol·L的HA溶液中氢离子的物质的量浓度________0.11 mol·L(填﹤、﹥、=),理由是__________________________。
四.有机题(本题包括2小题,共20分)
23.(10分)根据下列转化关系回答:
(1)化合物C含有的官能团有________________________________。
(2)反应④需加入的试剂是__________,⑥的反应类型是____________。
(3)写出下列反应的化学方程式:
反应①______________________________________________;
反应⑦______________________________________________。
24.(10分)某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用,不仅可以提高经济效益,而且还能防止环境污染,现按下列方式进行综合利用。
已知H是具有香味的液体,F为E的三聚物,并且有特殊的六元环状对称结构。
(1)A的名称是___________;F的结构式为___________________。
(2)H的其同类物的异构体还有(写结构简式)__________________________________________________________________。
(3)写出D→E的化学方程式:______________________________________。
写出B→C的离子方程式:_______________________________________。
五.计算题(本题包括2小题,共18分)
25.(8分)0.3moL某有机物和0.6moLO在密闭容器中引燃后充分反应,产物为CO、CO和HO(g)。产物经过浓硫酸后,浓硫酸的质量增加16.2g;再通过灼热的CuO,充分反应后,固体质量减轻4.8g;最后气体再通过碱石灰被完全吸收,碱石灰增重26.4g。
(1)推断该有机物的分子式。
(2)若0.2moL该有机物恰好和9.2g金属钠完全反应,试确定该有机物的结构简式。
26.(10分)537℃某容器中充入2moLSO、1moLO,此时容器的体积为200L,向容器中加入固体催化剂并保持恒温恒压,发生反应:2SO(g)+O(g)2SO(g)。达到平衡时,平衡混和气中SO的体积分数为0.91。试回答下列问题:
(1)工业上SO的催化氧化常采用常压而不采用高压的原因是:___________。
(2)保持上述温度和压强不变,若向容器中只充入2moLSO,并加入固体催化剂,则平衡时,SO的体积分数是________,容器的体积为___________L。
(3)若仍保持上述温度和压强不变。充入amoLSO、bmoLO、cmoLSO,反应达到平衡时,SO的体积分数仍为0.91。则a、b、c之间的关系为______________.
参考答案:1.B2.C3.D4.D5.C6.D7.C8.A9.C10.B11.B12.C13.D14.D15.D16.B17.C18.B
19.(1)NaOH溶液(或CuSO溶液);除去气流中的HS杂质。(2)吸收乙醛蒸气。
(3)HgO、HO、HSO;将蒸馏烧瓶侧管向上横放,用小药匙或纸槽将HgO粉末送入烧瓶底部再慢慢直立。(4)水浴加热。(5)用NaOH溶液与CuSO溶液反应制得Cu(OH)悬浊液,取D中溶液少量,加入新制的Cu(OH)悬浊液并加热,产生砖红色沉淀证明乙醛已生成。CHCHO+2Cu(OH)→CHCOOH+CuO↓+2HO
20.(1)该反应是放热反应;2NaO+2HO=4NaOH+O↑;NaO;NaO
(2)将带火星的木条靠近导管口P处,木条复燃;将导管q浸入水中,反应过程中导管口有气泡冒出。
(3)①II;防止气体冷却时发生倒吸现象。②500mL
21.(1)NH+OH=NH↑+HO(2)HO+OH=2HO
22.(1)碱性;A+HOHA+OH(2)A、B
(3)﹤;HA第一步完全电离生成的H抑制了HA的电离。
23.(1)醛基、羧基、羟基(2)碳酸氢钠溶液,加成反应
(3)
24.(1)纤维素;
(2)CHCOOCH、HCOOCHCHCH、HCOOCH(CH)
(3)CHOH+CuO→CHCHO+HO+Cu;
CHOH(CHOH)CHO+2〔Ag(CH)〕+2OH→CHOH(CHOH)COOH+2Ag↓+HO+4CH
25.(1)CHO(2)HO—CHCH—OH
26.(1)常压时二氧化硫的转化率已经很高。(2)6%;137.5(3)a:b=2:1,c为任意值
PAGE
1
山东省广饶第一中学257300杨会平
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Fe 56 Cu 64
第Ⅰ卷(选择题,共72分)
一.选择题(本题包括18小题,每小题4分,每小题只有一个答案)
1.我国城市环境中的大气污染物主要是()
A.CO、Cl、N、酸雨 B.SO、CO、NO、烟尘
C.NH、CO、NO 、雾 D.HCl、SO、N、粉尘
2.关于氢键的下列说法中正确的是()
A.每个水分子内含有两个氢键 B.在水蒸气、水和冰中都含有氢键
C.分子间能形成氢键使物质的熔点和沸点升高 D.HF的稳定性很强,是因为其分子间能形成氢键
3.如图是某种有机物分子的球棍模型图。图中的“棍”代表
单键或双键,不同大小的“球”代表不同的短周期元素的原
子.对该有机物的叙述不正确是()
A.该有机物可能的分子式为CHCl
B.该有机物分子中一定有碳碳双键 C.该有机物分子中的所有
原子在一个平面上 D.该有机物可以由乙炔和氯化氢加成反应得到
4.在下列物质的溶液中分别加入一定量的NaO固体,不会出现浑浊现象的是()
A.饱和硫化氢溶液B.饱和氯化钙溶液C.碳酸氢钙溶液D.亚硫酸钠溶液
5.下列各组化合物中,不论以何种比例混合,只要总质量不变,完全燃烧消耗O的质量和生成HO和CO的质量均不变的是()
A.CH、CH B.CH、CH
C.HCHO、CHCOOH D.CH、CH
6.下列说法正确的是()
A.微粒半径:Na>Mg>O>F B.密度:浓硫酸>氨水>水>煤油
C.熔沸点:金刚石>晶体硅>SiC>SiCl D.稳定性:HF>HO>NH>CH
7.已知某溶液中滴加酚酞试液显红色,其中能大量存在的离子是()
A.NH、Ba、AlO、Cl B.SO、NO、Fe、Al
C. Cl、SO、Na、K D.Na、K、HCO、Cl
8.将Cl缓缓通入含0.02moLHSO和0.02moLHBr的混合溶液,在此过程中,溶液的c(H)与Cl用量的关系示意图是(溶液的体积不变)
9.已知反应N(g)+3H(g)2NH(g);△H<0,向体积恒定的密闭容器中按体积比1:3充入N和H,在不同温度下发生反应。如图是某物理量Y随时间(t)变化的示意图,则Y不可能是()
A.N的转化率 B.混合气体的平均摩尔质量
C.容器内的压强 D.氨的体积分数
10.用N表示阿伏加德罗常数的值,下列说法正是()
A.1moL硫与足量钠完全反应转移的电子数为N B.32g氧气和32g臭氧所含原子数均为2N C.在常温常压下,22.4L NH所含质子数为10N D.在标准状况下,2.24L三氧化硫所含分子数为0.1N
11.氢氧燃料电池是一种高性能电池,总反应为2H+O=2HO,电解质溶液为KOH溶液,下列有关该电池的叙述中错误的是()
A.H为负极,O为正极 B.工作时电解质溶液的pH不断增大
C.负极反应:2H-4e+4OH=4HO D.正极反应:O+4e+2HO=4OH
12.下列除去括号内杂质的有关操作正确的是()
A.苯(苯酚):加浓溴水振荡,分液 B.亚硫酸钠溶液(硫酸钠):加入过量氯化钡溶液、过滤 C.肥皂液(甘油):加食盐颗粒,过滤 D.乙酸乙酯(乙酸):加NaOH溶液,蒸馏
13.下列反应的离子方程式中正确的是()
A.钠和冷水:Na+2HO=Na+2OH+H B.向Ca(ClO)溶液中通入SO:Ca+2ClO+SO+HO=CaSO↓+2HClO C.碳酸钙中加入盐酸:CO+2H=CO↑+HO D.氯化铝溶液中加入过量氨水:Al+3NH·HO=Al(OH)↓+3NH
14.下列说法或表示方法中正确的是()
A.等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 B.氢气的燃烧热为285.8kJ·moL,则氢气燃烧的热化学方程式为2H(g)+O(g)=2HO(l);△H=-285.8kJ·moL C.Ba(OH)·8HO(s)+2NHCl(s)=BaCl(s)+2NH(g)+10 HO(l);△H<0 D.已知中和热为57.3kJ·moL,若将含0.5moLHSO的浓溶液与含1moLNaOH的溶液混合,放出的热量大于57.3kJ
15.CH=CH—CH—CH(OH)—COOH在不同条件下可能发生以下不同类型的反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚。其中与—OH有关的反应是()
A.③④⑤ B.①④⑥ C.①③④ D.②③④⑤
16.有机物甲是一种包含有一个六元环结构的化合物,其分子式为CHO,在酸性条件下可以发生水解,且水解产物只有一种,则甲的可能结构有()
A.3种 B.4种 C.5种 D.6种
17.将amLNO、bmLNO、xmLO混合于同一集气瓶内,把集气瓶倒立在水中,充分反应后瓶内气体全部溶解,则x对a、b的函数关系式x=f(a,b)是()
A.(a+b)∕2 B.(2a+b)∕3 C.(3a+b)∕4 D.(4a+b)∕5
18.已知在100mL硫酸、硫酸亚铁、硫酸铁的混合溶液中,各阳离子的物质的量浓度相等,硫酸根离子的浓度为6mol·L,则此溶液可溶解铁粉为()
A.5.6g B.11.2g C.33.6g D.10.6g
第Ⅱ卷(非选择题,共78分)
二.实验题(本题包括2小题,共24分)
19.(11分)在75℃左右,用HgSO做催化剂,乙炔可水化为乙醛。但HgSO遇到某些特定物质常会发生催化剂中毒而失去催化作用,HS就是其中的一种。现有块状电石、浓硫酸、水、NaOH溶液、CuSO溶液、氧化汞粉末六种物质,
试用乙炔水化法制取并验证乙醛(装置如图)。请回答以下问题:
(1)实验开始时,仪器A中盛放电石,B中应装入_____,其作用是_________。
(2)仪器D中盛放水,其作用是______________。
(3)蒸馏烧瓶C中应放入氧化汞和另外两种试剂,若将三者分别直接加入,请写出加入物质的先后顺序(包括氧化汞):_________________;将HgO加入C中的操作方法是___________。
(4)装置图中,对C的加热方式应是___________。
(5)检验乙醛已制出的操作、现象是____________________________________________。
检验乙醛的化学方程式是____________________________________。
20.(13分)高一教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论:第一,有氧气生成,第二,____________。NaO跟水反应的化学方程式是_________________,其中还原剂是___________,氧化剂是______________。
(2)某研究性学习小组拟用右图所示装置(气密性良好)进行实验,
以证明上述结论。用以验证第一条结论的实验方法是:___________;
用以验证第二条结论的实验方法是:_______________。
(3)该小组同学提出用定量的方法探究NaO跟水反应后的溶液中是否含有HO,其实验方法为:称取2.6g NaO固体,使之与足量的水反应,测量产生氧气的体积并与理论值比较,即可得出结论。
①测量气体体积时,必须待试管和量筒内
的气体都冷却至室温时进行,应选用如图装置中的(忽略导管在量筒中所占的体积)______________(填序号),理由是___________________________________。②若在标准状况下测量气体的体积,应选用的量筒的大小规格为___________(选填100mL、200mL、500mL、1000mL)。
三.无机题(本题包括2小题,共16分)
21.(6分)A、B、C、D、E五种微粒(分子或离子),它们都分别含有10个电子,已知它们有如下转化关系:(1)A+ C→D+E↑ (2)B+C→2D
写出(1)的离子方程式___________________________________。
写出(2)的离子方程式___________________________________。
22(10分)某二元酸(化学式用HA表示)在水中的电离方程式是HA=H+HA、
HAH+A回答下列问题:
(1)NaA溶液显_______(填酸性、中性、碱性)。原因是(用离子方程式表示)_____________________________。
(2)在0.1mol·L的NaA溶液中,下列微粒浓度关系不正确的是_______。
A.c(A)+c(HA)+c(HA)=0.1mol·L
B.c(H)=c(OH)+c(HA)
C.c(Na)+c(H)=c(OH)+c(HA)+2c(A)
D.c(Na)=2c(A)+2c(HA)
(3)已知0.1mol·LNaHA溶液的pH=2,则0.1mol·L的HA溶液中氢离子的物质的量浓度________0.11 mol·L(填﹤、﹥、=),理由是__________________________。
四.有机题(本题包括2小题,共20分)
23.(10分)根据下列转化关系回答:
(1)化合物C含有的官能团有________________________________。
(2)反应④需加入的试剂是__________,⑥的反应类型是____________。
(3)写出下列反应的化学方程式:
反应①______________________________________________;
反应⑦______________________________________________。
24.(10分)某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用,不仅可以提高经济效益,而且还能防止环境污染,现按下列方式进行综合利用。
已知H是具有香味的液体,F为E的三聚物,并且有特殊的六元环状对称结构。
(1)A的名称是___________;F的结构式为___________________。
(2)H的其同类物的异构体还有(写结构简式)__________________________________________________________________。
(3)写出D→E的化学方程式:______________________________________。
写出B→C的离子方程式:_______________________________________。
五.计算题(本题包括2小题,共18分)
25.(8分)0.3moL某有机物和0.6moLO在密闭容器中引燃后充分反应,产物为CO、CO和HO(g)。产物经过浓硫酸后,浓硫酸的质量增加16.2g;再通过灼热的CuO,充分反应后,固体质量减轻4.8g;最后气体再通过碱石灰被完全吸收,碱石灰增重26.4g。
(1)推断该有机物的分子式。
(2)若0.2moL该有机物恰好和9.2g金属钠完全反应,试确定该有机物的结构简式。
26.(10分)537℃某容器中充入2moLSO、1moLO,此时容器的体积为200L,向容器中加入固体催化剂并保持恒温恒压,发生反应:2SO(g)+O(g)2SO(g)。达到平衡时,平衡混和气中SO的体积分数为0.91。试回答下列问题:
(1)工业上SO的催化氧化常采用常压而不采用高压的原因是:___________。
(2)保持上述温度和压强不变,若向容器中只充入2moLSO,并加入固体催化剂,则平衡时,SO的体积分数是________,容器的体积为___________L。
(3)若仍保持上述温度和压强不变。充入amoLSO、bmoLO、cmoLSO,反应达到平衡时,SO的体积分数仍为0.91。则a、b、c之间的关系为______________.
参考答案:1.B2.C3.D4.D5.C6.D7.C8.A9.C10.B11.B12.C13.D14.D15.D16.B17.C18.B
19.(1)NaOH溶液(或CuSO溶液);除去气流中的HS杂质。(2)吸收乙醛蒸气。
(3)HgO、HO、HSO;将蒸馏烧瓶侧管向上横放,用小药匙或纸槽将HgO粉末送入烧瓶底部再慢慢直立。(4)水浴加热。(5)用NaOH溶液与CuSO溶液反应制得Cu(OH)悬浊液,取D中溶液少量,加入新制的Cu(OH)悬浊液并加热,产生砖红色沉淀证明乙醛已生成。CHCHO+2Cu(OH)→CHCOOH+CuO↓+2HO
20.(1)该反应是放热反应;2NaO+2HO=4NaOH+O↑;NaO;NaO
(2)将带火星的木条靠近导管口P处,木条复燃;将导管q浸入水中,反应过程中导管口有气泡冒出。
(3)①II;防止气体冷却时发生倒吸现象。②500mL
21.(1)NH+OH=NH↑+HO(2)HO+OH=2HO
22.(1)碱性;A+HOHA+OH(2)A、B
(3)﹤;HA第一步完全电离生成的H抑制了HA的电离。
23.(1)醛基、羧基、羟基(2)碳酸氢钠溶液,加成反应
(3)
24.(1)纤维素;
(2)CHCOOCH、HCOOCHCHCH、HCOOCH(CH)
(3)CHOH+CuO→CHCHO+HO+Cu;
CHOH(CHOH)CHO+2〔Ag(CH)〕+2OH→CHOH(CHOH)COOH+2Ag↓+HO+4CH
25.(1)CHO(2)HO—CHCH—OH
26.(1)常压时二氧化硫的转化率已经很高。(2)6%;137.5(3)a:b=2:1,c为任意值
PAGE
1
同课章节目录
