05-06江西东方明珠高级中学高三金属测试题[上学期]
文档属性
| 名称 | 05-06江西东方明珠高级中学高三金属测试题[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 63.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-26 00:00:00 | ||
图片预览


文档简介
05-06江西东方明珠高级中学高三金属测试题 明德力
1、下列有关纯铁的描述正确的是 A?熔点比生铁的低 B?与相同浓度的盐酸反应生成氢气的速率比生铁的快 C?在潮湿空气中比生铁容易被腐蚀 D?在冷的浓硫酸中可钝化 2、下列反应的离子方程式正确的是 A? 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ B? 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ C? 碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ D? 铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O 3、家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是 A? 4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B? 2Fe+2H2O+O2=2Fe(OH)2↓ C? 2H2O+O2+4e=4OH- D? Fe-3e=Fe3+ 4、取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是????????? A.H2 B.CO C.C6H12O6 ????? D.C12H22O11 5、久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的物质是 A.过氧化钠固体???? B.亚硫酸钠固体???? C.硫酸亚铁晶体???? D.苯酚晶体 6、若1.8g某金属跟足量盐酸充分反应,放出2.24L(标准状况)氢气,则该金属是 A.Al?? ??B.Mg?????? C.Fe? D.Zn 7、下列物质中不会因见光而分解的是 A? NaHCO3??? B? HNO3??? C? AgI??? D? HClO 8、将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 A?稀硝酸??? B?稀盐酸??? C?硝酸铜??? D?氢氧化钠 9、等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为 A? 3︰4︰1??? B? 3︰3︰2??? C? 6︰7︰3??? D? 6︰9︰0 10、下列离子方程式中,正确的是 A 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- B 三氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ C? 碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ D? 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O 11、下列反应离子方程式正确的是 A、向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH-= AlO2- + 2H2O B、向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O-→ 2C6H5OH + CO32- C、向小苏打溶液中加入醋酸溶液:HCO3- + H+=CO2↑+ H2O D、向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br - + 2Cl2=Fe3+ +Br2 + 4Cl - 12、下列金属冶炼的反应原理,错误的是
A、2NaCl(熔融) 2Na+Cl2↑??? B、MgO+H2 Mg+H2O
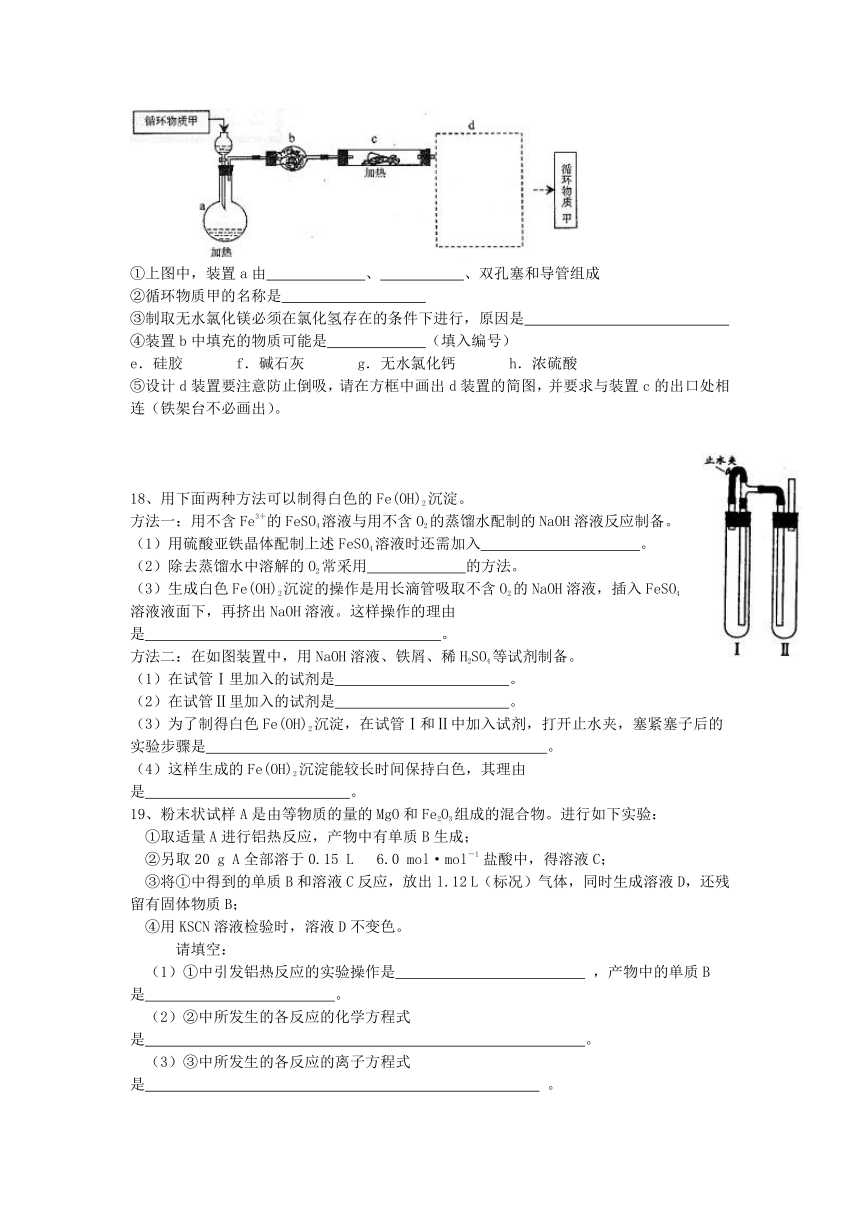
C、Fe3O4+4CO 3Fe+4CO2 ????D、2HgO 2Hg+O2↑ 13、向0.1mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是 A、Na+、CO32-??? B、Na+、HCO3- ????C、HCO3-、CO32-??? D、Na+、OH- 14、下列各组离子一定能大量共存的是 A、含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN- B、在强碱溶液中:Na+、K+、AlO2-、CO32- C、在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3- D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3- 15、关于小苏打水溶液的表述正确的是 A、c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3) B、c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-) C、HCO3- 的电离程度大于HCO3-的水解程度 D、存在的电离有:NaHCO3=Na++HCO3—,HCO3— H++CO32—,H2O H++OH— 16、锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。 回答下列问题: (1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为?????????? (用化学式表示)。 (2)写出锌和氢氧化钠溶液反应的化学方程式?????????????? 。 (3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是??????????? 。 ①硫酸铝和氢氧化钠??②硫酸铝和氨水??③硫酸锌和氢氧化钠??④硫酸锌和氨水 (4)写出可溶性铝盐与氨水反应的离子方程式??????????? 。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因?????????? 。 17、 航天飞行器座舱内空气更新过程如图所示: (1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式??????????????????????????? (2)从装置Ⅰ,Ⅱ,Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O???? mol。 (3)以下是另一种将CO2转化为O2的实验设想 其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下: ①上图中,装置a由?????? 、????? 、双孔塞和导管组成 ②循环物质甲的名称是????????? ③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是????????????? ④装置b中填充的物质可能是?????? (填入编号) e.硅胶??? f.碱石灰??? g.无水氯化钙??? h.浓硫酸 ⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
18、用下面两种方法可以制得白色的Fe(OH)2沉淀。 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。 (1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入?????????? 。 (2)除去蒸馏水中溶解的O2常采用?????? 的方法。 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是??????????????????? 。 方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是??????????? 。 (2)在试管Ⅱ里加入的试剂是??????????? 。 (3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是?????????????????????? 。 (4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是????????????? 。 19、粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验: ①取适量A进行铝热反应,产物中有单质B生成; ②另取20 g A全部溶于0.15 L? 6.0 mol·mol-1 盐酸中,得溶液C; ③将①中得到的单质B和溶液C反应,放出l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B; ④用KSCN溶液检验时,溶液D不变色。 请填空: (1)①中引发铝热反应的实验操作是 ,产物中的单质B是 。 (2)②中所发生的各反应的化学方程式是 。 (3)③中所发生的各反应的离子方程式是 。 (4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为___________________, ???? c(Fe2+)为____________________________________________________。 19、 A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH-、CO32-、NO3-、SO42-两两组合而成,它们的溶液发生如下反应: A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀。B与C反应生成白色沉淀。 写出它们的化学式:A:??? ????,B:??????? ,C:??????? ,D:??????? 。 20、钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下: (1)Ti的原子序数为22,Ti位于元素周期表中第_____________周期,第__________族。 (2)步骤①加Fe的目的是____________________________________________________; 步骤②冷却的目的是___________________________________________________。 (3)上述制备TiO2的过程中,可以利用的副产物是_____________;考虑成本和废物综合利用因素,废液中应加入__________________处理。 (4)由金红石(TiO2)制取单质Ti,涉及到的步骤为: 己知:①C (s) +O2 (g)=CO2 (g);???????????????? △H =-393.5 kJ·mol-1 ②2CO (g) + O2 (g)=2CO2 (g);????????? ????△H =-566 kJ·mol-1 ③TiO2(s) + 2Cl2 (g)=TiCl4(s) + O2(g);??????? △H = +141 kJ·mol-1 则TiO2(g)+2Cl2(g)+2C(s) =TiCl4(s) + 2CO (g)的△H= _____????? __________。 反应TiCl4 +2Mg=2MgCl2 + Ti在Ar气氛中进行的理由是_______________________。 21、 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为: (1)用没食子酸制造墨水主要利用了___________________类化合物的性质(填代号)。 A、醇?????????? B、酚????????? C、油脂?????? ????D、羧酸 (2)没食子酸丙酯且有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为________________________________________________。 (3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_________________________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有___________种。 (4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式: __________________________________________________???????????????????? ___________ 22、化合物KxFe(C2O4)y· zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.49lg两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3 mol·L-1 H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500mol·L-1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3-完全转化为Fe2+,该溶液中Fe2+刚好与4.0 mL0.0500mol·L-1KMnO4溶液完全反应。 通过计算,分别求: (1)0.49lg样品中结晶水的物质的量。 (2)化合物中草酸根的质量分数。 (3)化合物的化学式。 己知:2 KMnO4 + 5 H2C2O4 + 3H2SO4 =2MnSO4 + K2SO4 + 10CO2↑+ 8H2O ????? MnO4- +5Fe2++8H+=Mn2+ + 5Fe3+ + 4H2O
?
参考答案
D C D D A
A A C A B
A B B B AD 15、(1)AlO2-[或Al(OH)4-] (2)Zn+2NaOH=Na2ZnO2+H2↑ [或Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑] (3)①③④ (4)Al3++3NH3·H2O=Al(OH)3+3NH4+ 可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制 16、(1)2H2+CO2→2H2O+C (2)10 (3)①分液漏斗 烧瓶②盐酸③防止水解④e g ⑤ 17、方法一 (1)稀H2SO4铁屑(2)煮沸(3)避免生成的Fe(OH)2沉淀接触O2 方法二 (1)稀H2SO4铁屑(2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。 18、(1)加少量KClO3,插上Mg条并将其点燃 Fe (2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O (3)Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ (4)c(Mg2+) 0.67mol·L-1 , c(Fe2+) 2.3mol·L-1 。 19、 Ba(OH),Al2(SO4)3,K2CO3,Fe(NO3)3 20、 (1) 4ⅣB (2)将Fe3+还原为Fe2+ 析出(或分离、或得到)FeSO4·7H2O (3) FeSO4·7H2O 石灰(或碳酸钙、废碱) (4)- 80 kJ·mol-1 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用 21、 (1) B (2) (3) C11H14O3 (4) 22、 (1) n(H2O) = (2) n(C2O42-) = 0.0500 mol·L-1×0.024 L× m(C2O42-) = 0.003 mol×88 g·mol-1 = 0.264g ω(C2O42-) = ×100% = 53.8 % (3)因为n(Fe3+) = n(Fe2+) = 0.0500 mol·L-1×0.004 L×5 = 0.00100 mol 1:y :z = 0.00100 mol:0.00300 mol:0.00300 mol = 1:3:3 则 y = 3, z = 3 根据电荷平衡有:x + 3 = 2y,得x = 3 所以,化合物的化学式为:K3Fe(C2O4)3·3H2O
?
1、下列有关纯铁的描述正确的是 A?熔点比生铁的低 B?与相同浓度的盐酸反应生成氢气的速率比生铁的快 C?在潮湿空气中比生铁容易被腐蚀 D?在冷的浓硫酸中可钝化 2、下列反应的离子方程式正确的是 A? 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ B? 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ C? 碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ D? 铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O 3、家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是 A? 4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B? 2Fe+2H2O+O2=2Fe(OH)2↓ C? 2H2O+O2+4e=4OH- D? Fe-3e=Fe3+ 4、取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是????????? A.H2 B.CO C.C6H12O6 ????? D.C12H22O11 5、久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的物质是 A.过氧化钠固体???? B.亚硫酸钠固体???? C.硫酸亚铁晶体???? D.苯酚晶体 6、若1.8g某金属跟足量盐酸充分反应,放出2.24L(标准状况)氢气,则该金属是 A.Al?? ??B.Mg?????? C.Fe? D.Zn 7、下列物质中不会因见光而分解的是 A? NaHCO3??? B? HNO3??? C? AgI??? D? HClO 8、将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 A?稀硝酸??? B?稀盐酸??? C?硝酸铜??? D?氢氧化钠 9、等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为 A? 3︰4︰1??? B? 3︰3︰2??? C? 6︰7︰3??? D? 6︰9︰0 10、下列离子方程式中,正确的是 A 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- B 三氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ C? 碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ D? 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O 11、下列反应离子方程式正确的是 A、向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH-= AlO2- + 2H2O B、向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O-→ 2C6H5OH + CO32- C、向小苏打溶液中加入醋酸溶液:HCO3- + H+=CO2↑+ H2O D、向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br - + 2Cl2=Fe3+ +Br2 + 4Cl - 12、下列金属冶炼的反应原理,错误的是
A、2NaCl(熔融) 2Na+Cl2↑??? B、MgO+H2 Mg+H2O
C、Fe3O4+4CO 3Fe+4CO2 ????D、2HgO 2Hg+O2↑ 13、向0.1mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是 A、Na+、CO32-??? B、Na+、HCO3- ????C、HCO3-、CO32-??? D、Na+、OH- 14、下列各组离子一定能大量共存的是 A、含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN- B、在强碱溶液中:Na+、K+、AlO2-、CO32- C、在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3- D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3- 15、关于小苏打水溶液的表述正确的是 A、c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3) B、c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-) C、HCO3- 的电离程度大于HCO3-的水解程度 D、存在的电离有:NaHCO3=Na++HCO3—,HCO3— H++CO32—,H2O H++OH— 16、锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。 回答下列问题: (1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为?????????? (用化学式表示)。 (2)写出锌和氢氧化钠溶液反应的化学方程式?????????????? 。 (3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是??????????? 。 ①硫酸铝和氢氧化钠??②硫酸铝和氨水??③硫酸锌和氢氧化钠??④硫酸锌和氨水 (4)写出可溶性铝盐与氨水反应的离子方程式??????????? 。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因?????????? 。 17、 航天飞行器座舱内空气更新过程如图所示: (1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式??????????????????????????? (2)从装置Ⅰ,Ⅱ,Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O???? mol。 (3)以下是另一种将CO2转化为O2的实验设想 其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下: ①上图中,装置a由?????? 、????? 、双孔塞和导管组成 ②循环物质甲的名称是????????? ③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是????????????? ④装置b中填充的物质可能是?????? (填入编号) e.硅胶??? f.碱石灰??? g.无水氯化钙??? h.浓硫酸 ⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
18、用下面两种方法可以制得白色的Fe(OH)2沉淀。 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。 (1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入?????????? 。 (2)除去蒸馏水中溶解的O2常采用?????? 的方法。 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是??????????????????? 。 方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是??????????? 。 (2)在试管Ⅱ里加入的试剂是??????????? 。 (3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是?????????????????????? 。 (4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是????????????? 。 19、粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验: ①取适量A进行铝热反应,产物中有单质B生成; ②另取20 g A全部溶于0.15 L? 6.0 mol·mol-1 盐酸中,得溶液C; ③将①中得到的单质B和溶液C反应,放出l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B; ④用KSCN溶液检验时,溶液D不变色。 请填空: (1)①中引发铝热反应的实验操作是 ,产物中的单质B是 。 (2)②中所发生的各反应的化学方程式是 。 (3)③中所发生的各反应的离子方程式是 。 (4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为___________________, ???? c(Fe2+)为____________________________________________________。 19、 A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH-、CO32-、NO3-、SO42-两两组合而成,它们的溶液发生如下反应: A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。C与D反应生成有色沉淀。B与C反应生成白色沉淀。 写出它们的化学式:A:??? ????,B:??????? ,C:??????? ,D:??????? 。 20、钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下: (1)Ti的原子序数为22,Ti位于元素周期表中第_____________周期,第__________族。 (2)步骤①加Fe的目的是____________________________________________________; 步骤②冷却的目的是___________________________________________________。 (3)上述制备TiO2的过程中,可以利用的副产物是_____________;考虑成本和废物综合利用因素,废液中应加入__________________处理。 (4)由金红石(TiO2)制取单质Ti,涉及到的步骤为: 己知:①C (s) +O2 (g)=CO2 (g);???????????????? △H =-393.5 kJ·mol-1 ②2CO (g) + O2 (g)=2CO2 (g);????????? ????△H =-566 kJ·mol-1 ③TiO2(s) + 2Cl2 (g)=TiCl4(s) + O2(g);??????? △H = +141 kJ·mol-1 则TiO2(g)+2Cl2(g)+2C(s) =TiCl4(s) + 2CO (g)的△H= _____????? __________。 反应TiCl4 +2Mg=2MgCl2 + Ti在Ar气氛中进行的理由是_______________________。 21、 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为: (1)用没食子酸制造墨水主要利用了___________________类化合物的性质(填代号)。 A、醇?????????? B、酚????????? C、油脂?????? ????D、羧酸 (2)没食子酸丙酯且有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为________________________________________________。 (3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_________________________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有___________种。 (4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式: __________________________________________________???????????????????? ___________ 22、化合物KxFe(C2O4)y· zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.49lg两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3 mol·L-1 H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500mol·L-1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3-完全转化为Fe2+,该溶液中Fe2+刚好与4.0 mL0.0500mol·L-1KMnO4溶液完全反应。 通过计算,分别求: (1)0.49lg样品中结晶水的物质的量。 (2)化合物中草酸根的质量分数。 (3)化合物的化学式。 己知:2 KMnO4 + 5 H2C2O4 + 3H2SO4 =2MnSO4 + K2SO4 + 10CO2↑+ 8H2O ????? MnO4- +5Fe2++8H+=Mn2+ + 5Fe3+ + 4H2O
?
参考答案
D C D D A
A A C A B
A B B B AD 15、(1)AlO2-[或Al(OH)4-] (2)Zn+2NaOH=Na2ZnO2+H2↑ [或Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑] (3)①③④ (4)Al3++3NH3·H2O=Al(OH)3+3NH4+ 可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制 16、(1)2H2+CO2→2H2O+C (2)10 (3)①分液漏斗 烧瓶②盐酸③防止水解④e g ⑤ 17、方法一 (1)稀H2SO4铁屑(2)煮沸(3)避免生成的Fe(OH)2沉淀接触O2 方法二 (1)稀H2SO4铁屑(2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。 18、(1)加少量KClO3,插上Mg条并将其点燃 Fe (2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O (3)Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ (4)c(Mg2+) 0.67mol·L-1 , c(Fe2+) 2.3mol·L-1 。 19、 Ba(OH),Al2(SO4)3,K2CO3,Fe(NO3)3 20、 (1) 4ⅣB (2)将Fe3+还原为Fe2+ 析出(或分离、或得到)FeSO4·7H2O (3) FeSO4·7H2O 石灰(或碳酸钙、废碱) (4)- 80 kJ·mol-1 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用 21、 (1) B (2) (3) C11H14O3 (4) 22、 (1) n(H2O) = (2) n(C2O42-) = 0.0500 mol·L-1×0.024 L× m(C2O42-) = 0.003 mol×88 g·mol-1 = 0.264g ω(C2O42-) = ×100% = 53.8 % (3)因为n(Fe3+) = n(Fe2+) = 0.0500 mol·L-1×0.004 L×5 = 0.00100 mol 1:y :z = 0.00100 mol:0.00300 mol:0.00300 mol = 1:3:3 则 y = 3, z = 3 根据电荷平衡有:x + 3 = 2y,得x = 3 所以,化合物的化学式为:K3Fe(C2O4)3·3H2O
?
同课章节目录
