仁爱版初中化学九年级上册专题6《物质的溶解》测试题(解析版)
文档属性
| 名称 | 仁爱版初中化学九年级上册专题6《物质的溶解》测试题(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 178.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-29 21:15:27 | ||
图片预览




文档简介
专题6《物质的溶解》测试题
一、单选题(每小题只有一个正确答案)
1.如图是甲、乙、丙三种物质的溶解度曲线,从图中获得的信息错误的是( )
A.t1℃时甲、乙、丙三者的溶解度相等
B.甲的溶解度受温度的影响最大
C.要使t1℃时甲的饱和溶液变成不饱和溶液可以采取升高温度的方法
D.t2℃ 时,往100g水中加入90g甲,充分搅拌后得到190g甲的溶液
2.某初三年级的同学正在筹备毕业晚会,预定有以下饮料,其中不属于溶液的是( )
A.啤酒 B.酸奶 C.矿泉水 D.可口可乐
3.一只盛有饱和石灰水溶液的烧杯放置在空气中,较长时间后,石灰水表面形成了一层白膜(假设水没有减少、温度不变),则下列说法正确的是( )
A. 此时该溶液仍为饱和溶液 B. “白膜”为析出的氢氧化钙固体
C. 形成“白膜”的过程为物理变化 D. 若加热饱和石灰水溶液,溶液可能会变浑浊
4.下列有关计算结果错误的是( )
A.K2Cr2O7中Cr元素的化合价为+6价
B.C2H4与C4H8中碳元素和氢元素的质量比相同,均为1:2
C.NH4NO3中氮元素的质量分数为35%
D.20℃时,NaCl的溶解度为36g,故该温度下50g水中最多溶解18g NaCl
5.溶液的基本特征是( )
A.含有溶质和溶剂 B.其组成中一定含有水
C.具有无色及透明性 D.具有均一性和稳定性
6.如图所示装置,向试管里的水中加入某种物质后,U形管左边支管的红墨水液面降低,右边支管的红墨水液面上升,则加入的物质可能是( )
A. 氯化钠 B. 生石灰 C. 蔗糖 D. 硝酸铵
7.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸能使紫色石蕊溶液变红,通入CO2后的紫色石蕊溶液变红,所以CO2是酸
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.酸性溶液的pH小于7,食醋是酸性溶液,所以食醋的pH小于7
D.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
8.下列每组中的固体物质,只用水做试剂,不能将其鉴别出来的是( )
A.氢氧化钠、氯化钠 B.氧化铜、铁粉
C.高锰酸钾、碘 D.氧化钙、氢氧化钙
9.如图所示是甲物质的溶解度曲线。把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是( )
A. 溶剂的质量一定变小 B. 溶液的质量可能不变
C. 溶质的质量分数一定变大 D. 溶质的质量一定不变
10.推理是化学学习中常用的思维方法,下列推理正确的是( )
A. 混合物中至少含有两种物质,则混合物中至少含有两种元素
B. 硝酸铵溶于水吸收大量的热,则氢氧化钠溶于水吸收大量的热
C. 物质在发生化学变化时,原子的种类不变,则元素种类也不会改变
D. 利用红磷燃烧的方法可以测定空气中氧气的含量,则利用木炭也可以
11.下列说法中,错误的是( )
A. 铁、锌、钙、硒、碘都是人体必需的微量元素
B. 洗洁精除去餐具上的油污是“乳化作用”
C. 在铁桶中加入硫酸铜溶液和石灰水配制杀菌剂的操作欠妥
D. 蛋白质是重要的营养物质,常吃鱼、虾、大豆都能补充蛋白质
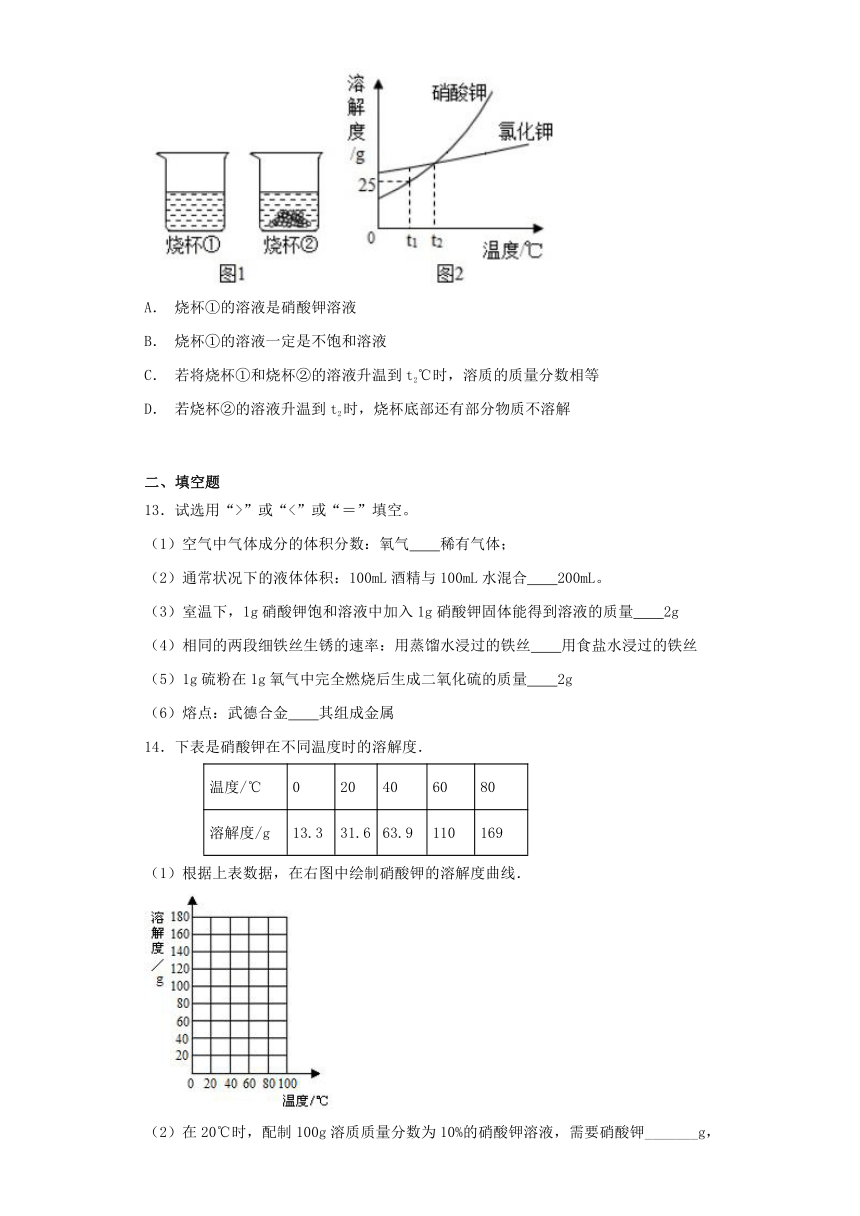
12.t1℃时,将等质量的硝酸钾和氯化钾分别放入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是( )
A. 烧杯①的溶液是硝酸钾溶液
B. 烧杯①的溶液一定是不饱和溶液
C. 若将烧杯①和烧杯②的溶液升温到t2℃时,溶质的质量分数相等
D. 若烧杯②的溶液升温到t2时,烧杯底部还有部分物质不溶解
二、填空题
13.试选用“>”或“<”或“=”填空。
(1)空气中气体成分的体积分数:氧气 稀有气体;
(2)通常状况下的液体体积:100mL酒精与100mL水混合 200mL。
(3)室温下,1g硝酸钾饱和溶液中加入1g硝酸钾固体能得到溶液的质量 2g
(4)相同的两段细铁丝生锈的速率:用蒸馏水浸过的铁丝 用食盐水浸过的铁丝
(5)1g硫粉在1g氧气中完全燃烧后生成二氧化硫的质量 2g
(6)熔点:武德合金 其组成金属
14.下表是硝酸钾在不同温度时的溶解度.
温度/℃ 0 20 40 60 80
溶解度/g 13.3 31.6 63.9 110 169
(1)根据上表数据,在右图中绘制硝酸钾的溶解度曲线.
(2)在20℃时,配制100g溶质质量分数为10%的硝酸钾溶液,需要硝酸钾_______g,水_______g。根据溶解度判断,该溶液是________(填“饱和”或“不饱和”)溶液.
(3)现有60℃时接近饱和的硝酸钾溶液,要使它变成饱和溶液,可采用的方法是 ?(写出一种即可)。
15.化学用语是学习和研究化学的重要工具,请按要求完成下列各题:
(1)请用元素符号回答:
①幼儿及青少年缺 _________ 会患佝偻病和发育不良;
②甘蔗是我市主要的经济作物之一,为了增强甘蔗的抗倒伏能力可以适当施用 _________ 肥.
(2)请用离子符号回答:
①食盐的主要成份是氯化钠,它是由 _________ 和氯离子构成的;
②碱具有一些相似的化学性质,是因为碱溶液中都含有 _________ .
(3)请用化学式回答:
①农业上用来改良酸性土壤的是 _________ ;
②碘酒是家庭常备药,碘酒中的溶剂是 _________ .
(4)请用化学方程式回答:
①正常雨水呈弱酸性,原因是 _________ ;
②生活中的铝制品抗腐蚀性能好,原因是 _________ .
16.配制500g 10%的氢氧化钠溶液,需要氢氧化钠固体????? g。若把配制好的氢氧化钠溶液倒入用蒸馏水润洗过的试剂瓶中,溶液的溶质质量分数将?????? (选填“变大”、 “变小”或“不变”)。
17.在40℃时,取等质量的a、b、c三种物质的饱和溶液于三个烧杯中,再分别蒸发等质量的水,并将温度降低到30℃,固体溶解情况如图1所示,图2为a、b、c三种物质的溶解度曲线,回答下列问题:
(1)图2中p点的意义是__________________________,三种物质的溶解度关系为b>a>c时的温度为t,则t的取值范围是________________。
(2)40℃时,烧杯_________(填“甲”、“乙”或“丙”)里溶液中水量最少;根据图1析出固体质量的变化可推测烧杯甲里是________物质的溶液,烧杯乙里是________物质的溶液。
三、实验题
18.利用右图装置证明一氧化碳的部分性质并验证产物。
① 氧化铜为_____色粉末,其中氧元素以_______态存在。
② 加热玻璃管后,a中发生反应的化学方程式是________,
反应后a中固体的质量_________(选填“变大”“变小”或“不变”)。
③ b中盛放的液体所含的溶质是____________________。
④ c处点燃后,火焰呈________色。
⑤ a中发生的反应证明了一氧化碳具有__________性。
19.实验小组同学做了如下实验:
(1)仪器①的名称是 _____________。某同学用A装置制氧气,其他同学认为该装置有个缺陷,改进方法是 ______________________________,将带火星的木条置于a处,若观察到_______________________________,说明已有氧气产生。
(2)B中现象是量筒内涌出柱状的泡沫,可形象地称为“大象牙膏”,其原理主要是H2O2在碘化钾(KI)催化作用下迅速分解,该反应的化学方程式为_____________。
该实验中的发泡剂是洗洁精,洗洁精能除去油污是因为洗洁精具有______作用。
四、计算题
20.质量分数不同的硫酸溶液其密度不相同,对照表如下:
质量分数
10%
20%
30%
40%
50%
60%
70%
80%
90%
98%
密度(g/mL)
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含_________gH2SO4。
(2)列式计算消耗金属锌的质量。
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是 。10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在 至 之间。
21.某温度下,100g溶质的质量分数为10%的食盐溶液,如果使其溶质的质量分数增大一倍,应该
⑴ 加入食盐多少克?
⑵ 也可以蒸发水多少克?
试卷第6页,总6页
参考答案
1.D
【解析】
试题分析:溶解度曲线的纵坐标为溶解度,横坐标为温度,t1℃时甲、乙、丙三者的溶解度曲线交于一点,说明t1℃时甲、乙、丙三者的溶解度相同;甲的溶解度随温度的升高而增加的最快,甲的溶解度受温度影响最大;由图知,甲的溶解度随温度升高而增大,要使t1℃时甲的饱和溶液变成不饱和溶液可以采取升高温度的方法;t2℃ 时,甲的溶解度为80g,故往100g水中加入90g甲,充分搅拌后得到180g甲的溶液.
考点:溶解度与溶解度曲线
2.B
【解析】酸奶属于乳浊液,不是溶液,其他物质都属于溶液.
3.D
【解析】一只盛有饱和石灰水溶液的烧杯放置在空气中,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水;由于溶质减少,溶液称为不饱和溶液;石灰水表面形成了一层白膜是碳酸钙;形成“白膜”的过程有新的物质生成,为化学变化;D、氢氧化钙的溶解度随温度升高而减小,若加热饱和石灰水溶液,溶质析出,溶液会变浑浊。选D
4.B
【解析】A、钾元素显+1价,氧元素显﹣2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(﹣2)×7=0,则x=+6价,故选项说法正确.
B、C2H4与C4H8中碳元素和氢元素的质量比分别为(12×2):(1×4)=6:1,(12×4):(1×8)=6:1,故选项说法错误.
C、NH4NO3中氮元素的质量分数为×100%=35%,故选项说法正确.
D、20℃时,NaCl的溶解度为36g,是指该温度下,100g水中最多溶解36g氯化钠,故该温度下50g水中最多溶解18g 氯化钠,故选项说法正确.
故选:B.
【答案】D
【解析】考点定位分析:本题的考点是溶液的概念、组成及其特点。溶液是指由一种或多种物质分散到另外一种物质里形成的均一、稳定的混合物。溶液的本质特征是均一性、稳定性,属于混合物。
解答过程分析:溶液的特点是均一性和稳定性,其中,均一性是指溶液中各部分的性质和成分均相同(如一瓶溶液中,上下左右等各部分的密度都是一样的);稳定性是指在条件不变(即温度、压强等不改变,溶剂不蒸发等)的情况下,溶液中的溶质永远不会析出(即溶质与溶剂永不分离)。
A、溶液是由溶质和溶剂组成的,含有溶质和溶剂不是溶液的基本特征,故选项错误;
B、溶液的组成中不一定含有水,如碘酒中就不含水,故选项错误;
C、有些溶液是带有颜色的,如硫酸铜溶液是蓝色的,故选项错误;
D、溶液具有均一性、稳定性,故选项正确。故选D
试题总结评价:本题难度不大,主要考查的是溶液基本特征,充分理解溶液特征是即可正确解题。
6.B
【解析】A、氯化钠溶于水既不放热也不吸热,使容器内温度不变,压强不变,液面不发生变化,错误;B、生石灰溶于水放出热量,使容器内温度升高,压强增大,右边液面上升,左边液面下降,正确;C、蔗糖溶于水既不放热也不吸热,使容器内温度不变,压强不变,液面不发生变化,错误;D、硝酸铵溶于水吸热,使容器内温度降低,气压减小,小于外界大气压,右边液面降低,左边液面上升,错误。故选D。
7.C
【解析】
试题分析:A、酸能使紫色石蕊溶液变红,通入CO2后的紫色石蕊溶液变红,是由于CO2能与水反应生成碳酸,而不是CO2是酸,错误,B、溶液中有晶体析出时,溶质质量减小,但溶质的质量分数不一定减小,有可能是饱和溶液蒸发水分析出晶体,此时溶质质量分数不变,错误,C、酸性溶液的pH小于7,食醋是酸性溶液,所以食醋的pH小于7,正确,D、在同一化合物中,金属元素显正价,非金属元素也不一定显负价,如:CuSO4等,错误,故选C
考点:酸的概念,溶质的质量分数的计算,溶液的酸碱性,元素化合价的一般规律
8.B
【解析】
试题分析:B中二者都是黑色固体,且均不能入水中,也不能和水发生反应,无法用水鉴别。故选B.
考点:物质的鉴别
9.B
【解析】
A、甲物质的不饱和溶液变为饱和溶液,溶剂的质量不一定变小,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶剂的质量可能不变,故A错误;B、甲物质的不饱和溶液变为饱和溶液,溶质的质量可能不变,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶质的质量可能不变,故B正确;C、甲物质的不饱和溶液变为饱和溶液,溶质的质量分数不一定变大,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶质的质量分数可能不变或变小,故C错误;D、甲物质的不饱和溶液变为饱和溶液,溶液的质量不一定变大,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶液的质量可能不变或变小,故D错误。故选B。
10.C
【解析】A、由两种或两种以上的物质组成的物质叫混合物,混合物不一定至少含有两种元素,比如氧气和臭氧组成的物质是由两种物质组成,是混合物,但是该物质是由一种元素组成的,故错误;
B、硝酸铵溶于水温度降低,氢氧化钠溶于水温度升高,故错误;
C、根据质量守恒定律,物质在发生化学变化时,元素的种类、质量不变,原子的种类、质量、个数不变,故正确;
D、测定空气中氧气含量的原理是利用红磷燃烧耗尽瓶中的氧气,生成固体的五氧化二磷,耗掉多少体积的氧气,就有多少体积的水进入集气瓶中,木炭燃烧后生成了二氧化碳气体,填充了耗掉氧气的体积,故不能用木炭代替红磷,故错误。故选C。
11.A
【解析】A、钙是人体内的常量元素,错误;B、洗洁精使油以小液滴均匀悬浮在水中,随水被冲掉,属于乳化作用,正确;C、铁桶中加入硫酸铜溶液,铁会与硫酸铜反应生成硫酸亚铁和铜,正确;D、蛋白质是重要的营养物质,常吃鱼、虾、大豆都能补充蛋白质,正确。故选A。
12.C
【解析】由图看出,t1℃时,硝酸钾的溶解度小于氯化钾的溶解度。t1℃时,将等质量的硝酸钾和氯化钾分别放入到各盛有100g水的两个烧杯中,充分搅拌后,烧杯②中有固体剩余,说明烧杯②中溶解的固体少,则烧杯②中加入的是硝酸钾。A. 烧杯①的溶液是氯化钾溶液,错误;B. 烧杯①的溶液可能恰好是饱和溶液,错误;C. t2℃时,硝酸钾和氯化钾的溶解度相等,若将烧杯①和烧杯②的溶液升温到t2℃时,两种物质溶解的质量相等,故溶质的质量分数相等,正确;D. t1℃时,烧杯①中的物质完全溶解,升温到t2时,氯化钾的溶解度增大,能溶解的氯化钾增多,而t2时,氯化钾与硝酸钾的溶解度相等,故若烧杯②的溶液升温到t2时,烧杯底部的固体物质全部溶解,错误。故选C。
点睛:要顺利解决此题,就要知道溶解度曲线的意义,并且能根据图看出物质的溶解度受温度影响的大小。
13.> ;< ;<;<;=;< 。
【解析】
试题分析:
(1)空气中气体成分的体积分数,氧气占21%,稀有气体0.94% ;
(2)分子间有间隔,故100mL酒精与100mL水混合体积小于200ml;
(3)饱和溶液是不能继续溶解该溶质的溶液,故1g硝酸钾饱和溶液中加入硝酸钾固体不能继续溶解;
(4)食盐水能加速铁的生锈;
(5)硫与氧气反应的质量比为1:1,故1g硫粉在1g氧气中完全燃烧后生成二氧化硫的质量为2g;
(6)合金的熔点比组成它的纯金属的熔点低;
考点:量的关系
14.(7分)(1)见图(不要求画得很精确)
(2) 10; 90; 不饱和
(3) (2分)加入硝酸钾或降温或恒温蒸发少量水
【解析】(1)先根据表头画好坐标系的纵横坐标,再根据表格中的数据,描点连线即可。(2)硝酸钾的质量:100g×10%=10g,水的质量:100g-10g=90g. 20℃时,硝酸钾的溶解度是31.6g,则此温度下,该溶液为不饱和溶液;(3)硝酸钾的溶解度受温度影响较大,所以将60℃时接近饱和的硝酸钾溶液,变成饱和溶液,可采用的方法:加入硝酸钾或降温或恒温蒸发少量水。
15.(1)钙;钾;(2)钠离子;氢氧根离子;(3)消石灰;酒精;(4)CO2+H2O═H2CO3;4Al+3O2=2Al2O3;
【解析】
试题分析:(1)幼儿及青少年缺钙会患佝偻病和发育不良;肥能促进作物生长健壮,茎杆粗硬,增强抗病虫害和抗倒伏能力,因此为了增强甘蔗的抗倒伏能力可以适当施用钾肥;(2)氯化钠是由氯离子和钠离子构成的;碱具有一些相似的化学性质,是因为碱溶液中都含有氢氧根离子;(3)改良酸性土壤一般用碱性物质来中和,消石灰的主要成分是氢氧化钙,是一种碱性的物质.可用于中和酸性土壤改良土壤结构.碘酒是固态碘和酒精的溶液,其中酒精是溶剂;(4)正常雨水呈弱酸性,原因是空气中的二氧化碳溶于水中生成碳酸.化学方程式为:CO2+H2O═H2CO3;生活中的铝制品抗腐蚀性能好,原因是铝表面易生成一种氧化铝膜,对铝制品起到保护作用,其化学方程式为:4Al+3O2=2Al2O3;
考点:元素的符号及其意义;化学式的书写及意义;化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式
16.50??? 变小
【解析】① 相关知识点:溶质、溶剂、溶液质量的计算? 配制一定质量分数的溶液② 解析思路:溶质的质量=溶液的质量×溶质质量分数,配制好的氢氧化钠溶液倒入用蒸馏水润洗过的试剂瓶中,等于增加了溶剂的质量,溶质质量分数减小。
17. 在30℃时,a和b的溶解度相等 20℃<t<30℃ 丙 b c
【解析】由题中信息知,(1)图2中p点的意义是在30℃时,a和b的溶解度相等。三种物质的溶解度关系为b>a>c时的温度为t,则t的取值范围是20℃<t<30℃ 。(2)40℃时,三种物质的溶解度关系为a>b>c,烧杯丙里溶液中水量最少;根据图1析出固体质量的变化可推测烧杯甲里是b物质的溶液,烧杯乙里是c物质的溶液。
点睛∶本题主要考查溶解度曲线的应用。
18.黑化合CO+CuOCu+CO2变小Ca(OH)2(氢氧化钙、熟石灰)淡蓝还原性
【解析】
①化合态的氧元素指化合物中有氧元素;
②根据反应物、生成物以及反应条件书写反应方程式;结合质量守恒定律填空;
③b中盛放的液体是用来检验二氧化碳气体的;
④根据CO燃烧的现象进行分析;
⑤玻璃管中发生的反应是一氧化碳与氧化铜反应生成铜和二氧化碳.
解:①氧化铜是黑色粉末,氧化铜中氧元素只有化合态存在.
故填:黑;化合;
②一氧化碳与氧化铜在加热的条件下反应,生成铜和二氧化碳;由于氧化铜被还原成了铜,失去氧元素,故质量减小;
故填:CO+CuOCu+CO2;变小;
③一氧化碳与氧化铜在加热的条件下反应,生成铜和二氧化碳,b中盛放的液体是澄清石灰水,用来检验二氧化碳气体的,故该液体所含的溶质是Ca(OH)2(氢氧化钙、熟石灰).
故填:Ca(OH)2(氢氧化钙、熟石灰);
④CO被点燃后,发出淡蓝色火焰;
故填:淡蓝;
⑤一氧化碳与氧化铜反应生成铜和二氧化碳,说明一氧化碳具有还原性.
故填:还原性.
点睛:CO还原CuO。
19. 铁架台 在试管口塞一团棉花 带火星木条复燃 乳化
【解析】(1)根据高锰酸钾制取氧气的实验装置及氧气的检验分析解答;
(2)通常情况下,过氧化氢在某些催化剂的作用下,分解生成水和氧气,根据反应原理书写化学方程式;依据洗洁精的去污原理分析。
解:(1)仪器①的名称是铁架台。实验室用高锰酸钾制取氧气时为防止高锰酸钾粉末进入导管,需在试管口放一团棉花。故改进方法是在试管口塞一团棉花。将带火星的木条置于a处,是在检验是否有氧气生成。检验是否有氧气生成的方法是看带火星的木条是否复燃。故若观察到带火星木条复燃,说明已有氧气产生;
(2)过氧化氢在某些催化剂的作用下分解的化学方程式为2H2O2 2H2O+O2↑。洗洁精能除去油污是因为洗洁精具有乳化作用。
20.(1)18
(2)解:设10mL稀硫酸与锌完全反应消耗锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
X 18.0g×
答:略
(3)质量分数越大密度越大% b%
【解析】(1)根据对照表,98%的浓硫酸的密度为1.84g/mL,10mL98%浓硫酸中溶质硫酸的质量=10mL×1.84g/mL×98%≈18.0g;(2)所取10mL稀硫酸中硫酸的质量=18g×10mL100mL=1.8g,设10mL稀硫酸与锌完全反应消耗锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65? 98
x?? 1.8g
,?x≈1.2g
答:消耗金属锌的质量约为1.2g;(3)从对照表可以得到:硫酸溶液质量分数从10%至98%不断增大,硫酸溶液的密度也在不断增大;假设硫酸溶液的密度为ρ,
10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数=①当ρ=1.07g/ml时,混合后溶液的质量分数=;②当ρ=1.84g/ml时,混合后溶液的质量分数=。
所以10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在0.52b%?0.65b%之间。
21.12.5g 50g
【解析】根据溶质质量分数=×100%计算解答。解: 100g溶质的质量分数为10%的食盐溶液中溶质质量=100g×10%=10g。⑴、设需要加入的食盐的质量为x。则(100g+x)×20%=10g+x 解得x=12.5g;⑵、设蒸发水的质量为y。则(100g-y)×20%=10g 解得 y=50g。答:⑴、加入食盐12.5克;⑵ 、也可以蒸发水50克。
点睛:掌握溶质质量分数=×100%是解题关键。
一、单选题(每小题只有一个正确答案)
1.如图是甲、乙、丙三种物质的溶解度曲线,从图中获得的信息错误的是( )
A.t1℃时甲、乙、丙三者的溶解度相等
B.甲的溶解度受温度的影响最大
C.要使t1℃时甲的饱和溶液变成不饱和溶液可以采取升高温度的方法
D.t2℃ 时,往100g水中加入90g甲,充分搅拌后得到190g甲的溶液
2.某初三年级的同学正在筹备毕业晚会,预定有以下饮料,其中不属于溶液的是( )
A.啤酒 B.酸奶 C.矿泉水 D.可口可乐
3.一只盛有饱和石灰水溶液的烧杯放置在空气中,较长时间后,石灰水表面形成了一层白膜(假设水没有减少、温度不变),则下列说法正确的是( )
A. 此时该溶液仍为饱和溶液 B. “白膜”为析出的氢氧化钙固体
C. 形成“白膜”的过程为物理变化 D. 若加热饱和石灰水溶液,溶液可能会变浑浊
4.下列有关计算结果错误的是( )
A.K2Cr2O7中Cr元素的化合价为+6价
B.C2H4与C4H8中碳元素和氢元素的质量比相同,均为1:2
C.NH4NO3中氮元素的质量分数为35%
D.20℃时,NaCl的溶解度为36g,故该温度下50g水中最多溶解18g NaCl
5.溶液的基本特征是( )
A.含有溶质和溶剂 B.其组成中一定含有水
C.具有无色及透明性 D.具有均一性和稳定性
6.如图所示装置,向试管里的水中加入某种物质后,U形管左边支管的红墨水液面降低,右边支管的红墨水液面上升,则加入的物质可能是( )
A. 氯化钠 B. 生石灰 C. 蔗糖 D. 硝酸铵
7.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸能使紫色石蕊溶液变红,通入CO2后的紫色石蕊溶液变红,所以CO2是酸
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.酸性溶液的pH小于7,食醋是酸性溶液,所以食醋的pH小于7
D.在同一化合物中,金属元素显正价,所以非金属元素一定显负价
8.下列每组中的固体物质,只用水做试剂,不能将其鉴别出来的是( )
A.氢氧化钠、氯化钠 B.氧化铜、铁粉
C.高锰酸钾、碘 D.氧化钙、氢氧化钙
9.如图所示是甲物质的溶解度曲线。把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是( )
A. 溶剂的质量一定变小 B. 溶液的质量可能不变
C. 溶质的质量分数一定变大 D. 溶质的质量一定不变
10.推理是化学学习中常用的思维方法,下列推理正确的是( )
A. 混合物中至少含有两种物质,则混合物中至少含有两种元素
B. 硝酸铵溶于水吸收大量的热,则氢氧化钠溶于水吸收大量的热
C. 物质在发生化学变化时,原子的种类不变,则元素种类也不会改变
D. 利用红磷燃烧的方法可以测定空气中氧气的含量,则利用木炭也可以
11.下列说法中,错误的是( )
A. 铁、锌、钙、硒、碘都是人体必需的微量元素
B. 洗洁精除去餐具上的油污是“乳化作用”
C. 在铁桶中加入硫酸铜溶液和石灰水配制杀菌剂的操作欠妥
D. 蛋白质是重要的营养物质,常吃鱼、虾、大豆都能补充蛋白质
12.t1℃时,将等质量的硝酸钾和氯化钾分别放入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是( )
A. 烧杯①的溶液是硝酸钾溶液
B. 烧杯①的溶液一定是不饱和溶液
C. 若将烧杯①和烧杯②的溶液升温到t2℃时,溶质的质量分数相等
D. 若烧杯②的溶液升温到t2时,烧杯底部还有部分物质不溶解
二、填空题
13.试选用“>”或“<”或“=”填空。
(1)空气中气体成分的体积分数:氧气 稀有气体;
(2)通常状况下的液体体积:100mL酒精与100mL水混合 200mL。
(3)室温下,1g硝酸钾饱和溶液中加入1g硝酸钾固体能得到溶液的质量 2g
(4)相同的两段细铁丝生锈的速率:用蒸馏水浸过的铁丝 用食盐水浸过的铁丝
(5)1g硫粉在1g氧气中完全燃烧后生成二氧化硫的质量 2g
(6)熔点:武德合金 其组成金属
14.下表是硝酸钾在不同温度时的溶解度.
温度/℃ 0 20 40 60 80
溶解度/g 13.3 31.6 63.9 110 169
(1)根据上表数据,在右图中绘制硝酸钾的溶解度曲线.
(2)在20℃时,配制100g溶质质量分数为10%的硝酸钾溶液,需要硝酸钾_______g,水_______g。根据溶解度判断,该溶液是________(填“饱和”或“不饱和”)溶液.
(3)现有60℃时接近饱和的硝酸钾溶液,要使它变成饱和溶液,可采用的方法是 ?(写出一种即可)。
15.化学用语是学习和研究化学的重要工具,请按要求完成下列各题:
(1)请用元素符号回答:
①幼儿及青少年缺 _________ 会患佝偻病和发育不良;
②甘蔗是我市主要的经济作物之一,为了增强甘蔗的抗倒伏能力可以适当施用 _________ 肥.
(2)请用离子符号回答:
①食盐的主要成份是氯化钠,它是由 _________ 和氯离子构成的;
②碱具有一些相似的化学性质,是因为碱溶液中都含有 _________ .
(3)请用化学式回答:
①农业上用来改良酸性土壤的是 _________ ;
②碘酒是家庭常备药,碘酒中的溶剂是 _________ .
(4)请用化学方程式回答:
①正常雨水呈弱酸性,原因是 _________ ;
②生活中的铝制品抗腐蚀性能好,原因是 _________ .
16.配制500g 10%的氢氧化钠溶液,需要氢氧化钠固体????? g。若把配制好的氢氧化钠溶液倒入用蒸馏水润洗过的试剂瓶中,溶液的溶质质量分数将?????? (选填“变大”、 “变小”或“不变”)。
17.在40℃时,取等质量的a、b、c三种物质的饱和溶液于三个烧杯中,再分别蒸发等质量的水,并将温度降低到30℃,固体溶解情况如图1所示,图2为a、b、c三种物质的溶解度曲线,回答下列问题:
(1)图2中p点的意义是__________________________,三种物质的溶解度关系为b>a>c时的温度为t,则t的取值范围是________________。
(2)40℃时,烧杯_________(填“甲”、“乙”或“丙”)里溶液中水量最少;根据图1析出固体质量的变化可推测烧杯甲里是________物质的溶液,烧杯乙里是________物质的溶液。
三、实验题
18.利用右图装置证明一氧化碳的部分性质并验证产物。
① 氧化铜为_____色粉末,其中氧元素以_______态存在。
② 加热玻璃管后,a中发生反应的化学方程式是________,
反应后a中固体的质量_________(选填“变大”“变小”或“不变”)。
③ b中盛放的液体所含的溶质是____________________。
④ c处点燃后,火焰呈________色。
⑤ a中发生的反应证明了一氧化碳具有__________性。
19.实验小组同学做了如下实验:
(1)仪器①的名称是 _____________。某同学用A装置制氧气,其他同学认为该装置有个缺陷,改进方法是 ______________________________,将带火星的木条置于a处,若观察到_______________________________,说明已有氧气产生。
(2)B中现象是量筒内涌出柱状的泡沫,可形象地称为“大象牙膏”,其原理主要是H2O2在碘化钾(KI)催化作用下迅速分解,该反应的化学方程式为_____________。
该实验中的发泡剂是洗洁精,洗洁精能除去油污是因为洗洁精具有______作用。
四、计算题
20.质量分数不同的硫酸溶液其密度不相同,对照表如下:
质量分数
10%
20%
30%
40%
50%
60%
70%
80%
90%
98%
密度(g/mL)
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含_________gH2SO4。
(2)列式计算消耗金属锌的质量。
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是 。10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在 至 之间。
21.某温度下,100g溶质的质量分数为10%的食盐溶液,如果使其溶质的质量分数增大一倍,应该
⑴ 加入食盐多少克?
⑵ 也可以蒸发水多少克?
试卷第6页,总6页
参考答案
1.D
【解析】
试题分析:溶解度曲线的纵坐标为溶解度,横坐标为温度,t1℃时甲、乙、丙三者的溶解度曲线交于一点,说明t1℃时甲、乙、丙三者的溶解度相同;甲的溶解度随温度的升高而增加的最快,甲的溶解度受温度影响最大;由图知,甲的溶解度随温度升高而增大,要使t1℃时甲的饱和溶液变成不饱和溶液可以采取升高温度的方法;t2℃ 时,甲的溶解度为80g,故往100g水中加入90g甲,充分搅拌后得到180g甲的溶液.
考点:溶解度与溶解度曲线
2.B
【解析】酸奶属于乳浊液,不是溶液,其他物质都属于溶液.
3.D
【解析】一只盛有饱和石灰水溶液的烧杯放置在空气中,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水;由于溶质减少,溶液称为不饱和溶液;石灰水表面形成了一层白膜是碳酸钙;形成“白膜”的过程有新的物质生成,为化学变化;D、氢氧化钙的溶解度随温度升高而减小,若加热饱和石灰水溶液,溶质析出,溶液会变浑浊。选D
4.B
【解析】A、钾元素显+1价,氧元素显﹣2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(﹣2)×7=0,则x=+6价,故选项说法正确.
B、C2H4与C4H8中碳元素和氢元素的质量比分别为(12×2):(1×4)=6:1,(12×4):(1×8)=6:1,故选项说法错误.
C、NH4NO3中氮元素的质量分数为×100%=35%,故选项说法正确.
D、20℃时,NaCl的溶解度为36g,是指该温度下,100g水中最多溶解36g氯化钠,故该温度下50g水中最多溶解18g 氯化钠,故选项说法正确.
故选:B.
【答案】D
【解析】考点定位分析:本题的考点是溶液的概念、组成及其特点。溶液是指由一种或多种物质分散到另外一种物质里形成的均一、稳定的混合物。溶液的本质特征是均一性、稳定性,属于混合物。
解答过程分析:溶液的特点是均一性和稳定性,其中,均一性是指溶液中各部分的性质和成分均相同(如一瓶溶液中,上下左右等各部分的密度都是一样的);稳定性是指在条件不变(即温度、压强等不改变,溶剂不蒸发等)的情况下,溶液中的溶质永远不会析出(即溶质与溶剂永不分离)。
A、溶液是由溶质和溶剂组成的,含有溶质和溶剂不是溶液的基本特征,故选项错误;
B、溶液的组成中不一定含有水,如碘酒中就不含水,故选项错误;
C、有些溶液是带有颜色的,如硫酸铜溶液是蓝色的,故选项错误;
D、溶液具有均一性、稳定性,故选项正确。故选D
试题总结评价:本题难度不大,主要考查的是溶液基本特征,充分理解溶液特征是即可正确解题。
6.B
【解析】A、氯化钠溶于水既不放热也不吸热,使容器内温度不变,压强不变,液面不发生变化,错误;B、生石灰溶于水放出热量,使容器内温度升高,压强增大,右边液面上升,左边液面下降,正确;C、蔗糖溶于水既不放热也不吸热,使容器内温度不变,压强不变,液面不发生变化,错误;D、硝酸铵溶于水吸热,使容器内温度降低,气压减小,小于外界大气压,右边液面降低,左边液面上升,错误。故选D。
7.C
【解析】
试题分析:A、酸能使紫色石蕊溶液变红,通入CO2后的紫色石蕊溶液变红,是由于CO2能与水反应生成碳酸,而不是CO2是酸,错误,B、溶液中有晶体析出时,溶质质量减小,但溶质的质量分数不一定减小,有可能是饱和溶液蒸发水分析出晶体,此时溶质质量分数不变,错误,C、酸性溶液的pH小于7,食醋是酸性溶液,所以食醋的pH小于7,正确,D、在同一化合物中,金属元素显正价,非金属元素也不一定显负价,如:CuSO4等,错误,故选C
考点:酸的概念,溶质的质量分数的计算,溶液的酸碱性,元素化合价的一般规律
8.B
【解析】
试题分析:B中二者都是黑色固体,且均不能入水中,也不能和水发生反应,无法用水鉴别。故选B.
考点:物质的鉴别
9.B
【解析】
A、甲物质的不饱和溶液变为饱和溶液,溶剂的质量不一定变小,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶剂的质量可能不变,故A错误;B、甲物质的不饱和溶液变为饱和溶液,溶质的质量可能不变,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶质的质量可能不变,故B正确;C、甲物质的不饱和溶液变为饱和溶液,溶质的质量分数不一定变大,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶质的质量分数可能不变或变小,故C错误;D、甲物质的不饱和溶液变为饱和溶液,溶液的质量不一定变大,例如用降温的方法使甲物质的不饱和溶液变为饱和溶液,溶液的质量可能不变或变小,故D错误。故选B。
10.C
【解析】A、由两种或两种以上的物质组成的物质叫混合物,混合物不一定至少含有两种元素,比如氧气和臭氧组成的物质是由两种物质组成,是混合物,但是该物质是由一种元素组成的,故错误;
B、硝酸铵溶于水温度降低,氢氧化钠溶于水温度升高,故错误;
C、根据质量守恒定律,物质在发生化学变化时,元素的种类、质量不变,原子的种类、质量、个数不变,故正确;
D、测定空气中氧气含量的原理是利用红磷燃烧耗尽瓶中的氧气,生成固体的五氧化二磷,耗掉多少体积的氧气,就有多少体积的水进入集气瓶中,木炭燃烧后生成了二氧化碳气体,填充了耗掉氧气的体积,故不能用木炭代替红磷,故错误。故选C。
11.A
【解析】A、钙是人体内的常量元素,错误;B、洗洁精使油以小液滴均匀悬浮在水中,随水被冲掉,属于乳化作用,正确;C、铁桶中加入硫酸铜溶液,铁会与硫酸铜反应生成硫酸亚铁和铜,正确;D、蛋白质是重要的营养物质,常吃鱼、虾、大豆都能补充蛋白质,正确。故选A。
12.C
【解析】由图看出,t1℃时,硝酸钾的溶解度小于氯化钾的溶解度。t1℃时,将等质量的硝酸钾和氯化钾分别放入到各盛有100g水的两个烧杯中,充分搅拌后,烧杯②中有固体剩余,说明烧杯②中溶解的固体少,则烧杯②中加入的是硝酸钾。A. 烧杯①的溶液是氯化钾溶液,错误;B. 烧杯①的溶液可能恰好是饱和溶液,错误;C. t2℃时,硝酸钾和氯化钾的溶解度相等,若将烧杯①和烧杯②的溶液升温到t2℃时,两种物质溶解的质量相等,故溶质的质量分数相等,正确;D. t1℃时,烧杯①中的物质完全溶解,升温到t2时,氯化钾的溶解度增大,能溶解的氯化钾增多,而t2时,氯化钾与硝酸钾的溶解度相等,故若烧杯②的溶液升温到t2时,烧杯底部的固体物质全部溶解,错误。故选C。
点睛:要顺利解决此题,就要知道溶解度曲线的意义,并且能根据图看出物质的溶解度受温度影响的大小。
13.> ;< ;<;<;=;< 。
【解析】
试题分析:
(1)空气中气体成分的体积分数,氧气占21%,稀有气体0.94% ;
(2)分子间有间隔,故100mL酒精与100mL水混合体积小于200ml;
(3)饱和溶液是不能继续溶解该溶质的溶液,故1g硝酸钾饱和溶液中加入硝酸钾固体不能继续溶解;
(4)食盐水能加速铁的生锈;
(5)硫与氧气反应的质量比为1:1,故1g硫粉在1g氧气中完全燃烧后生成二氧化硫的质量为2g;
(6)合金的熔点比组成它的纯金属的熔点低;
考点:量的关系
14.(7分)(1)见图(不要求画得很精确)
(2) 10; 90; 不饱和
(3) (2分)加入硝酸钾或降温或恒温蒸发少量水
【解析】(1)先根据表头画好坐标系的纵横坐标,再根据表格中的数据,描点连线即可。(2)硝酸钾的质量:100g×10%=10g,水的质量:100g-10g=90g. 20℃时,硝酸钾的溶解度是31.6g,则此温度下,该溶液为不饱和溶液;(3)硝酸钾的溶解度受温度影响较大,所以将60℃时接近饱和的硝酸钾溶液,变成饱和溶液,可采用的方法:加入硝酸钾或降温或恒温蒸发少量水。
15.(1)钙;钾;(2)钠离子;氢氧根离子;(3)消石灰;酒精;(4)CO2+H2O═H2CO3;4Al+3O2=2Al2O3;
【解析】
试题分析:(1)幼儿及青少年缺钙会患佝偻病和发育不良;肥能促进作物生长健壮,茎杆粗硬,增强抗病虫害和抗倒伏能力,因此为了增强甘蔗的抗倒伏能力可以适当施用钾肥;(2)氯化钠是由氯离子和钠离子构成的;碱具有一些相似的化学性质,是因为碱溶液中都含有氢氧根离子;(3)改良酸性土壤一般用碱性物质来中和,消石灰的主要成分是氢氧化钙,是一种碱性的物质.可用于中和酸性土壤改良土壤结构.碘酒是固态碘和酒精的溶液,其中酒精是溶剂;(4)正常雨水呈弱酸性,原因是空气中的二氧化碳溶于水中生成碳酸.化学方程式为:CO2+H2O═H2CO3;生活中的铝制品抗腐蚀性能好,原因是铝表面易生成一种氧化铝膜,对铝制品起到保护作用,其化学方程式为:4Al+3O2=2Al2O3;
考点:元素的符号及其意义;化学式的书写及意义;化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式
16.50??? 变小
【解析】① 相关知识点:溶质、溶剂、溶液质量的计算? 配制一定质量分数的溶液② 解析思路:溶质的质量=溶液的质量×溶质质量分数,配制好的氢氧化钠溶液倒入用蒸馏水润洗过的试剂瓶中,等于增加了溶剂的质量,溶质质量分数减小。
17. 在30℃时,a和b的溶解度相等 20℃<t<30℃ 丙 b c
【解析】由题中信息知,(1)图2中p点的意义是在30℃时,a和b的溶解度相等。三种物质的溶解度关系为b>a>c时的温度为t,则t的取值范围是20℃<t<30℃ 。(2)40℃时,三种物质的溶解度关系为a>b>c,烧杯丙里溶液中水量最少;根据图1析出固体质量的变化可推测烧杯甲里是b物质的溶液,烧杯乙里是c物质的溶液。
点睛∶本题主要考查溶解度曲线的应用。
18.黑化合CO+CuOCu+CO2变小Ca(OH)2(氢氧化钙、熟石灰)淡蓝还原性
【解析】
①化合态的氧元素指化合物中有氧元素;
②根据反应物、生成物以及反应条件书写反应方程式;结合质量守恒定律填空;
③b中盛放的液体是用来检验二氧化碳气体的;
④根据CO燃烧的现象进行分析;
⑤玻璃管中发生的反应是一氧化碳与氧化铜反应生成铜和二氧化碳.
解:①氧化铜是黑色粉末,氧化铜中氧元素只有化合态存在.
故填:黑;化合;
②一氧化碳与氧化铜在加热的条件下反应,生成铜和二氧化碳;由于氧化铜被还原成了铜,失去氧元素,故质量减小;
故填:CO+CuOCu+CO2;变小;
③一氧化碳与氧化铜在加热的条件下反应,生成铜和二氧化碳,b中盛放的液体是澄清石灰水,用来检验二氧化碳气体的,故该液体所含的溶质是Ca(OH)2(氢氧化钙、熟石灰).
故填:Ca(OH)2(氢氧化钙、熟石灰);
④CO被点燃后,发出淡蓝色火焰;
故填:淡蓝;
⑤一氧化碳与氧化铜反应生成铜和二氧化碳,说明一氧化碳具有还原性.
故填:还原性.
点睛:CO还原CuO。
19. 铁架台 在试管口塞一团棉花 带火星木条复燃 乳化
【解析】(1)根据高锰酸钾制取氧气的实验装置及氧气的检验分析解答;
(2)通常情况下,过氧化氢在某些催化剂的作用下,分解生成水和氧气,根据反应原理书写化学方程式;依据洗洁精的去污原理分析。
解:(1)仪器①的名称是铁架台。实验室用高锰酸钾制取氧气时为防止高锰酸钾粉末进入导管,需在试管口放一团棉花。故改进方法是在试管口塞一团棉花。将带火星的木条置于a处,是在检验是否有氧气生成。检验是否有氧气生成的方法是看带火星的木条是否复燃。故若观察到带火星木条复燃,说明已有氧气产生;
(2)过氧化氢在某些催化剂的作用下分解的化学方程式为2H2O2 2H2O+O2↑。洗洁精能除去油污是因为洗洁精具有乳化作用。
20.(1)18
(2)解:设10mL稀硫酸与锌完全反应消耗锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
X 18.0g×
答:略
(3)质量分数越大密度越大% b%
【解析】(1)根据对照表,98%的浓硫酸的密度为1.84g/mL,10mL98%浓硫酸中溶质硫酸的质量=10mL×1.84g/mL×98%≈18.0g;(2)所取10mL稀硫酸中硫酸的质量=18g×10mL100mL=1.8g,设10mL稀硫酸与锌完全反应消耗锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65? 98
x?? 1.8g
,?x≈1.2g
答:消耗金属锌的质量约为1.2g;(3)从对照表可以得到:硫酸溶液质量分数从10%至98%不断增大,硫酸溶液的密度也在不断增大;假设硫酸溶液的密度为ρ,
10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数=①当ρ=1.07g/ml时,混合后溶液的质量分数=;②当ρ=1.84g/ml时,混合后溶液的质量分数=。
所以10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在0.52b%?0.65b%之间。
21.12.5g 50g
【解析】根据溶质质量分数=×100%计算解答。解: 100g溶质的质量分数为10%的食盐溶液中溶质质量=100g×10%=10g。⑴、设需要加入的食盐的质量为x。则(100g+x)×20%=10g+x 解得x=12.5g;⑵、设蒸发水的质量为y。则(100g-y)×20%=10g 解得 y=50g。答:⑴、加入食盐12.5克;⑵ 、也可以蒸发水50克。
点睛:掌握溶质质量分数=×100%是解题关键。
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
