郑州市2005年高三第一次化学质量检测试题[下学期]
文档属性
| 名称 | 郑州市2005年高三第一次化学质量检测试题[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 97.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-03 00:00:00 | ||
图片预览

文档简介
2005年郑州市高三年级第一次质量检测
化学试题
说明:本试卷分为第Ⅰ卷和第Ⅱ卷,考试时间90分钟,满分100分。请将第Ⅰ卷试题的正确答案用ⅡB铅笔填涂在答题卡上,将第Ⅱ卷试题的正确答案写在答题纸上。
可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32 Cl:35.5 Br:80 Na:23 Al:27 K:39 Fe:56 Cu:64 Ag:108
第Ⅰ卷 选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.有同学将NaOH固体、P2O5固体、无水CaCl2固体划分为一类。据此分类,下列A~D选项中能与这三种物质归为一类的是
A 浓硫酸 B NaCl C 碱石灰 D CaO
2.在装有蒸馏水的烧杯中,悬浮有一个小空心球,要使这小球下沉,可加入的试剂是
A 浓氨水 B Na2SO4溶液 C NaOH溶液 D CH3COOH 溶液
3.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列性质与这些用途无关的性质是
A.导电、导热性好 B.不易生锈 C.密度小 D.强度高
4.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.NaOH溶液[Ba(OH)2溶液] B.FeSO4溶液(KSCN溶液)
C.KI(淀粉溶液) D.Na2SO3溶液(BaCl2溶液)
5.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g);△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(l)+2NH3·H2O(1)+8H2O(1);△H>0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H<0
6.用NA表示阿伏加德罗常数,下列叙述中不正确的是
A.0.1mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA
B.46 g NO2 和 N2O4混合气体中含有原子数为3NA
C.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
D.标准状况下11.2L臭氧中约含有1.5NA个氧原子
7.短周期元素X和Y,X元素位于Y的前一周期,其原子最外电子层只有一个电子,Y原子的次外层电子数是最外层电子数的,则X和Y形成的化合物的化学式可表示为
A.X2Y3 B.X3Y C.XY2 D.X2Y
8.下列各组无色溶液中所含的离子在pH=l时能大量共存的是
A、NH4+、Mg2+、MnO4—、SO42— B、A13+、Cu2+、SO42—、A1O2—
C、Ba2+、K+、NO3—、CO32— D、 Ca2+、Na+、C1—、NO3—
9.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体.下列一定能说明CaF2是离子晶体的实验是
A. CaF2难溶于水,其水溶液的导电性极弱 B. CaF2的熔、沸点较高,硬度较大
C. CaF2固体不导电,但在熔化状态下可以导电 D. CaF2在有机溶剂(如苯)中的溶解度极小
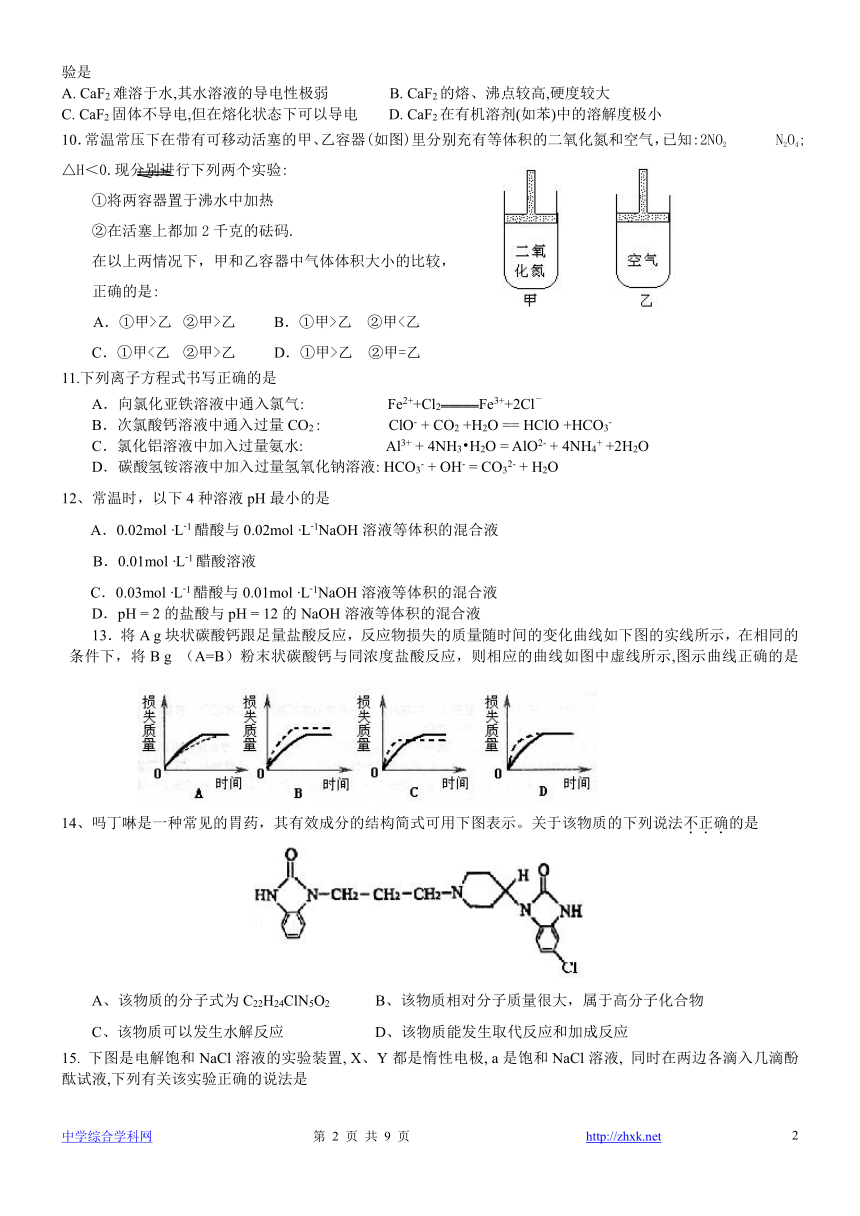
10.常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮和空气,已知:2NO2 N2O4;△H<0.现分别进行下列两个实验:
①将两容器置于沸水中加热
②在活塞上都加2千克的砝码.
在以上两情况下,甲和乙容器中气体体积大小的比较,
正确的是:
A.①甲>乙 ②甲>乙 B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙 D.①甲>乙 ②甲=乙
11.下列离子方程式书写正确的是
A.向氯化亚铁溶液中通入氯气: Fe2++Cl2 Fe3++2Cl-
B.次氯酸钙溶液中通入过量CO2 : ClO- + CO2 +H2O == HClO +HCO3-
C.氯化铝溶液中加入过量氨水: Al3+ + 4NH3?H2O = AlO2- + 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液: HCO3- + OH- = CO32- + H2O
12、常温时,以下4种溶液pH最小的是
A.0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积的混合液
B.0.01mol ·L-1醋酸溶液
C.0.03mol ·L-1醋酸与0.01mol ·L-1NaOH溶液等体积的混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积的混合液
13.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A=B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线如图中虚线所示,图示曲线正确的是
14、吗丁啉是一种常见的胃药,其有效成分的结构简式可用下图表示。关于该物质的下列说法不正确的是
A、该物质的分子式为C22H24ClN5O2 B、该物质相对分子质量很大,属于高分子化合物
C、该物质可以发生水解反应 D、该物质能发生取代反应和加成反应
15. 下图是电解饱和NaCl溶液的实验装置, X、Y都是惰性电极, a是饱和NaCl溶液, 同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是
A. X电极为阳极,Y电极为阴极
B. X电极溶液变红色, 且有刺激性气味气体产生
C. 若将X、Y两极产生的气体收集起来,其体积比略大于1:1
D. 电解后,将溶液混匀,电解前后溶液的pH未发生变化
第Ⅱ卷.非选择题(本卷包括6小题,共55分)
16(9分).(1)已知下列反应在一定条件下可以发生:
H2O2+2 Fe 2++2 H+=2 Fe3++2 H2O
H2O2+2 Fe3+=2 Fe 2++ O2↑+2 H+
在以上反应中Fe 2+实际上起着 作用,总反应式为
(2)I2也与Fe 2+一样发生上述类似反应,类比(1)在下面横线上填入配平的合适的化学反应方程式:
H2O2+I2=2HIO
总反应式为
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2I-=I2+ O2↑+2 H+,这个方程式正确吗?
若正确,理由是
若不正确,原因是(若认为正确,该步不必作答)
正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式) 、
17(9分).某学校化学研究性学习小组在制取某些有毒气体时,为了尽量防止毒气造成大气污染而设计了图I装置,并打算用图II装置代替图I中的虚线部分以求达到同样的目的。
(1)仪器a的名称为 ,仪器b的名称为
(2)若用(I)制取氯气,a中发生反应的化学反应方程式为
C瓶中加入的液体一般为 。在选取试剂正确且适量的前提下反应开始,当关闭活塞后发现d中液面上升并不明显,可能的原因是 。检查原因的简单方法是
。
(3)装置(I)虚线部分能防止多余气体逸散的原因是 。
(4)用(II)代替(I)中的虚线部分,你认为可行吗? ,
原因是 。
18.(10分) A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物, F、H常温下呈气态,B常温下呈液态,其中F是人类生存不能离开的气态单质,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
(1)写出C的电子式
(2)写出反应①的化学反应方程式
(3)列出两种E能发生的反应类型
(4)写出过量的H与D溶液反应的离子反应方程式
(5)实验室制取H的装置可以选用下列装置中的 选项。
19(9分).已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01 mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性.请回答下列问题:
(1) 高碘酸是 (填“强酸”或“弱酸”),理由是
(2) 0.01 mol·L-1的碘酸( HIO3)溶液与pH=12的NaOH溶液等体积混合后所得溶液中IO3-与Na+的关系是 (填“大于”、“小于”或“等于”)
(3)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的还原剂是 ,
该反应的离子方程式可表示为
20(10分). 芳香化合物A、B互为同分异构体,B的结构简式是
A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
B可以发生的反应类型有(填序号)
① 加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
E中含有官能团的名称是
A有两种可能的结构,其对应的结构简式为
B、C、D、F、G化合物中互为同系物的是
F与H在浓硫酸作用下加热时发生反应的方程式为
21(8分)、在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)3Z(气),已知加入2 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入4 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入3 mol X和2 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y, mol Z,才能使平衡时Z为0.6a mol。
2005年郑州市高三年级第一次质量检测
化学答题纸
第Ⅰ卷 选择题(本题包括15小题,每小题3分,共45分)
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
答案
第Ⅱ卷 非选择题(本卷包括6小题,共55分)
16(9分).
(1) , 。
(2)
(3)
若正确,理由是
若不正确,原因是(若认为正确,该步不必作答)
、
17(9分).
(1) , 。
(2) 。
,
,
。
(3) 。
(4) ,
。
18.(10分)
(1)
(2)
(3)
(4)
(5)
19(9分).
(1) ; 。
(2) 。
(3) , 。
20(10分).
(1)
(2)
(3) 、
(4)
(5)
21(8分)、
(1) 。
(2)
(3) , 。
参考答案和评分标准
第Ⅰ卷 选择题(本题包括15小题,每小题3分,共45分)
题号
1
2
3
4
5
6
7
8
答案
D
A
A
D
D
A
D
D
题号
9
10
11
12
13
14
15
答案
C
B
B
B
D
B
C
第Ⅱ卷 非选择题(本卷包括6小题,共55分)
16(9分)
(1)催化剂(1分),2H2O2 2H2O+2 O2↑(1分)
(2)2HIO+ H2O2=I2+ H2O+ O2 (2分) 2 H2O22 H2O+ O2↑(1分)
(3)不正确(1分),O元素和I元素的化合价均上升,没有化合价降低的元素(1分),
H2O2+2I-+2H+=2 H2O+I2 (1分) 2 H2O22 H2O+ O2↑(1分)
17. (9分)
(1)分液漏斗(1分),烧瓶(1分)
(2)MnO2+4HClMnCl2+ Cl2↑+2H2O(1分)
饱和食盐水(1分),装置漏气(1分),用湿润的淀粉碘化钾试纸靠近各连接处检查,漏气处试纸变蓝色(1分)。
(3)关闭活塞后,若b处仍有气体产生,气体压强增大,将c中液体压入d中,整个装置成为储气装置,不会有气体逸出。(1分)
(4)不可行(1分), (II)中后面的集气瓶密闭,气体无法通入(1分)。
18(10分)(1)Na+[ O O ]2- Na+ (2分)
(2)CaC2+2H2O→Ca (OH)2+C2H2↑(2分)
(3)加成反应,氧化反应,聚合反应中的任意两种。(2分)
(4)CO2+OH-=HCO3- (2分) (5) B、D (2分)
19(9分).
(1) 弱酸(1分),由于高碘酸溶液中的c(H+)与NaOH溶液中的c(OH-)相等,二者等体积混合后,混合液显酸性,说明酸过量(1分),原高碘酸溶液中只有一部分高碘酸分子发生了电离,故高碘酸是弱酸.(1分)
(2)等于(2分)
(3)硫酸锰(1分),5 HIO4+2Mn2++3H2O = 2MnO4-+5 IO3-+11H+(3分,反应物、产物均写对得1分,配平正确得2分)
20(10分)
(1) ①④ (2分) (2) 羟基、羧基(2分)
(3)
(1分) (1分)
(4)C、F (2分) (5)CH3COOH+CH3CH2OHCH3COOCH2CH3+H20(2分)
21(8分)
(1)2 a mol (2分) (2)15(2分) (3)0.4(2分), 2.1 (2分)
化学试题
说明:本试卷分为第Ⅰ卷和第Ⅱ卷,考试时间90分钟,满分100分。请将第Ⅰ卷试题的正确答案用ⅡB铅笔填涂在答题卡上,将第Ⅱ卷试题的正确答案写在答题纸上。
可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32 Cl:35.5 Br:80 Na:23 Al:27 K:39 Fe:56 Cu:64 Ag:108
第Ⅰ卷 选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.有同学将NaOH固体、P2O5固体、无水CaCl2固体划分为一类。据此分类,下列A~D选项中能与这三种物质归为一类的是
A 浓硫酸 B NaCl C 碱石灰 D CaO
2.在装有蒸馏水的烧杯中,悬浮有一个小空心球,要使这小球下沉,可加入的试剂是
A 浓氨水 B Na2SO4溶液 C NaOH溶液 D CH3COOH 溶液
3.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列性质与这些用途无关的性质是
A.导电、导热性好 B.不易生锈 C.密度小 D.强度高
4.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.NaOH溶液[Ba(OH)2溶液] B.FeSO4溶液(KSCN溶液)
C.KI(淀粉溶液) D.Na2SO3溶液(BaCl2溶液)
5.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g);△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(l)+2NH3·H2O(1)+8H2O(1);△H>0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H<0
6.用NA表示阿伏加德罗常数,下列叙述中不正确的是
A.0.1mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA
B.46 g NO2 和 N2O4混合气体中含有原子数为3NA
C.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
D.标准状况下11.2L臭氧中约含有1.5NA个氧原子
7.短周期元素X和Y,X元素位于Y的前一周期,其原子最外电子层只有一个电子,Y原子的次外层电子数是最外层电子数的,则X和Y形成的化合物的化学式可表示为
A.X2Y3 B.X3Y C.XY2 D.X2Y
8.下列各组无色溶液中所含的离子在pH=l时能大量共存的是
A、NH4+、Mg2+、MnO4—、SO42— B、A13+、Cu2+、SO42—、A1O2—
C、Ba2+、K+、NO3—、CO32— D、 Ca2+、Na+、C1—、NO3—
9.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体.下列一定能说明CaF2是离子晶体的实验是
A. CaF2难溶于水,其水溶液的导电性极弱 B. CaF2的熔、沸点较高,硬度较大
C. CaF2固体不导电,但在熔化状态下可以导电 D. CaF2在有机溶剂(如苯)中的溶解度极小
10.常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮和空气,已知:2NO2 N2O4;△H<0.现分别进行下列两个实验:
①将两容器置于沸水中加热
②在活塞上都加2千克的砝码.
在以上两情况下,甲和乙容器中气体体积大小的比较,
正确的是:
A.①甲>乙 ②甲>乙 B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙 D.①甲>乙 ②甲=乙
11.下列离子方程式书写正确的是
A.向氯化亚铁溶液中通入氯气: Fe2++Cl2 Fe3++2Cl-
B.次氯酸钙溶液中通入过量CO2 : ClO- + CO2 +H2O == HClO +HCO3-
C.氯化铝溶液中加入过量氨水: Al3+ + 4NH3?H2O = AlO2- + 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液: HCO3- + OH- = CO32- + H2O
12、常温时,以下4种溶液pH最小的是
A.0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积的混合液
B.0.01mol ·L-1醋酸溶液
C.0.03mol ·L-1醋酸与0.01mol ·L-1NaOH溶液等体积的混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积的混合液
13.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A=B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线如图中虚线所示,图示曲线正确的是
14、吗丁啉是一种常见的胃药,其有效成分的结构简式可用下图表示。关于该物质的下列说法不正确的是
A、该物质的分子式为C22H24ClN5O2 B、该物质相对分子质量很大,属于高分子化合物
C、该物质可以发生水解反应 D、该物质能发生取代反应和加成反应
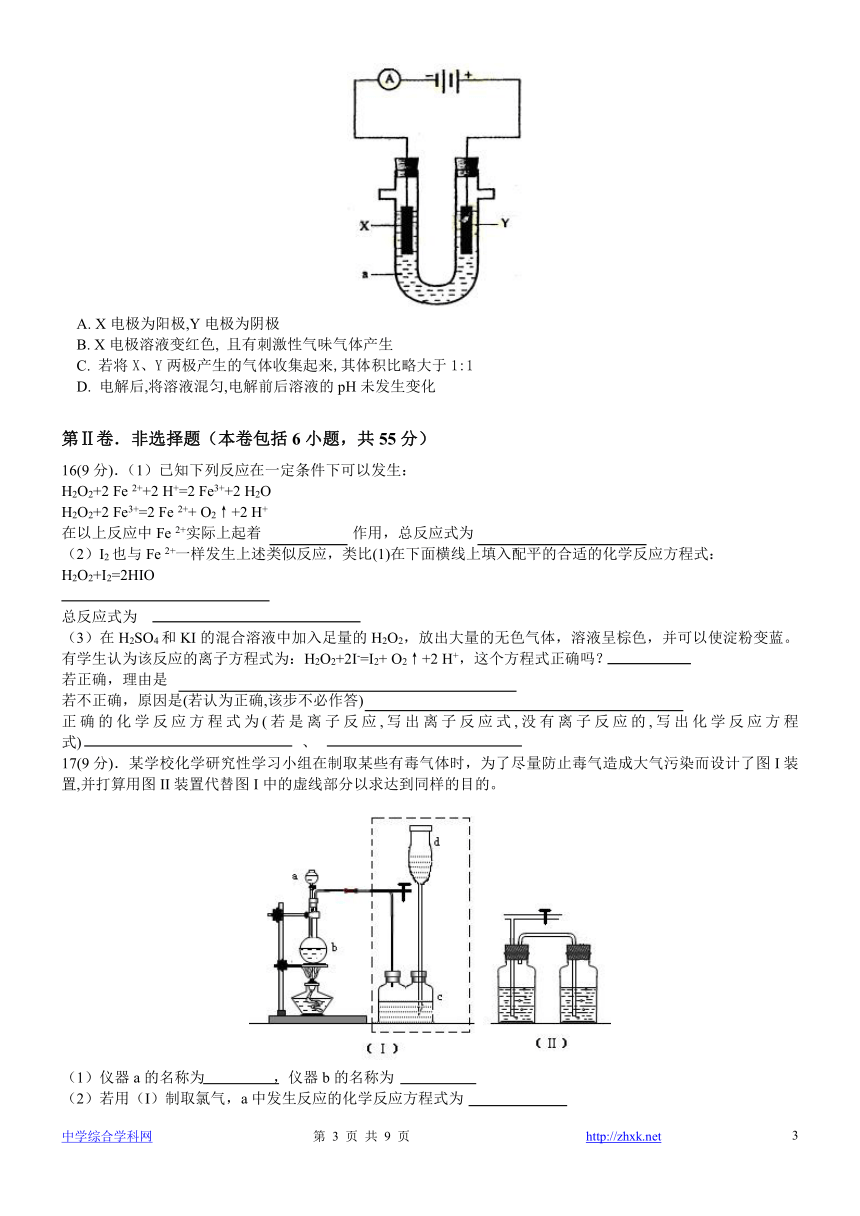
15. 下图是电解饱和NaCl溶液的实验装置, X、Y都是惰性电极, a是饱和NaCl溶液, 同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是
A. X电极为阳极,Y电极为阴极
B. X电极溶液变红色, 且有刺激性气味气体产生
C. 若将X、Y两极产生的气体收集起来,其体积比略大于1:1
D. 电解后,将溶液混匀,电解前后溶液的pH未发生变化
第Ⅱ卷.非选择题(本卷包括6小题,共55分)
16(9分).(1)已知下列反应在一定条件下可以发生:
H2O2+2 Fe 2++2 H+=2 Fe3++2 H2O
H2O2+2 Fe3+=2 Fe 2++ O2↑+2 H+
在以上反应中Fe 2+实际上起着 作用,总反应式为
(2)I2也与Fe 2+一样发生上述类似反应,类比(1)在下面横线上填入配平的合适的化学反应方程式:
H2O2+I2=2HIO
总反应式为
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2I-=I2+ O2↑+2 H+,这个方程式正确吗?
若正确,理由是
若不正确,原因是(若认为正确,该步不必作答)
正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式) 、
17(9分).某学校化学研究性学习小组在制取某些有毒气体时,为了尽量防止毒气造成大气污染而设计了图I装置,并打算用图II装置代替图I中的虚线部分以求达到同样的目的。
(1)仪器a的名称为 ,仪器b的名称为
(2)若用(I)制取氯气,a中发生反应的化学反应方程式为
C瓶中加入的液体一般为 。在选取试剂正确且适量的前提下反应开始,当关闭活塞后发现d中液面上升并不明显,可能的原因是 。检查原因的简单方法是
。
(3)装置(I)虚线部分能防止多余气体逸散的原因是 。
(4)用(II)代替(I)中的虚线部分,你认为可行吗? ,
原因是 。
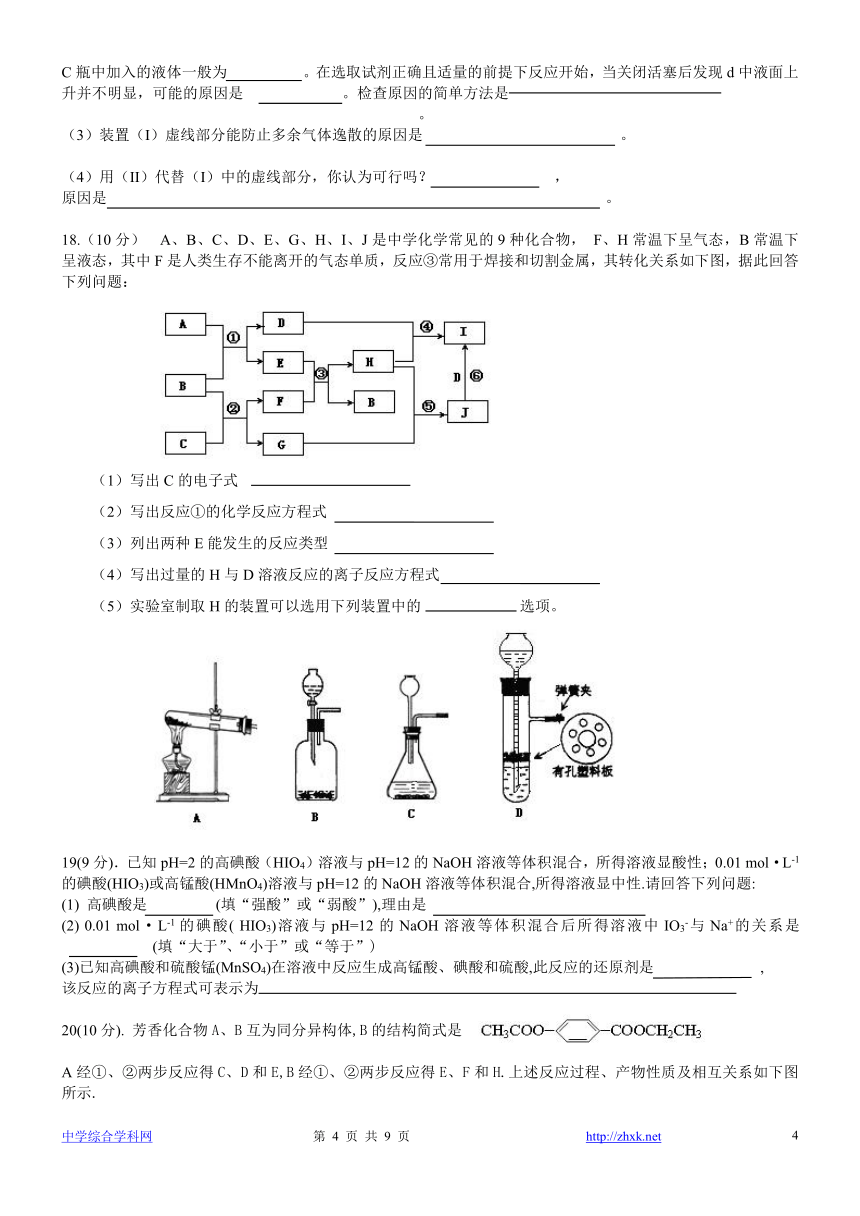
18.(10分) A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物, F、H常温下呈气态,B常温下呈液态,其中F是人类生存不能离开的气态单质,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题:
(1)写出C的电子式
(2)写出反应①的化学反应方程式
(3)列出两种E能发生的反应类型
(4)写出过量的H与D溶液反应的离子反应方程式
(5)实验室制取H的装置可以选用下列装置中的 选项。
19(9分).已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01 mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性.请回答下列问题:
(1) 高碘酸是 (填“强酸”或“弱酸”),理由是
(2) 0.01 mol·L-1的碘酸( HIO3)溶液与pH=12的NaOH溶液等体积混合后所得溶液中IO3-与Na+的关系是 (填“大于”、“小于”或“等于”)
(3)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的还原剂是 ,
该反应的离子方程式可表示为
20(10分). 芳香化合物A、B互为同分异构体,B的结构简式是
A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
B可以发生的反应类型有(填序号)
① 加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
E中含有官能团的名称是
A有两种可能的结构,其对应的结构简式为
B、C、D、F、G化合物中互为同系物的是
F与H在浓硫酸作用下加热时发生反应的方程式为
21(8分)、在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)3Z(气),已知加入2 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入4 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入3 mol X和2 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y, mol Z,才能使平衡时Z为0.6a mol。
2005年郑州市高三年级第一次质量检测
化学答题纸
第Ⅰ卷 选择题(本题包括15小题,每小题3分,共45分)
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
答案
第Ⅱ卷 非选择题(本卷包括6小题,共55分)
16(9分).
(1) , 。
(2)
(3)
若正确,理由是
若不正确,原因是(若认为正确,该步不必作答)
、
17(9分).
(1) , 。
(2) 。
,
,
。
(3) 。
(4) ,
。
18.(10分)
(1)
(2)
(3)
(4)
(5)
19(9分).
(1) ; 。
(2) 。
(3) , 。
20(10分).
(1)
(2)
(3) 、
(4)
(5)
21(8分)、
(1) 。
(2)
(3) , 。
参考答案和评分标准
第Ⅰ卷 选择题(本题包括15小题,每小题3分,共45分)
题号
1
2
3
4
5
6
7
8
答案
D
A
A
D
D
A
D
D
题号
9
10
11
12
13
14
15
答案
C
B
B
B
D
B
C
第Ⅱ卷 非选择题(本卷包括6小题,共55分)
16(9分)
(1)催化剂(1分),2H2O2 2H2O+2 O2↑(1分)
(2)2HIO+ H2O2=I2+ H2O+ O2 (2分) 2 H2O22 H2O+ O2↑(1分)
(3)不正确(1分),O元素和I元素的化合价均上升,没有化合价降低的元素(1分),
H2O2+2I-+2H+=2 H2O+I2 (1分) 2 H2O22 H2O+ O2↑(1分)
17. (9分)
(1)分液漏斗(1分),烧瓶(1分)
(2)MnO2+4HClMnCl2+ Cl2↑+2H2O(1分)
饱和食盐水(1分),装置漏气(1分),用湿润的淀粉碘化钾试纸靠近各连接处检查,漏气处试纸变蓝色(1分)。
(3)关闭活塞后,若b处仍有气体产生,气体压强增大,将c中液体压入d中,整个装置成为储气装置,不会有气体逸出。(1分)
(4)不可行(1分), (II)中后面的集气瓶密闭,气体无法通入(1分)。
18(10分)(1)Na+[ O O ]2- Na+ (2分)
(2)CaC2+2H2O→Ca (OH)2+C2H2↑(2分)
(3)加成反应,氧化反应,聚合反应中的任意两种。(2分)
(4)CO2+OH-=HCO3- (2分) (5) B、D (2分)
19(9分).
(1) 弱酸(1分),由于高碘酸溶液中的c(H+)与NaOH溶液中的c(OH-)相等,二者等体积混合后,混合液显酸性,说明酸过量(1分),原高碘酸溶液中只有一部分高碘酸分子发生了电离,故高碘酸是弱酸.(1分)
(2)等于(2分)
(3)硫酸锰(1分),5 HIO4+2Mn2++3H2O = 2MnO4-+5 IO3-+11H+(3分,反应物、产物均写对得1分,配平正确得2分)
20(10分)
(1) ①④ (2分) (2) 羟基、羧基(2分)
(3)
(1分) (1分)
(4)C、F (2分) (5)CH3COOH+CH3CH2OHCH3COOCH2CH3+H20(2分)
21(8分)
(1)2 a mol (2分) (2)15(2分) (3)0.4(2分), 2.1 (2分)
同课章节目录
