浙江省名师刘卫捐2007年高考化学预测试题(2[下学期]
文档属性
| 名称 | 浙江省名师刘卫捐2007年高考化学预测试题(2[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 98.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-05-17 20:42:00 | ||
图片预览



文档简介
浙江省武义第一中学2007年高考预测试题(2)
浙江 武义一中 刘卫捐
本测试分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分,时间120分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 3 5.5
K 39 Ca 40 Fe 56 Cu 64 Zn 65
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
2.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——二氧化碳 B.光化学污染——二氧化氮
C.酸雨——二氧化碳 D.臭氧层破坏——氟氯烃
3.下列物质的电子式书写正确的是
A.NaCl B.H2S
C.-CH3 D.NH4I
4.下列有关实验问题的处理方法正确的是
A.浓硫酸不慎溅到皮肤上,应立即用碳酸钠溶液冲洗
B. 制备气体时为防止气流不通畅,应检查乳胶管是否弯折堵塞
C.燃着的酒精灯打翻在桌面上引起失火,可用水浇灭
D.铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体
5.在pH=1的溶液中,大量存在着的阳离子是NH4+、Mg2+、Al3+、Fe2+,则溶液中还可能大量存在的阴离子是
A.Cl— B.ClO— C.HCO3— D.NO3—
6.101kPa时,2g辛烷完全燃烧生成二氧化碳气体和液态水,放出96.81kJ热量,则下列表示辛烷燃烧热的热化学方程式正确的是
A.2 C8H18 (l)+25O2(g) 16CO2(g)+18H2O(1);△H=—96.81kJ·mol-1
B.C8H18 (l)+25/2O2(g) 8CO2(g)+9H2O(1);△H=+5 518kJ·mol-1
C.2 C8H18 (l)+25O2(g) 16CO2(g)+18H2O(1);△H=—11 036kJ·mol-1
D.C8H18 (l)+25/2O2(g) 8CO2(g)+9H2O(1);△H=—5 518kJ·mol-1
7.三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到,反应的化学方程式为:4NH3+3F2 NF3+3NH4F。下列有关NF3的叙述不正确的是
A.NF3的氧化性比F2强 B.NF3是共价化合物
C.NF3中N呈+3价 D.NF3分子呈三角锥形
8.已知20oC时,CuSO4的溶解度为20g。此温度下将36g的无水硫酸铜放入100g水中,
充分搅拌后,所得溶液的质量约为
A.136 g B.120g C.116g D.108g
二、选择题(本题包括10小题,第9—16题每小题4分,第17、18小题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题为0分)
9.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数可能是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
10.在常温下100mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于
7,则对反应后溶液的叙述正确的是
A.V(混合液)≥200mL B.V(混合液)≤200mL
C.c(H+)= c(OH-)< c(K+)< c(A-) D.c(A-)= c(K+)
11.某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥NO、⑦NO2、⑧SO2,下列操作正确的是
A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
12.设NA表示阿伏加德罗常数,下列有关叙述不正确的是
A.1 mol OH—所含的电子数为10NA
B.含0.01mol FeCl3的饱和溶液制成的氢氧化铁胶体中所含胶粒数小于0.01NA
C.常温常压下,NA个氢分子的体积大于22.4L
D.0.1mol KO2与水反应生成氧气和氢氧化钾时,转移的电子数为0.1NA
13.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至沉淀刚好完全:
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B.氨气溶于醋酸溶液:NH3 + H+ = NH4+
C.澄清石灰水与少量小苏打溶液混合:
Ca2+ + OH—+ HCO3— = CaCO3↓ + H2O
D.将少量SO2气体通入NaClO溶液中:SO2 + H2O + ClO—=SO42— + Cl— + 2H+
14.某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是
①及时向上风口和地势较高处转移疏散人群;②及时戴上用浓烧碱溶液湿润过的口罩;③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;④及时戴上用稀纯碱溶液湿润过的口罩;⑤及时用毛巾包裹活性炭捂住口鼻;⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
15.曲酸是一种非常有潜力的食品添加剂,其结构简式如下图所示,试推测曲酸可能具有的性质为:
A.能发生酯化反应
B.可溶于水、醇
C.能发生水解反应
D.具有强酸性
16.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.a电极是负极
B.b电极的电极反应为:4OH— — 4e— = 2H2O + O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂
全部储藏在电池内的新型发电装置
17.在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是
A.最后得到的溶液中不含有Fe3+ B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+ D.残余固体一定全部是铜
18.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
姓名___________ 得分__________
第Ⅱ卷(非选择题 共76分)
三、(本题包括两小题,共22分)
19.(10分)试回答下列中学化学实验室中常见仪器的有关问题:
(1)在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平 中,标有“0”刻度的是(填序号,下同)__________________;标有使用温度的仪器是_________________________。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器 ①试管、②分液漏斗、③细口试剂瓶、④广口试剂瓶、⑤集气瓶、⑥滴瓶、⑦酸式滴定管、⑧碱式滴定管 中,用到“磨砂”的有______________________________。
(3)在仪器①漏斗、②容量瓶、③蒸馏烧瓶、④分液漏斗、⑤烧杯、⑥蒸发皿 中,可用于粗盐提纯实验的有 ;可用于分离两种沸点接近且互不相溶的液态混合物实验的有 。
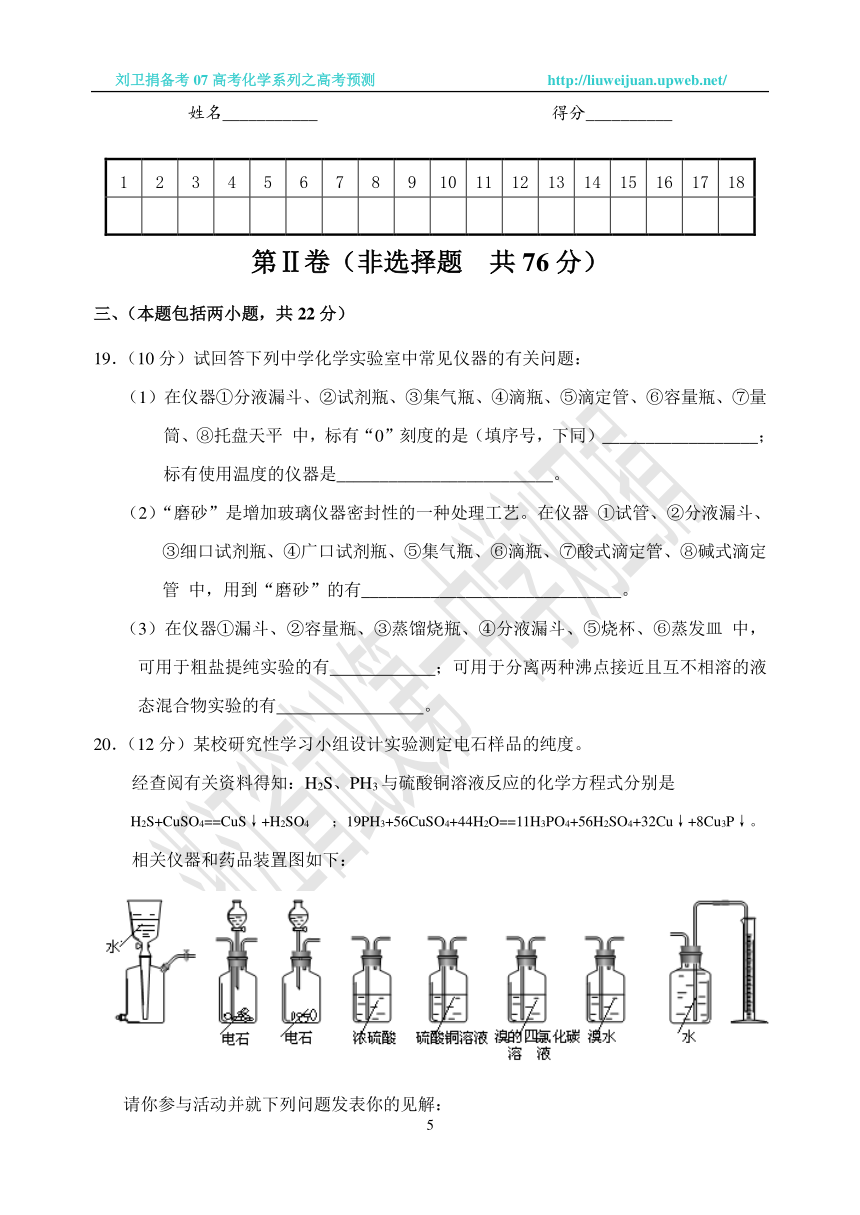
20.(12分)某校研究性学习小组设计实验测定电石样品的纯度。
经查阅有关资料得知:H2S、PH3与硫酸铜溶液反应的化学方程式分别是
H2S+CuSO4==CuS↓+H2SO4 ;19PH3+56CuSO4+44H2O==11H3PO4+56H2SO4+32Cu↓+8Cu3P↓。
相关仪器和药品装置图如下:
A B C D E F G H
请你参与活动并就下列问题发表你的见解:
⑴按气体从左到右的流向选择合理的装置组合是(选填字母序号):
⑵经小组同学讨论认为乙炔的吸收装置选用F装置最佳。理由是:
⑶为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是 。
⑷若电石样品的质量为m1 g,F吸收乙炔前后的质量差为m2 g,则电石样品中CaC2质量分数ω(CaC2)= 。
四、(本题包括两小题,共18分)
21.(8分)混合物平均摩尔质量通常可表示为:,利用此概念可以讨论许多化学问题:
⑴相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度,理由是: ;
⑵在一定条件下的密闭容器中,存在如下平衡:C(s)+H2O(g)CO(g)+H2 (g);假如温度保持不变并加压,则(混合气)将 (填写“变大”、“变小”或“不变”);
⑶以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)= mol(用含a的代数式表示)。
22.(10分)江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
试填写下列空白:
⑴N的化学式为: ;
⑵写出反应①的化学方程式: ;
⑶由K溶液经如何处理才能制得N?
。
五、(本题包括2小题,共18分)
23.(8分)乙烯在不同的条件下可被氧化成不同的产物。如下图所示:
请回答下列问题:
(1)已知烯醇很不稳定,很快会发生异构化,形成稳定的羰基( )化合物,如:RCH=CH-OH→R-CH2-CHO。取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜而B不能。
则A、B的结构简式分别为 、 。
写出C发生银镜反应的化学方程式 。
(2)D有多种同分异构体,其中有一种叫过氧乙酸,过氧乙酸具有很强的氧化性和腐蚀性,可作杀虫剂、杀菌剂。则过氧乙酸的结构简式为: 。
24.(10分)在有机分析中,常用臭氧化分解来确定有机物中碳碳双键的位置与数目。如:
(CH3)2C=CH-CH3 (CH3)2C=O+CH3CHO
已知某有机物A经臭氧化分解后发生下列一系列的变化:
试回答下列问题:
(1)有机物A、F的结构简式为A: 、F: 。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是 。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)写出下列变化的化学方程式。
①I水解生成E和H: ;
②F制取G: 。
六、(本题包括2小题,共18分)
25.(6分)某有机物A由C、H、O三种元素组成,其分子中有8个原子、46个质子,将其完全燃烧,在相同条件下测得产物CO2气体和水蒸气的体积比为2∶1。另取0.45 g有机物A恰好与10 mL 1 mol·L-1 NaHCO3溶液完全反应。求:
(1)有机物分子式; (2)有机物结构简式。
26.(12分)为测定镁铝合金的成分,取13.5g合金全部溶于500mL 3 mol·L—1的H2SO4中,充分反应后,再加入400mL 8 mol·L—的NaOH溶液,结果得到了白色沉淀。
⑴若只有一种沉淀,试确定合金中镁的质量分数范围。
⑵请写出沉淀质量与合金中铝的质量{m(Al)}的关系式{用含m(Al)的函数关系式表达},并求沉淀质量的范围。
高三化学综合练习(2)
参考答案
第Ⅰ卷
题号
1
2
3
4
5
6
7
8
答案
B
C
C
B
A
D
A
D
题号
9
10
11
12
13
14
15
16
17
18
答案
BC
BD
A
D
CD
C
AB
B
AB
BC
第Ⅱ卷
19.(各小题全对得2分、漏写得1分、不写或错写得0分)
⑴⑤⑧ ⑤⑥⑦ ⑵②③④⑤⑥⑦ ⑶①⑤⑥ ④⑤
20.⑴A、B、D、E、F(3分,整体给分); ⑵饱和食盐水(2分)。
⑶由于溴在四氯化碳中溶解度较大,溴不易挥发,吸收乙炔的效果较好,所以选择F(2分);而排水法测定精度不高,故不选择H(1分);溴水具有较强的发挥性,同样测定精度不高,故也不选择G。
⑷32m2/13m1或64m2/26m1或2.46m2/m1(3分)。
21.⑴<(1分);因为(空气)=29g/mol,M(水)=18g/mol,则(总)必小于29g/mol(2分);
⑵变大(2分);⑶3a/442 mol(3分)。
22.⑴Mg(2分); ⑵NaCl(饱和)+NH3+CO2+H2O==NaHCO3↓+NH4Cl(4分);
⑶MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁(4分)。
23.(1)A: (2分) B: (2分)
CH3CHO + 2[Ag(NH3)2]OHCH3COONH4 + 2Ag↓+ 3NH3 +H2O(2分)
(2)CH3COOOH(2分)
24.(1)A: (2分)F: (2分)
(2)B(2分)
(3)①
(2分)
②
(2分)
25.(6分)解: 设有机物分子式CxHyOz
因为V(CO2)/V(H2O)=2/1 所以n(C)/n(H)=1/1 (1分)
根据题意 所以:分子式C2H2O4 (2分)
(1分)
所以:有机物分子中含有两个羧基,有机物为二元羧酸,结构简式 (2分)
26.(12分)(1)n(Na+)=8 mol·L—1×0.4L=3.2 mol
n(SO)=3 mol·L—1×0.5L=1.5 mol (1分)
若沉淀只有Mg(OH)2时,则溶液中只有Na+、AlO、SO,且为电中性。
则n(Na+)= 2n(SO)+n(AlO) (2分)
n(Al)=n(AlO)=0.2 mol
m(Al)=0.2 g×27 g·mol-1=5.4 g
m(Mg)=13.5 g-5.4 g=8.1 g (1分)
则60%≤ω(Mg)<100% (2分)
(5分)(2)当m(Al)≤5.4g时,m(沉)= 58[13.5-m(Al)] /24 (2分)
当5.4g<m(Al)<13.5g,m(沉)= 78 [m(Al)-5.4] /27 + 58[(13.5-m(Al))]/24 (2分)
19.575≤m(沉)<32.625 (2分)
浙江 武义一中 刘卫捐
本测试分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分,时间120分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 3 5.5
K 39 Ca 40 Fe 56 Cu 64 Zn 65
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
2.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——二氧化碳 B.光化学污染——二氧化氮
C.酸雨——二氧化碳 D.臭氧层破坏——氟氯烃
3.下列物质的电子式书写正确的是
A.NaCl B.H2S
C.-CH3 D.NH4I
4.下列有关实验问题的处理方法正确的是
A.浓硫酸不慎溅到皮肤上,应立即用碳酸钠溶液冲洗
B. 制备气体时为防止气流不通畅,应检查乳胶管是否弯折堵塞
C.燃着的酒精灯打翻在桌面上引起失火,可用水浇灭
D.铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体
5.在pH=1的溶液中,大量存在着的阳离子是NH4+、Mg2+、Al3+、Fe2+,则溶液中还可能大量存在的阴离子是
A.Cl— B.ClO— C.HCO3— D.NO3—
6.101kPa时,2g辛烷完全燃烧生成二氧化碳气体和液态水,放出96.81kJ热量,则下列表示辛烷燃烧热的热化学方程式正确的是
A.2 C8H18 (l)+25O2(g) 16CO2(g)+18H2O(1);△H=—96.81kJ·mol-1
B.C8H18 (l)+25/2O2(g) 8CO2(g)+9H2O(1);△H=+5 518kJ·mol-1
C.2 C8H18 (l)+25O2(g) 16CO2(g)+18H2O(1);△H=—11 036kJ·mol-1
D.C8H18 (l)+25/2O2(g) 8CO2(g)+9H2O(1);△H=—5 518kJ·mol-1
7.三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到,反应的化学方程式为:4NH3+3F2 NF3+3NH4F。下列有关NF3的叙述不正确的是
A.NF3的氧化性比F2强 B.NF3是共价化合物
C.NF3中N呈+3价 D.NF3分子呈三角锥形
8.已知20oC时,CuSO4的溶解度为20g。此温度下将36g的无水硫酸铜放入100g水中,
充分搅拌后,所得溶液的质量约为
A.136 g B.120g C.116g D.108g
二、选择题(本题包括10小题,第9—16题每小题4分,第17、18小题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题为0分)
9.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数可能是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
10.在常温下100mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于
7,则对反应后溶液的叙述正确的是
A.V(混合液)≥200mL B.V(混合液)≤200mL
C.c(H+)= c(OH-)< c(K+)< c(A-) D.c(A-)= c(K+)
11.某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥NO、⑦NO2、⑧SO2,下列操作正确的是
A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
12.设NA表示阿伏加德罗常数,下列有关叙述不正确的是
A.1 mol OH—所含的电子数为10NA
B.含0.01mol FeCl3的饱和溶液制成的氢氧化铁胶体中所含胶粒数小于0.01NA
C.常温常压下,NA个氢分子的体积大于22.4L
D.0.1mol KO2与水反应生成氧气和氢氧化钾时,转移的电子数为0.1NA
13.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至沉淀刚好完全:
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B.氨气溶于醋酸溶液:NH3 + H+ = NH4+
C.澄清石灰水与少量小苏打溶液混合:
Ca2+ + OH—+ HCO3— = CaCO3↓ + H2O
D.将少量SO2气体通入NaClO溶液中:SO2 + H2O + ClO—=SO42— + Cl— + 2H+
14.某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是
①及时向上风口和地势较高处转移疏散人群;②及时戴上用浓烧碱溶液湿润过的口罩;③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;④及时戴上用稀纯碱溶液湿润过的口罩;⑤及时用毛巾包裹活性炭捂住口鼻;⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
15.曲酸是一种非常有潜力的食品添加剂,其结构简式如下图所示,试推测曲酸可能具有的性质为:
A.能发生酯化反应
B.可溶于水、醇
C.能发生水解反应
D.具有强酸性
16.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.a电极是负极
B.b电极的电极反应为:4OH— — 4e— = 2H2O + O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂
全部储藏在电池内的新型发电装置
17.在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是
A.最后得到的溶液中不含有Fe3+ B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+ D.残余固体一定全部是铜
18.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
姓名___________ 得分__________
第Ⅱ卷(非选择题 共76分)
三、(本题包括两小题,共22分)
19.(10分)试回答下列中学化学实验室中常见仪器的有关问题:
(1)在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平 中,标有“0”刻度的是(填序号,下同)__________________;标有使用温度的仪器是_________________________。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器 ①试管、②分液漏斗、③细口试剂瓶、④广口试剂瓶、⑤集气瓶、⑥滴瓶、⑦酸式滴定管、⑧碱式滴定管 中,用到“磨砂”的有______________________________。
(3)在仪器①漏斗、②容量瓶、③蒸馏烧瓶、④分液漏斗、⑤烧杯、⑥蒸发皿 中,可用于粗盐提纯实验的有 ;可用于分离两种沸点接近且互不相溶的液态混合物实验的有 。
20.(12分)某校研究性学习小组设计实验测定电石样品的纯度。
经查阅有关资料得知:H2S、PH3与硫酸铜溶液反应的化学方程式分别是
H2S+CuSO4==CuS↓+H2SO4 ;19PH3+56CuSO4+44H2O==11H3PO4+56H2SO4+32Cu↓+8Cu3P↓。
相关仪器和药品装置图如下:
A B C D E F G H
请你参与活动并就下列问题发表你的见解:
⑴按气体从左到右的流向选择合理的装置组合是(选填字母序号):
⑵经小组同学讨论认为乙炔的吸收装置选用F装置最佳。理由是:
⑶为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是 。
⑷若电石样品的质量为m1 g,F吸收乙炔前后的质量差为m2 g,则电石样品中CaC2质量分数ω(CaC2)= 。
四、(本题包括两小题,共18分)
21.(8分)混合物平均摩尔质量通常可表示为:,利用此概念可以讨论许多化学问题:
⑴相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度,理由是: ;
⑵在一定条件下的密闭容器中,存在如下平衡:C(s)+H2O(g)CO(g)+H2 (g);假如温度保持不变并加压,则(混合气)将 (填写“变大”、“变小”或“不变”);
⑶以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)= mol(用含a的代数式表示)。
22.(10分)江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
试填写下列空白:
⑴N的化学式为: ;
⑵写出反应①的化学方程式: ;
⑶由K溶液经如何处理才能制得N?
。
五、(本题包括2小题,共18分)
23.(8分)乙烯在不同的条件下可被氧化成不同的产物。如下图所示:
请回答下列问题:
(1)已知烯醇很不稳定,很快会发生异构化,形成稳定的羰基( )化合物,如:RCH=CH-OH→R-CH2-CHO。取1.24g A与过量的金属钠完全作用后,生成448mL(标准状况)气体,B、C都可由A脱水生成,C能发生银镜而B不能。
则A、B的结构简式分别为 、 。
写出C发生银镜反应的化学方程式 。
(2)D有多种同分异构体,其中有一种叫过氧乙酸,过氧乙酸具有很强的氧化性和腐蚀性,可作杀虫剂、杀菌剂。则过氧乙酸的结构简式为: 。
24.(10分)在有机分析中,常用臭氧化分解来确定有机物中碳碳双键的位置与数目。如:
(CH3)2C=CH-CH3 (CH3)2C=O+CH3CHO
已知某有机物A经臭氧化分解后发生下列一系列的变化:
试回答下列问题:
(1)有机物A、F的结构简式为A: 、F: 。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是 。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)写出下列变化的化学方程式。
①I水解生成E和H: ;
②F制取G: 。
六、(本题包括2小题,共18分)
25.(6分)某有机物A由C、H、O三种元素组成,其分子中有8个原子、46个质子,将其完全燃烧,在相同条件下测得产物CO2气体和水蒸气的体积比为2∶1。另取0.45 g有机物A恰好与10 mL 1 mol·L-1 NaHCO3溶液完全反应。求:
(1)有机物分子式; (2)有机物结构简式。
26.(12分)为测定镁铝合金的成分,取13.5g合金全部溶于500mL 3 mol·L—1的H2SO4中,充分反应后,再加入400mL 8 mol·L—的NaOH溶液,结果得到了白色沉淀。
⑴若只有一种沉淀,试确定合金中镁的质量分数范围。
⑵请写出沉淀质量与合金中铝的质量{m(Al)}的关系式{用含m(Al)的函数关系式表达},并求沉淀质量的范围。
高三化学综合练习(2)
参考答案
第Ⅰ卷
题号
1
2
3
4
5
6
7
8
答案
B
C
C
B
A
D
A
D
题号
9
10
11
12
13
14
15
16
17
18
答案
BC
BD
A
D
CD
C
AB
B
AB
BC
第Ⅱ卷
19.(各小题全对得2分、漏写得1分、不写或错写得0分)
⑴⑤⑧ ⑤⑥⑦ ⑵②③④⑤⑥⑦ ⑶①⑤⑥ ④⑤
20.⑴A、B、D、E、F(3分,整体给分); ⑵饱和食盐水(2分)。
⑶由于溴在四氯化碳中溶解度较大,溴不易挥发,吸收乙炔的效果较好,所以选择F(2分);而排水法测定精度不高,故不选择H(1分);溴水具有较强的发挥性,同样测定精度不高,故也不选择G。
⑷32m2/13m1或64m2/26m1或2.46m2/m1(3分)。
21.⑴<(1分);因为(空气)=29g/mol,M(水)=18g/mol,则(总)必小于29g/mol(2分);
⑵变大(2分);⑶3a/442 mol(3分)。
22.⑴Mg(2分); ⑵NaCl(饱和)+NH3+CO2+H2O==NaHCO3↓+NH4Cl(4分);
⑶MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁(4分)。
23.(1)A: (2分) B: (2分)
CH3CHO + 2[Ag(NH3)2]OHCH3COONH4 + 2Ag↓+ 3NH3 +H2O(2分)
(2)CH3COOOH(2分)
24.(1)A: (2分)F: (2分)
(2)B(2分)
(3)①
(2分)
②
(2分)
25.(6分)解: 设有机物分子式CxHyOz
因为V(CO2)/V(H2O)=2/1 所以n(C)/n(H)=1/1 (1分)
根据题意 所以:分子式C2H2O4 (2分)
(1分)
所以:有机物分子中含有两个羧基,有机物为二元羧酸,结构简式 (2分)
26.(12分)(1)n(Na+)=8 mol·L—1×0.4L=3.2 mol
n(SO)=3 mol·L—1×0.5L=1.5 mol (1分)
若沉淀只有Mg(OH)2时,则溶液中只有Na+、AlO、SO,且为电中性。
则n(Na+)= 2n(SO)+n(AlO) (2分)
n(Al)=n(AlO)=0.2 mol
m(Al)=0.2 g×27 g·mol-1=5.4 g
m(Mg)=13.5 g-5.4 g=8.1 g (1分)
则60%≤ω(Mg)<100% (2分)
(5分)(2)当m(Al)≤5.4g时,m(沉)= 58[13.5-m(Al)] /24 (2分)
当5.4g<m(Al)<13.5g,m(沉)= 78 [m(Al)-5.4] /27 + 58[(13.5-m(Al))]/24 (2分)
19.575≤m(沉)<32.625 (2分)
同课章节目录
