陕西 高考模拟试题很不错的[下学期]
图片预览

文档简介
延长县中学高三年级模拟试卷 2007-5-4
命题人:lg 学号________. 姓名________.
第Ⅰ卷(选择题)
一.选择题 (请将你认为正确的答案代号填在Ⅱ卷的答题栏中,本题共16小题)
1. 在某100 mL混合液中,HNO3的物质的量浓度为0.4 mol/L,H2SO4的物质的量浓度为0.2 mol/L,向其中加入7.56 g 铜粉,微热,待充分反应后,溶液中Cu2+的物质的量浓度约为
A.0.15 mol/L B.0.3 mol/L C.0.225 mol/L D.无法计算
2. 下列叙述中正确的是
A.葡萄糖在人体内氧化分解是放热反应
B.酸碱中和反应是吸热反应
C.木柴燃烧需要用火柴点燃,所以木柴燃烧是吸热反应
D.苛性钠溶于水是放热反应
3. 脑白金,其有效成分的结构简式如图。下列对该化合物的叙述正确的是
(1)它属于芳香烃
(2)它属于高分子化合物
(3)分子式C13N2H16O2
(4)在一定条件下可以发生加成反应
A(1)(2) B(3)(4) C(1)(3) D(2)(4)
4. 红色信号弹的主要成分为KClO3、Sr(NO3)2、Mg粉、聚氯乙烯组成,而红色发光剂的主要成分为Sr(NO3)2、Mg粉、Al粉。由此可判断产生红焰色的元素是
A. Mg B. Sr C. K D. Cl
5. 纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某二硼化镁纳米颗粒的大小和形状恰好与二硼化镁晶胞的大小和形状相同(如下图所示),则这种纳米颗粒的表面微粒数占总微粒数的百分数为
A.22% B.33.3%
C.66.7% D.70%
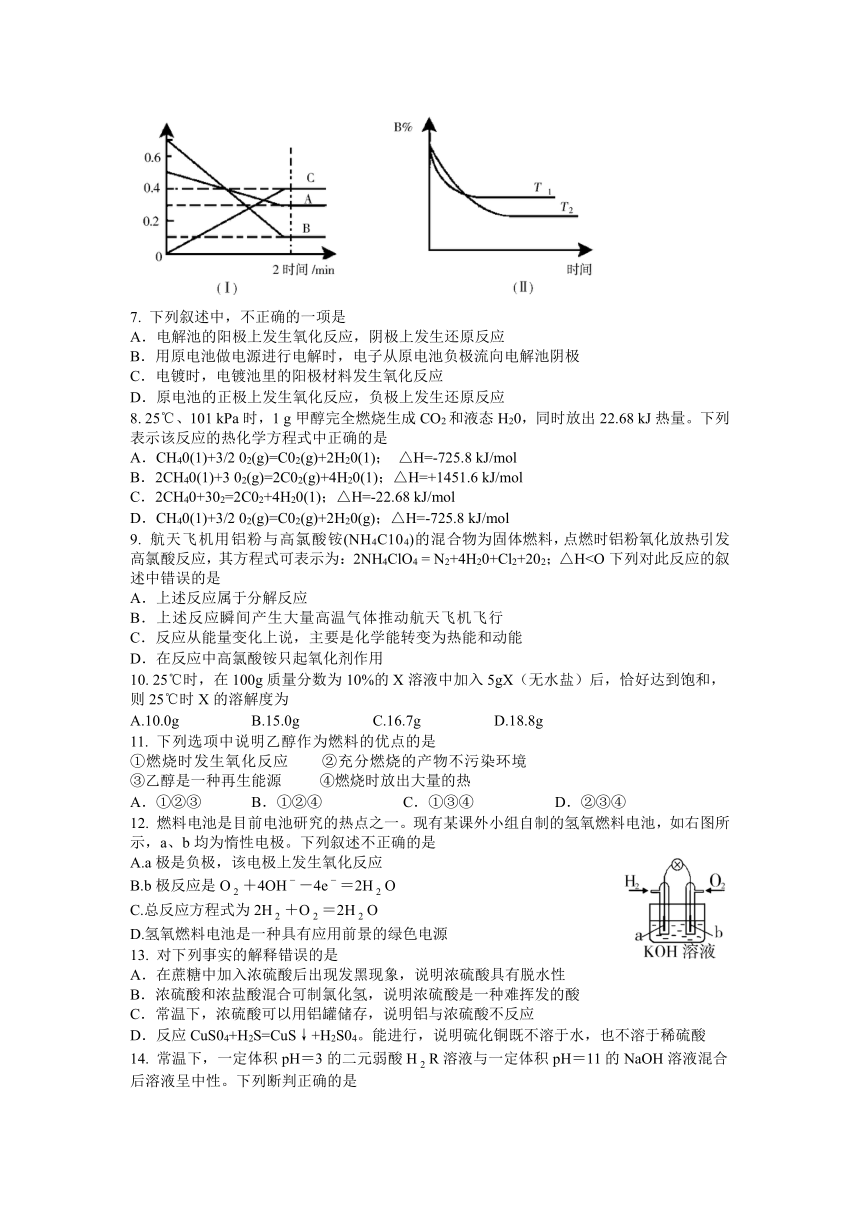
6. T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B和C物质的量变化与时间关系如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T和T时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是
A.2min内A的化学反应速率为0.1mol/L
B.在反应达到平衡时,保持其它条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达到平衡时,保持其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.在T℃时,若A的浓度减少了1mol/L,则B的浓度会减少3mol/L,C的浓度会增加2mol/L
7. 下列叙述中,不正确的一项是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.原电池的正极上发生氧化反应,负极上发生还原反应
8. 25℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H20,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是
A.CH40(1)+3/2 02(g)=C02(g)+2H20(1); △H=-725.8 kJ/mol
B.2CH40(1)+3 02(g)=2C02(g)+4H20(1);△H=+1451.6 kJ/mol
C.2CH40+302=2C02+4H20(1);△H=-22.68 kJ/mol
D.CH40(1)+3/2 02(g)=C02(g)+2H20(g);△H=-725.8 kJ/mol
9. 航天飞机用铝粉与高氯酸铵(NH4C104)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸反应,其方程式可表示为:2NH4ClO4 = N2+4H20+Cl2+202;△HA.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
10. 25℃时,在100g质量分数为10%的X溶液中加入5gX(无水盐)后,恰好达到饱和,则25℃时X的溶解度为
A.10.0g B.15.0g C.16.7g D.18.8g
11. 下列选项中说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③ B.①②④ C.①③④ D.②③④
12. 燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如右图所示,a、b均为惰性电极。下列叙述不正确的是
A.a极是负极,该电极上发生氧化反应
B.b极反应是O+4OH-4e=2HO
C.总反应方程式为2H+O=2HO
D.氢氧燃料电池是一种具有应用前景的绿色电源
13. 对下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应
D.反应CuS04+H2S=CuS↓+H2S04。能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
14. 常温下,一定体积pH=3的二元弱酸HR溶液与一定体积pH=11的NaOH溶液混合后溶液呈中性。下列断判正确的是
A.溶液中c(Na)=10mol/L
B.溶液中c(R)>c(Na)>c(H)>c(OH)
C.溶液中c(R)+c(OH)+c(HR)=c(Na)+c(H)
D.溶液中2c(R)+c(HR)=c(Na)
15. 有关晶体的叙述中正确的是
A.在Si02晶体中,由Si、O构成的最小单元环每个平均占有8个原子
B.在12 g金刚石中,含C—C共价键键数为4NA
C.在含阳离子的化合物晶体中一定含阴离子
D.金属晶体是由金属原子直接构成的
16. 下列各组物质中,按熔点由低到高排列正确的是
A.02、I2、Hg B.C02、KCl、Si02 C.Na、K、Rb D.SiC、NaCl、S02
第Ⅱ卷(非选择题 共4道简答题1道实验题1道计算题
请将你认为正确的答案代号填在下表中
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
二.简答题 (共4小题)
17. 舞台上的幕布与布景多是用浓氯化铵溶液浸泡过而制成,可以防火,其原因是
__________________________________________.
18. 用石墨作电极电解:①稀H2SO4、②K2SO4溶液、③CuCl2溶液、④CuSO4溶液、⑤KOH溶液。
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2:1的是(填序号,下同)_________________________________,其阳极的电极反应式都是______________________ ,阴极的电极反应式都是______________________ ,总反应的化学方程式都是____________________________________________ 。
(2)阴极、阳极都有气体产生,其中溶液pH变小的是___________ ,pH变大的是___________。
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是___________,其总反应的化学方程式是_________________________________ 。
19. 两份铜的试样分别与浓硫酸,稀硝酸反应:
(1)若消耗硫酸和硝酸物质的量相同,则两份铜的试样的质量比是___________
(2)若产生气体的体积相同(均在标准状况下测定)则两份铜的试样质量比___________
20. 将木屑与浓硝酸共热产生的气体等分为①②两份,①份先倒入蒸馏水再倒入石灰水中②份直接导入石灰水中。则①份石灰水___________;②份石灰水___________
三.实验题 (共1小题)
21. 制备无水乙醇的实验
原理:由于乙醇95.6%、水4.4%组成一种混合物,常压下,它有一定的沸点(78.17℃),这个沸点低于水的(100℃)也低于纯乙醇的沸点(78.3℃),所以只靠简单蒸馏酒精,所得乙醇纯度最高只能达到95.6%尚含有4.4%的水.如果要得到含量较高的乙醇,在实验室中常用的简便方法是加人生石灰回流(回流是在一个可以加热的反应容器中,把液体加热使受热转化生成的蒸气通过冷凝器冷凝又回流到原容器的操作.见图甲),回流之后再蒸馏,可得99.5%的乙醇,通常称为无水乙醇.如果要得到纯度更高的绝对乙醇(含乙醇99.95%),则还要用金属钠进行处理,借以除去最后微量的水份。
实验步骤::取干燥的250mL圆底烧瓶一只,加入95%乙醇100mL和小块生石灰30g,振摇后用橡皮塞塞紧,放置过夜。在烧瓶口装上回流冷凝管,管口接一支氯化钙干燥管(装置见图甲),在水浴上加热回流1至2小时,稍冷,取下冷凝管,改装成蒸馏装置(如图乙),再放在热水浴中蒸馏,把最初蒸出的5mL馏出液另外回收,然后用烘干的吸滤瓶作为接受器,其侧管接一支氯化钙干燥管,使其与大气相通,蒸至无液滴出来为止,量取所得乙醇的体积,计算回收率。请回答;
(1)为什么回收或蒸馏时都要装上氯化钙干燥管?
(2)为了防止回流系统外部湿气侵入,有人用塞子把冷凝管上端塞紧,这样做为什么不行?
(3)无水氯化钙常用作吸水剂,如用无水氯化钙代替氧化钙投入酒精中,放置过夜,然后不经过滤,进行本实验制取乙醇是否可行,为什么?
(4)一般用干燥剂干燥有机物时,在蒸馏前应先过滤,但用氯化钙制备无水乙醇时,为什么可不过滤,留在瓶中一起蒸馏?
(5)为什么最初蒸出的5mL馏出液另外收集,它的纯度是否已达99.5%?
四.计算题 (共1小题)
22. 某硫酸厂用接触法制硫酸的生产过程中,在煅烧黄铁矿时损失硫为5%(质量分数);在S02的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失S03为O.6%(质量分数)。现有含FeS2是95%的黄铁矿(杂质不含硫元素)lOOt,问可制得98%的浓硫酸多少吨?
延长县中学高三年级模拟试卷
参考答案(仅供参考)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B
A
B
B
D
D
D
A
D
C
D
B
C
D
C
16
B
二.简答题答案:
17. 着火时NH4Cl=NH3↑+HCl↑,反应需要吸收热量,生成的气体不能燃烧,也不能支持燃烧,因而使布与空气隔绝,起到防火作用。
18. (1)①②⑤ 4OH--4e-=2H2O+O2↑
4H++4e-=2H2↑(或2H++2e-= H2↑) 2H2O 2H2↑+O2↑
(2)① ⑤
(3)④ 2CuSO4+2H2O 2Cu+2H2SO4+O2↑ (最后一空2分,其他每空1分)
19. (1) 4:3 (2) 2:3
20. 变浑浊 无变化
三.实验题答案:
21. (1)本实验要求无水操作,要求严密防止大气中的湿气进入本体系。
(2)不可行。如果塞紧,回流系统就成了封闭系统。封闭系统受热后,将会发生过热、冲料、爆炸、着火(酒精可燃)等意外事故。
(3)氯化钙可以用作吸水剂,但它受热后又可使结合的水再释出,达不到干燥的目的,又氯化钙也可以吸附乙醇。
(4)氧化钙跟水发生反应生成的氢氧化钙是不挥发的,受热也不分解,所以不影响蒸馏纯乙醇。
(5)冷凝管内管管壁等仪器的表面,,尚附有湿气,因此最初的几毫升蒸馏液可能含有的水份相对多一些,纯度达不到99.5%,所以另外收集,以免影响所收集乙醇的纯度
四.计算题答案:
22. 设:可制得98%的浓硫酸x吨
FeS2------------------------------------2H2SO4
120 2×98%
100×95%×(1-0.6%)×92%×95% x·98%
x=137.55
命题人:lg 学号________. 姓名________.
第Ⅰ卷(选择题)
一.选择题 (请将你认为正确的答案代号填在Ⅱ卷的答题栏中,本题共16小题)
1. 在某100 mL混合液中,HNO3的物质的量浓度为0.4 mol/L,H2SO4的物质的量浓度为0.2 mol/L,向其中加入7.56 g 铜粉,微热,待充分反应后,溶液中Cu2+的物质的量浓度约为
A.0.15 mol/L B.0.3 mol/L C.0.225 mol/L D.无法计算
2. 下列叙述中正确的是
A.葡萄糖在人体内氧化分解是放热反应
B.酸碱中和反应是吸热反应
C.木柴燃烧需要用火柴点燃,所以木柴燃烧是吸热反应
D.苛性钠溶于水是放热反应
3. 脑白金,其有效成分的结构简式如图。下列对该化合物的叙述正确的是
(1)它属于芳香烃
(2)它属于高分子化合物
(3)分子式C13N2H16O2
(4)在一定条件下可以发生加成反应
A(1)(2) B(3)(4) C(1)(3) D(2)(4)
4. 红色信号弹的主要成分为KClO3、Sr(NO3)2、Mg粉、聚氯乙烯组成,而红色发光剂的主要成分为Sr(NO3)2、Mg粉、Al粉。由此可判断产生红焰色的元素是
A. Mg B. Sr C. K D. Cl
5. 纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某二硼化镁纳米颗粒的大小和形状恰好与二硼化镁晶胞的大小和形状相同(如下图所示),则这种纳米颗粒的表面微粒数占总微粒数的百分数为
A.22% B.33.3%
C.66.7% D.70%
6. T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B和C物质的量变化与时间关系如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T和T时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是
A.2min内A的化学反应速率为0.1mol/L
B.在反应达到平衡时,保持其它条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达到平衡时,保持其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.在T℃时,若A的浓度减少了1mol/L,则B的浓度会减少3mol/L,C的浓度会增加2mol/L
7. 下列叙述中,不正确的一项是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.原电池的正极上发生氧化反应,负极上发生还原反应
8. 25℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H20,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是
A.CH40(1)+3/2 02(g)=C02(g)+2H20(1); △H=-725.8 kJ/mol
B.2CH40(1)+3 02(g)=2C02(g)+4H20(1);△H=+1451.6 kJ/mol
C.2CH40+302=2C02+4H20(1);△H=-22.68 kJ/mol
D.CH40(1)+3/2 02(g)=C02(g)+2H20(g);△H=-725.8 kJ/mol
9. 航天飞机用铝粉与高氯酸铵(NH4C104)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸反应,其方程式可表示为:2NH4ClO4 = N2+4H20+Cl2+202;△H
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
10. 25℃时,在100g质量分数为10%的X溶液中加入5gX(无水盐)后,恰好达到饱和,则25℃时X的溶解度为
A.10.0g B.15.0g C.16.7g D.18.8g
11. 下列选项中说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③ B.①②④ C.①③④ D.②③④
12. 燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如右图所示,a、b均为惰性电极。下列叙述不正确的是
A.a极是负极,该电极上发生氧化反应
B.b极反应是O+4OH-4e=2HO
C.总反应方程式为2H+O=2HO
D.氢氧燃料电池是一种具有应用前景的绿色电源
13. 对下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应
D.反应CuS04+H2S=CuS↓+H2S04。能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
14. 常温下,一定体积pH=3的二元弱酸HR溶液与一定体积pH=11的NaOH溶液混合后溶液呈中性。下列断判正确的是
A.溶液中c(Na)=10mol/L
B.溶液中c(R)>c(Na)>c(H)>c(OH)
C.溶液中c(R)+c(OH)+c(HR)=c(Na)+c(H)
D.溶液中2c(R)+c(HR)=c(Na)
15. 有关晶体的叙述中正确的是
A.在Si02晶体中,由Si、O构成的最小单元环每个平均占有8个原子
B.在12 g金刚石中,含C—C共价键键数为4NA
C.在含阳离子的化合物晶体中一定含阴离子
D.金属晶体是由金属原子直接构成的
16. 下列各组物质中,按熔点由低到高排列正确的是
A.02、I2、Hg B.C02、KCl、Si02 C.Na、K、Rb D.SiC、NaCl、S02
第Ⅱ卷(非选择题 共4道简答题1道实验题1道计算题
请将你认为正确的答案代号填在下表中
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
二.简答题 (共4小题)
17. 舞台上的幕布与布景多是用浓氯化铵溶液浸泡过而制成,可以防火,其原因是
__________________________________________.
18. 用石墨作电极电解:①稀H2SO4、②K2SO4溶液、③CuCl2溶液、④CuSO4溶液、⑤KOH溶液。
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2:1的是(填序号,下同)_________________________________,其阳极的电极反应式都是______________________ ,阴极的电极反应式都是______________________ ,总反应的化学方程式都是____________________________________________ 。
(2)阴极、阳极都有气体产生,其中溶液pH变小的是___________ ,pH变大的是___________。
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是___________,其总反应的化学方程式是_________________________________ 。
19. 两份铜的试样分别与浓硫酸,稀硝酸反应:
(1)若消耗硫酸和硝酸物质的量相同,则两份铜的试样的质量比是___________
(2)若产生气体的体积相同(均在标准状况下测定)则两份铜的试样质量比___________
20. 将木屑与浓硝酸共热产生的气体等分为①②两份,①份先倒入蒸馏水再倒入石灰水中②份直接导入石灰水中。则①份石灰水___________;②份石灰水___________
三.实验题 (共1小题)
21. 制备无水乙醇的实验
原理:由于乙醇95.6%、水4.4%组成一种混合物,常压下,它有一定的沸点(78.17℃),这个沸点低于水的(100℃)也低于纯乙醇的沸点(78.3℃),所以只靠简单蒸馏酒精,所得乙醇纯度最高只能达到95.6%尚含有4.4%的水.如果要得到含量较高的乙醇,在实验室中常用的简便方法是加人生石灰回流(回流是在一个可以加热的反应容器中,把液体加热使受热转化生成的蒸气通过冷凝器冷凝又回流到原容器的操作.见图甲),回流之后再蒸馏,可得99.5%的乙醇,通常称为无水乙醇.如果要得到纯度更高的绝对乙醇(含乙醇99.95%),则还要用金属钠进行处理,借以除去最后微量的水份。
实验步骤::取干燥的250mL圆底烧瓶一只,加入95%乙醇100mL和小块生石灰30g,振摇后用橡皮塞塞紧,放置过夜。在烧瓶口装上回流冷凝管,管口接一支氯化钙干燥管(装置见图甲),在水浴上加热回流1至2小时,稍冷,取下冷凝管,改装成蒸馏装置(如图乙),再放在热水浴中蒸馏,把最初蒸出的5mL馏出液另外回收,然后用烘干的吸滤瓶作为接受器,其侧管接一支氯化钙干燥管,使其与大气相通,蒸至无液滴出来为止,量取所得乙醇的体积,计算回收率。请回答;
(1)为什么回收或蒸馏时都要装上氯化钙干燥管?
(2)为了防止回流系统外部湿气侵入,有人用塞子把冷凝管上端塞紧,这样做为什么不行?
(3)无水氯化钙常用作吸水剂,如用无水氯化钙代替氧化钙投入酒精中,放置过夜,然后不经过滤,进行本实验制取乙醇是否可行,为什么?
(4)一般用干燥剂干燥有机物时,在蒸馏前应先过滤,但用氯化钙制备无水乙醇时,为什么可不过滤,留在瓶中一起蒸馏?
(5)为什么最初蒸出的5mL馏出液另外收集,它的纯度是否已达99.5%?
四.计算题 (共1小题)
22. 某硫酸厂用接触法制硫酸的生产过程中,在煅烧黄铁矿时损失硫为5%(质量分数);在S02的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失S03为O.6%(质量分数)。现有含FeS2是95%的黄铁矿(杂质不含硫元素)lOOt,问可制得98%的浓硫酸多少吨?
延长县中学高三年级模拟试卷
参考答案(仅供参考)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B
A
B
B
D
D
D
A
D
C
D
B
C
D
C
16
B
二.简答题答案:
17. 着火时NH4Cl=NH3↑+HCl↑,反应需要吸收热量,生成的气体不能燃烧,也不能支持燃烧,因而使布与空气隔绝,起到防火作用。
18. (1)①②⑤ 4OH--4e-=2H2O+O2↑
4H++4e-=2H2↑(或2H++2e-= H2↑) 2H2O 2H2↑+O2↑
(2)① ⑤
(3)④ 2CuSO4+2H2O 2Cu+2H2SO4+O2↑ (最后一空2分,其他每空1分)
19. (1) 4:3 (2) 2:3
20. 变浑浊 无变化
三.实验题答案:
21. (1)本实验要求无水操作,要求严密防止大气中的湿气进入本体系。
(2)不可行。如果塞紧,回流系统就成了封闭系统。封闭系统受热后,将会发生过热、冲料、爆炸、着火(酒精可燃)等意外事故。
(3)氯化钙可以用作吸水剂,但它受热后又可使结合的水再释出,达不到干燥的目的,又氯化钙也可以吸附乙醇。
(4)氧化钙跟水发生反应生成的氢氧化钙是不挥发的,受热也不分解,所以不影响蒸馏纯乙醇。
(5)冷凝管内管管壁等仪器的表面,,尚附有湿气,因此最初的几毫升蒸馏液可能含有的水份相对多一些,纯度达不到99.5%,所以另外收集,以免影响所收集乙醇的纯度
四.计算题答案:
22. 设:可制得98%的浓硫酸x吨
FeS2------------------------------------2H2SO4
120 2×98%
100×95%×(1-0.6%)×92%×95% x·98%
x=137.55
同课章节目录
