高三8+4模拟[下学期]
图片预览

文档简介
8+4模拟一
6.引起下列环境污染的原因不正确的是( )
A.重金属、农药和难分解有机物等会造成水体污染
B.SO2、NO2或CO2都会导致酸雨的形成
C.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
7.下列指定微粒数目不是1 : 1的是 ( )
A.Na2O2晶体中的阳离子和阴离子 B.NaHCO3晶体中的阳离子和阴离子
C.Mg2+离子中的质子和中子 D.醋酸钠溶液中的阳离子总数与阴离子总数
8.下列各组物质中各有两种组分,两种组分各取1 mol,在足量氧气中燃烧,两者耗氧量不相同的是 ( )
A.乙烯和乙醇 B.乙炔和乙醛
C.乙烷和乙酸甲酯 D.乙醇和乙酸
9.将0.1mol/L的醋酸溶液加水稀释,下列说法正确的是 ( )
A.溶液中c(H+)和c(OH—)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
10.要提纯下列物质(括号内物质为杂质),实验操作最合理的是 ( )
A.CO2(SO2):通入盛有饱和NaHCO3溶液的洗气瓶
B.溴苯(Br2):加入KI溶液,充分反应后,弃去水溶液
C.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离
D.乙酸乙酯(苯酚):加入NaOH溶液,振荡、静置分层后,除去水层
11.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:
P+CuSO4+H2O=Cu3P+H3PO4+H2SO4
下列关于该反应的说法正确的是 ( )
A.CuSO4发生了氧化反应
B.生成1mol H3PO4时,有10mol电子转移
C.氧化产物和还原产物的物质的量之比为6 : 5
D.白磷只作还原剂
12.某蓄电池充放电的反应如下:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列推断中正确的是 ( )
A.放电时铁为正极:NiO2为负极
B.充电时阴极的电极反应式为:Fe(OH)2+2e—=Fe+2OH—
C.充电时,铁为阳极
D.放电时,正极附近溶液的碱性减弱
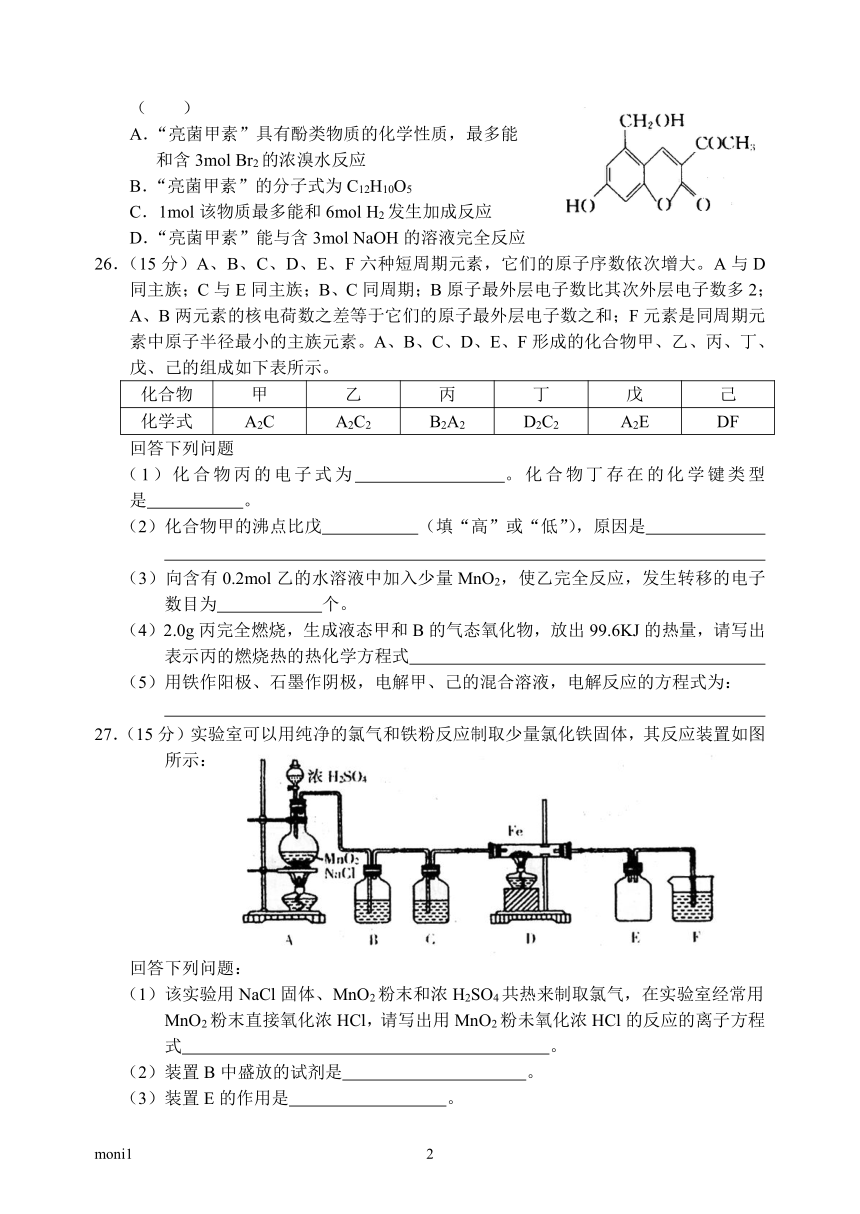
13.由于假药“亮菌甲素”注射液导致多名患者肾功能衰竭,药品安全问题已引起人们的关注。“亮菌甲素”的结构简式如图所示,它是黄色或橙黄色结晶粉末,几乎不溶于水,可用辅料丙二醇(C3H8O2)溶成注射剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。下列叙述不正确的是( )
A.“亮菌甲素”具有酚类物质的化学性质,最多能
和含3mol Br2的浓溴水反应
B.“亮菌甲素”的分子式为C12H10O5
C.1mol该物质最多能和6mol H2发生加成反应
D.“亮菌甲素”能与含3mol NaOH的溶液完全反应
26.(15分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
化合物
甲
乙
丙
丁
戊
己
化学式
A2C
A2C2
B2A2
D2C2
A2E
DF
回答下列问题
(1)化合物丙的电子式为 。化合物丁存在的化学键类型是 。
(2)化合物甲的沸点比戊 (填“高”或“低”),原因是
(3)向含有0.2mol乙的水溶液中加入少量MnO2 ,使乙完全反应,发生转移的电子数目为 个。
(4)2.0g丙完全燃烧,生成液态甲和B的气态氧化物,放出99.6KJ的热量,请写出表示丙的燃烧热的热化学方程式
(5)用铁作阳极、石墨作阴极,电解甲、己的混合溶液,电解反应的方程式为:
27.(15分)实验室可以用纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置如图所示:
回答下列问题:
(1)该实验用NaCl固体、MnO2粉末和浓H2SO4共热来制取氯气,在实验室经常用MnO2粉末直接氧化浓HCl,请写出用MnO2粉未氧化浓HCl的反应的离子方程式 。
(2)装置B中盛放的试剂是 。
(3)装置E的作用是 。
(4)如果没有装置C,水蒸气将混入D中,铁粉与水蒸气在高温下也可反应,写出该反应的方程式
(5)装置F中反应的离子方程式是 。
(6)氯化铁固体易潮解。为防止氯化铁发生水解反应,在上述示意图中 和
之间应再接入装置 (填写A—F字母)
28.(18分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化
合物D(分子式为C3H6O3)如下图所示。
请回答下列问题:
(1)写出下列物质的结构简式:
A: ;B: ;C: ;D: 。
(2)指出反应②的反应类型 。
(3)写出反应③的化学方程式 。
(4)反应④的目的是 。
(5)化合物D′是D的同一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D′在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出下列反应的化学方程式:D′→F:
D的银镜反应:
29.(12分)某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量小于150,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
(1)A的分子式是 。
(2)若A能与NaHCO3溶液反应放出CO2气体,其结构可能有 种。
(3)若A与NaOH溶液在加热时才能较快反应,且1molA消耗1mol NaOH,则A的所有可能的结构简式是 。
(4)若A与NaOH溶液在加热时才能较快反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有 种,不能发生镜镜反应的物质的结构简式是
。
8+4一参考答案
B A D D A C B C
26.(15分)
(1)丙的电子式H:C C: H(2分) 离子键、非极性共价键(2分)
(2)高(1分) 水分子间存在氢键而H2S分子中不存在氢键(2分)
(3)0.2·NA或1.204×1023(2分)
(4)C2H2(g)+O2(g)→H2O(l)+2CO2(g);△H=-1294.8kJ·mol—1(3分)
(5)Fe+2H2O H2↑+Fe(OH)2↓(3分)
27.(15分)(1)MnO2+2Ci+4H+ Mn2++Cl2↑+2H2O(3分)
(2)饱和食盐水 (2分)
(3)安全瓶,防止倒吸(2分)
(4)3Fe+4H2O Fe3O4+4H2 (3分)
(5)2OH—+Cl2=Cl—+ClO—+H2O(2分)
(6)D E C(3分)
28.(18分)
(1)A:CH2=CH2(2分)
B:CH3CH2CHO(2分)
C:CH2=CHCHO(2分)
D:CH2OHCH2OHCHO(2分)
(2)取代(1分)
(3)CH3CHBrCHO+NaOH CH2=CHCHO+NaBr+H2O(2分)
(4)保护醛基,防止反应⑤时被高猛酸钾碱性溶液氧化(1分)
(5)
6.引起下列环境污染的原因不正确的是( )
A.重金属、农药和难分解有机物等会造成水体污染
B.SO2、NO2或CO2都会导致酸雨的形成
C.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
7.下列指定微粒数目不是1 : 1的是 ( )
A.Na2O2晶体中的阳离子和阴离子 B.NaHCO3晶体中的阳离子和阴离子
C.Mg2+离子中的质子和中子 D.醋酸钠溶液中的阳离子总数与阴离子总数
8.下列各组物质中各有两种组分,两种组分各取1 mol,在足量氧气中燃烧,两者耗氧量不相同的是 ( )
A.乙烯和乙醇 B.乙炔和乙醛
C.乙烷和乙酸甲酯 D.乙醇和乙酸
9.将0.1mol/L的醋酸溶液加水稀释,下列说法正确的是 ( )
A.溶液中c(H+)和c(OH—)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
10.要提纯下列物质(括号内物质为杂质),实验操作最合理的是 ( )
A.CO2(SO2):通入盛有饱和NaHCO3溶液的洗气瓶
B.溴苯(Br2):加入KI溶液,充分反应后,弃去水溶液
C.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离
D.乙酸乙酯(苯酚):加入NaOH溶液,振荡、静置分层后,除去水层
11.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:
P+CuSO4+H2O=Cu3P+H3PO4+H2SO4
下列关于该反应的说法正确的是 ( )
A.CuSO4发生了氧化反应
B.生成1mol H3PO4时,有10mol电子转移
C.氧化产物和还原产物的物质的量之比为6 : 5
D.白磷只作还原剂
12.某蓄电池充放电的反应如下:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列推断中正确的是 ( )
A.放电时铁为正极:NiO2为负极
B.充电时阴极的电极反应式为:Fe(OH)2+2e—=Fe+2OH—
C.充电时,铁为阳极
D.放电时,正极附近溶液的碱性减弱
13.由于假药“亮菌甲素”注射液导致多名患者肾功能衰竭,药品安全问题已引起人们的关注。“亮菌甲素”的结构简式如图所示,它是黄色或橙黄色结晶粉末,几乎不溶于水,可用辅料丙二醇(C3H8O2)溶成注射剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。下列叙述不正确的是( )
A.“亮菌甲素”具有酚类物质的化学性质,最多能
和含3mol Br2的浓溴水反应
B.“亮菌甲素”的分子式为C12H10O5
C.1mol该物质最多能和6mol H2发生加成反应
D.“亮菌甲素”能与含3mol NaOH的溶液完全反应
26.(15分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
化合物
甲
乙
丙
丁
戊
己
化学式
A2C
A2C2
B2A2
D2C2
A2E
DF
回答下列问题
(1)化合物丙的电子式为 。化合物丁存在的化学键类型是 。
(2)化合物甲的沸点比戊 (填“高”或“低”),原因是
(3)向含有0.2mol乙的水溶液中加入少量MnO2 ,使乙完全反应,发生转移的电子数目为 个。
(4)2.0g丙完全燃烧,生成液态甲和B的气态氧化物,放出99.6KJ的热量,请写出表示丙的燃烧热的热化学方程式
(5)用铁作阳极、石墨作阴极,电解甲、己的混合溶液,电解反应的方程式为:
27.(15分)实验室可以用纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置如图所示:
回答下列问题:
(1)该实验用NaCl固体、MnO2粉末和浓H2SO4共热来制取氯气,在实验室经常用MnO2粉末直接氧化浓HCl,请写出用MnO2粉未氧化浓HCl的反应的离子方程式 。
(2)装置B中盛放的试剂是 。
(3)装置E的作用是 。
(4)如果没有装置C,水蒸气将混入D中,铁粉与水蒸气在高温下也可反应,写出该反应的方程式
(5)装置F中反应的离子方程式是 。
(6)氯化铁固体易潮解。为防止氯化铁发生水解反应,在上述示意图中 和
之间应再接入装置 (填写A—F字母)
28.(18分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化
合物D(分子式为C3H6O3)如下图所示。
请回答下列问题:
(1)写出下列物质的结构简式:
A: ;B: ;C: ;D: 。
(2)指出反应②的反应类型 。
(3)写出反应③的化学方程式 。
(4)反应④的目的是 。
(5)化合物D′是D的同一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D′在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出下列反应的化学方程式:D′→F:
D的银镜反应:
29.(12分)某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量小于150,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
(1)A的分子式是 。
(2)若A能与NaHCO3溶液反应放出CO2气体,其结构可能有 种。
(3)若A与NaOH溶液在加热时才能较快反应,且1molA消耗1mol NaOH,则A的所有可能的结构简式是 。
(4)若A与NaOH溶液在加热时才能较快反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有 种,不能发生镜镜反应的物质的结构简式是
。
8+4一参考答案
B A D D A C B C
26.(15分)
(1)丙的电子式H:C C: H(2分) 离子键、非极性共价键(2分)
(2)高(1分) 水分子间存在氢键而H2S分子中不存在氢键(2分)
(3)0.2·NA或1.204×1023(2分)
(4)C2H2(g)+O2(g)→H2O(l)+2CO2(g);△H=-1294.8kJ·mol—1(3分)
(5)Fe+2H2O H2↑+Fe(OH)2↓(3分)
27.(15分)(1)MnO2+2Ci+4H+ Mn2++Cl2↑+2H2O(3分)
(2)饱和食盐水 (2分)
(3)安全瓶,防止倒吸(2分)
(4)3Fe+4H2O Fe3O4+4H2 (3分)
(5)2OH—+Cl2=Cl—+ClO—+H2O(2分)
(6)D E C(3分)
28.(18分)
(1)A:CH2=CH2(2分)
B:CH3CH2CHO(2分)
C:CH2=CHCHO(2分)
D:CH2OHCH2OHCHO(2分)
(2)取代(1分)
(3)CH3CHBrCHO+NaOH CH2=CHCHO+NaBr+H2O(2分)
(4)保护醛基,防止反应⑤时被高猛酸钾碱性溶液氧化(1分)
(5)
同课章节目录
