理综高三化学模拟(二)[下学期]
图片预览

文档简介
理综高三化学模拟(二)
6、下列说法正确的是( )
A乙醇和汽油都是可再生的能源,应大力推广“乙醇汽油”
B、钢铁在海水中比在河水中更易腐蚀,主要原因是海水中含氧量高于河水。
C、废弃的塑料、金属、纸制品及玻璃都是可回收利用的资源。
D、凡含有食品添加剂的食物对人体健康均有害,不宜食用。
7、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
A 2Na218O2+2H2O==4Na18OH+O2
B 2KMnO4+5H218O+3H2SO4==K2SO4+2MnSO4+518O2↑+8H2O
C NH4CI+2H2O==NH4·2H2O+HCI
D K37CIO3+6HCI==K37CI+3CI+3H2O
8、下列八组离子:a: I- 、CIO- 、 NO3- 、H+。 b:K+ 、NH4+、 HCO3- 、 OH- 。 c:SO32-、 SO42-、 Na+、 OH- d: Fe2+、 Cu2+ 、SO42- 、CI- e :H+、 K+ 、AIO2-、 HSO3-、 f:Ca2+、 Na+ 、SO42- 、CO32-。 g: CIO- 、S2- 、H+、 K+ h: MnO4- 、SO32-、 K+、 Na2+;
能形成无色透明溶液,且能大量共存的是( )
A 1组 B 3组, C 5组, D 8组。
9、已知乙炔和乙烯燃烧的热化学方程式为 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l);△H=-2600kj/mol,
C2H4(g)+3O2(g)→2CO2(g)+2H2O(l);△H=-1411kj/mol,又已知,氧炔焰的温度高于乙烯的火焰的温度。据此,下列叙述错误的是( )
A 每摩尔烃完全燃烧时,放热多,火焰温度也高。
B 烃完全燃烧时,火焰温度的高低不仅仅决定于燃烧的反应热的大小。
C 相同条件下,等体积乙炔和乙烯完全燃烧时,乙炔放出的热稍小,耗氧少,生成的物质的量也少。
D 每摩乙烯完全燃烧,生成气态产物时,放热小于1411KJ
10、下列叙述正确的是( )
A、如果5。5升N2含有n个氮分子,则NA一定为4n。
B、如下图所示化合物的分子式是C10H13N2:
C、在100ml 0。5mol/L乙酸溶液中含乙酸分子数为0。05NA
D、15。6克Na2O2与过量的CO2反应时,转移的电子数为0。2NA
11、已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡,下列说法正确的是( )
A 通入稀有气体使压强增大,平衡将正向移动。
B X的正反应速率是Y的逆反应速率的m/n倍。
C 降低温度,混合气体的平均相对分子质量变小。
D 增加X的物质的量,Y的转化率降低。
12、室温时,有下列四种溶液:①0。1mol/L氨水。②0。1mol/LNH4CI溶液。③0。2mol/L盐酸和0。2mol/LNH4CI溶液等体积混和。④0。2mol/LNaOH溶液和0。2mol/L氨水等体积混和。
四种溶液中,c(NH4+)由大到小排列正确的是( )
A ②③④① B ④①②③ C ①④②③ D ③②①④
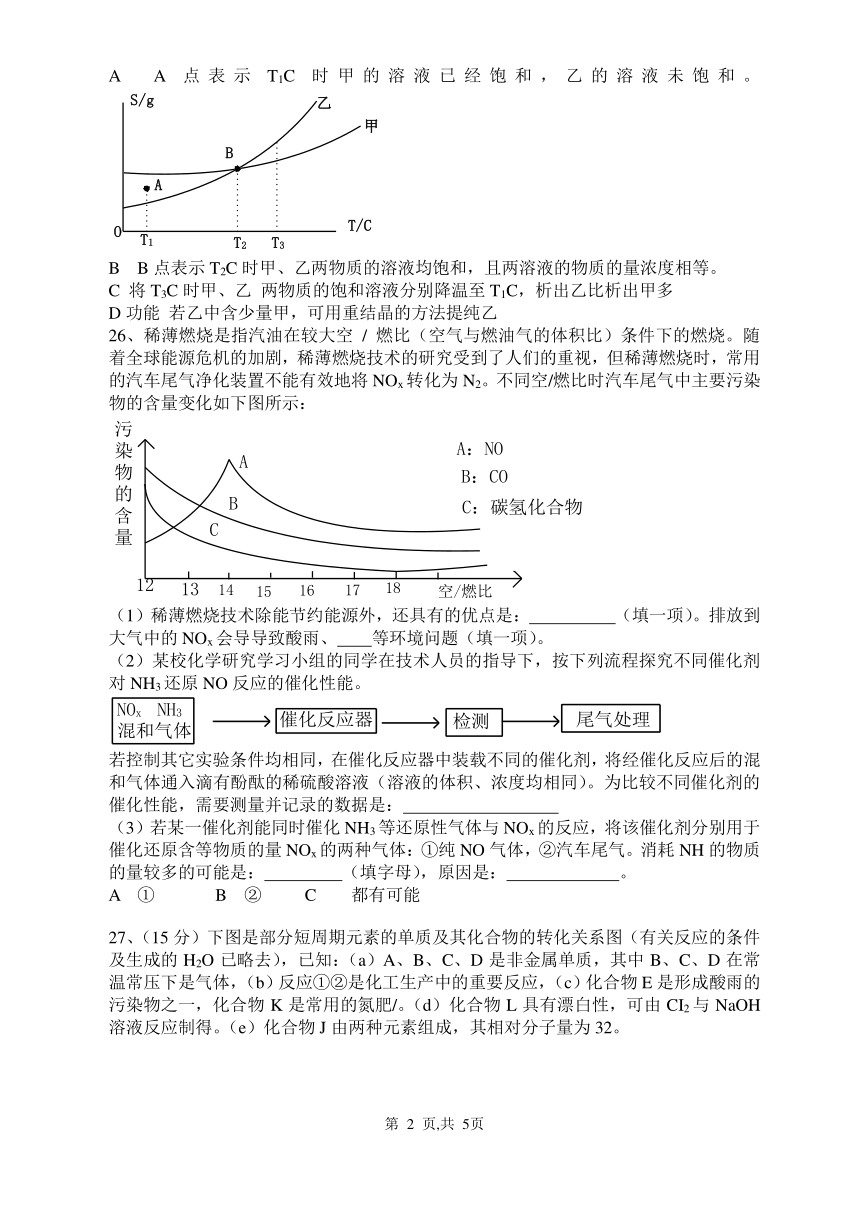
13、甲、乙两种物质的溶解度曲线如右图所示,下列说法一定
正确的是( )
A A点表示T1C时甲的溶液已经饱和,乙的溶液未饱和。
B B点表示T2C时甲、乙两物质的溶液均饱和,且两溶液的物质的量浓度相等。
C 将T3C时甲、乙 两物质的饱和溶液分别降温至T1C,析出乙比析出甲多
D功能 若乙中含少量甲,可用重结晶的方法提纯乙
26、稀薄燃烧是指汽油在较大空 / 燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示:
(1)稀薄燃烧技术除能节约能源外,还具有的优点是: (填一项)。排放到大气中的NOx会导导致酸雨、 等环境问题(填一项)。
(2)某校化学研究学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
若控制其它实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混和气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是:
(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应,将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH的物质的量较多的可能是: (填字母),原因是: 。
A ① B ② C 都有可能
27、(15分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体,(b)反应①②是化工生产中的重要反应,(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥/。(d)化合物L具有漂白性,可由CI2与NaOH溶液反应制得。(e)化合物J由两种元素组成,其相对分子量为32。
请按要求填空:
(1)反应③的化学方程式:
(2)C的结构式: H的化学式:
(3)L的溶液与化合物E反应的离子方程式:
(4)化合物J的化学式:
28. (15分)
烃通过臭氧化并经锌和水处理得到醛或酮。
例如:
上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳62.1%,含氢10.3%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色的物质E。反应图示如下:
回答下列问题:
(1)的反应类型为_____________;C中含有官能团的名称为___________;B的相对分子质量是_________________。
(2)的化学方程式是:
______________________________________________________________。
(3)A的结构简式为__________________________________________。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理只得到一种产物,写出所有符合该条件的同分异构体的结构简式。
______________________________________________________________________________________________________________________________________________________。
)
29.(共16分)(本题共2小题)
I.(6分)某温度时,只含C、H、O三种元素的有机物在足量氧气中充分燃烧,其燃烧产物立即与反应固体质量增加。试回答:
(1)写出符合上述条件且相对分子质量最小的有机物A的结构简式: 。
(2)写出符合上述条件且相对分子质量是A的2倍,但不是羧酸和酯的链状结构的有机物的结构简式: (任意写出一种)。
(3)归纳出符合上述条件的该有机物的分子通式是: (C、H、O的原子个数用、表示)
II.(10分)为了测定一种氧化型的磁性粉末(复合材料)的组成,现称取一定质量的样品,向其中加入的过量硝酸。待其全部溶解后,把溶液分成两等份。一份加入足量稀硫酸,生成白色沉淀,经过滤、洗涤、烘干后称重,其质量为。向另一份溶液中逐滴滴加溶液,边加边振荡至恰好沉淀完全,将沉淀过滤、洗涤、灼烧,得固体。
(1)化学式中的值为 。
(2)若全部是+2价,该磁性粉末溶于硝酸时消耗硝酸的物质的量为 ,若全部是+3价,该磁性粉末溶于硝酸时消耗硝酸的物质的量为 。
(3)如果反应中消耗的溶液的物质的量浓度为,体积为,判断的化合价是 ,该磁性粉末的化学式 。
答案:6、C 7、B 8、A 9、A 10、D 11、B 12、D 13、D
26、(14分)(1)减少CO和碳氢化合物的排放;光化学烟雾或破坏臭氧层. (2)溶液显色所需的时间 (3)A 汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3或B 汽车尾气中含有一定量的NOx,多消耗NH3或C 汽车尾气中同时含有CO和碳氢化合物等还原性气体和NOx等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少
27、(15分)(1)2NH3+H2SO4==(NH4)2SO4 (2)氮氮叁键, (NH4)2SO3或NH4HSO3(3)CIO-+SO2+2OH-==CI-+SO42-+H2O (4)N2H4
28. (15分)
(1)消去反应(2分);醛基(2分);58(2分)。
(2)
(3分)
(3)(2分)
(4)(4分
29.(16分)
I.
(1)HCHO(2分)
(2)HOCH2CHO或HOCH=CHOH(2分)
(3)(2分)
II.
(1)
所以(2分)
(2)当铁全部是+2价时,转化为(硝酸过量)并且有NO产生,钡生成,消耗(2分)
当铁全部为+3价时,则铁生成,钡生成
消耗(2分)
(3)溶液将铁沉淀后,溶液中溶质为和,
(),恰好等于加入硝酸根离子的量,所以硝酸未发生氧化还原反应,因而铁为+3价。
由化合价代数和为0可求得化学式为(4分)
6、下列说法正确的是( )
A乙醇和汽油都是可再生的能源,应大力推广“乙醇汽油”
B、钢铁在海水中比在河水中更易腐蚀,主要原因是海水中含氧量高于河水。
C、废弃的塑料、金属、纸制品及玻璃都是可回收利用的资源。
D、凡含有食品添加剂的食物对人体健康均有害,不宜食用。
7、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
A 2Na218O2+2H2O==4Na18OH+O2
B 2KMnO4+5H218O+3H2SO4==K2SO4+2MnSO4+518O2↑+8H2O
C NH4CI+2H2O==NH4·2H2O+HCI
D K37CIO3+6HCI==K37CI+3CI+3H2O
8、下列八组离子:a: I- 、CIO- 、 NO3- 、H+。 b:K+ 、NH4+、 HCO3- 、 OH- 。 c:SO32-、 SO42-、 Na+、 OH- d: Fe2+、 Cu2+ 、SO42- 、CI- e :H+、 K+ 、AIO2-、 HSO3-、 f:Ca2+、 Na+ 、SO42- 、CO32-。 g: CIO- 、S2- 、H+、 K+ h: MnO4- 、SO32-、 K+、 Na2+;
能形成无色透明溶液,且能大量共存的是( )
A 1组 B 3组, C 5组, D 8组。
9、已知乙炔和乙烯燃烧的热化学方程式为 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l);△H=-2600kj/mol,
C2H4(g)+3O2(g)→2CO2(g)+2H2O(l);△H=-1411kj/mol,又已知,氧炔焰的温度高于乙烯的火焰的温度。据此,下列叙述错误的是( )
A 每摩尔烃完全燃烧时,放热多,火焰温度也高。
B 烃完全燃烧时,火焰温度的高低不仅仅决定于燃烧的反应热的大小。
C 相同条件下,等体积乙炔和乙烯完全燃烧时,乙炔放出的热稍小,耗氧少,生成的物质的量也少。
D 每摩乙烯完全燃烧,生成气态产物时,放热小于1411KJ
10、下列叙述正确的是( )
A、如果5。5升N2含有n个氮分子,则NA一定为4n。
B、如下图所示化合物的分子式是C10H13N2:
C、在100ml 0。5mol/L乙酸溶液中含乙酸分子数为0。05NA
D、15。6克Na2O2与过量的CO2反应时,转移的电子数为0。2NA
11、已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡,下列说法正确的是( )
A 通入稀有气体使压强增大,平衡将正向移动。
B X的正反应速率是Y的逆反应速率的m/n倍。
C 降低温度,混合气体的平均相对分子质量变小。
D 增加X的物质的量,Y的转化率降低。
12、室温时,有下列四种溶液:①0。1mol/L氨水。②0。1mol/LNH4CI溶液。③0。2mol/L盐酸和0。2mol/LNH4CI溶液等体积混和。④0。2mol/LNaOH溶液和0。2mol/L氨水等体积混和。
四种溶液中,c(NH4+)由大到小排列正确的是( )
A ②③④① B ④①②③ C ①④②③ D ③②①④
13、甲、乙两种物质的溶解度曲线如右图所示,下列说法一定
正确的是( )
A A点表示T1C时甲的溶液已经饱和,乙的溶液未饱和。
B B点表示T2C时甲、乙两物质的溶液均饱和,且两溶液的物质的量浓度相等。
C 将T3C时甲、乙 两物质的饱和溶液分别降温至T1C,析出乙比析出甲多
D功能 若乙中含少量甲,可用重结晶的方法提纯乙
26、稀薄燃烧是指汽油在较大空 / 燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示:
(1)稀薄燃烧技术除能节约能源外,还具有的优点是: (填一项)。排放到大气中的NOx会导导致酸雨、 等环境问题(填一项)。
(2)某校化学研究学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
若控制其它实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混和气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是:
(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应,将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH的物质的量较多的可能是: (填字母),原因是: 。
A ① B ② C 都有可能
27、(15分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体,(b)反应①②是化工生产中的重要反应,(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥/。(d)化合物L具有漂白性,可由CI2与NaOH溶液反应制得。(e)化合物J由两种元素组成,其相对分子量为32。
请按要求填空:
(1)反应③的化学方程式:
(2)C的结构式: H的化学式:
(3)L的溶液与化合物E反应的离子方程式:
(4)化合物J的化学式:
28. (15分)
烃通过臭氧化并经锌和水处理得到醛或酮。
例如:
上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳62.1%,含氢10.3%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色的物质E。反应图示如下:
回答下列问题:
(1)的反应类型为_____________;C中含有官能团的名称为___________;B的相对分子质量是_________________。
(2)的化学方程式是:
______________________________________________________________。
(3)A的结构简式为__________________________________________。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理只得到一种产物,写出所有符合该条件的同分异构体的结构简式。
______________________________________________________________________________________________________________________________________________________。
)
29.(共16分)(本题共2小题)
I.(6分)某温度时,只含C、H、O三种元素的有机物在足量氧气中充分燃烧,其燃烧产物立即与反应固体质量增加。试回答:
(1)写出符合上述条件且相对分子质量最小的有机物A的结构简式: 。
(2)写出符合上述条件且相对分子质量是A的2倍,但不是羧酸和酯的链状结构的有机物的结构简式: (任意写出一种)。
(3)归纳出符合上述条件的该有机物的分子通式是: (C、H、O的原子个数用、表示)
II.(10分)为了测定一种氧化型的磁性粉末(复合材料)的组成,现称取一定质量的样品,向其中加入的过量硝酸。待其全部溶解后,把溶液分成两等份。一份加入足量稀硫酸,生成白色沉淀,经过滤、洗涤、烘干后称重,其质量为。向另一份溶液中逐滴滴加溶液,边加边振荡至恰好沉淀完全,将沉淀过滤、洗涤、灼烧,得固体。
(1)化学式中的值为 。
(2)若全部是+2价,该磁性粉末溶于硝酸时消耗硝酸的物质的量为 ,若全部是+3价,该磁性粉末溶于硝酸时消耗硝酸的物质的量为 。
(3)如果反应中消耗的溶液的物质的量浓度为,体积为,判断的化合价是 ,该磁性粉末的化学式 。
答案:6、C 7、B 8、A 9、A 10、D 11、B 12、D 13、D
26、(14分)(1)减少CO和碳氢化合物的排放;光化学烟雾或破坏臭氧层. (2)溶液显色所需的时间 (3)A 汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3或B 汽车尾气中含有一定量的NOx,多消耗NH3或C 汽车尾气中同时含有CO和碳氢化合物等还原性气体和NOx等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少
27、(15分)(1)2NH3+H2SO4==(NH4)2SO4 (2)氮氮叁键, (NH4)2SO3或NH4HSO3(3)CIO-+SO2+2OH-==CI-+SO42-+H2O (4)N2H4
28. (15分)
(1)消去反应(2分);醛基(2分);58(2分)。
(2)
(3分)
(3)(2分)
(4)(4分
29.(16分)
I.
(1)HCHO(2分)
(2)HOCH2CHO或HOCH=CHOH(2分)
(3)(2分)
II.
(1)
所以(2分)
(2)当铁全部是+2价时,转化为(硝酸过量)并且有NO产生,钡生成,消耗(2分)
当铁全部为+3价时,则铁生成,钡生成
消耗(2分)
(3)溶液将铁沉淀后,溶液中溶质为和,
(),恰好等于加入硝酸根离子的量,所以硝酸未发生氧化还原反应,因而铁为+3价。
由化合价代数和为0可求得化学式为(4分)
同课章节目录
