四平市2007年高考化学模拟试题[下学期]
文档属性
| 名称 | 四平市2007年高考化学模拟试题[下学期] |

|
|
| 格式 | zip | ||
| 文件大小 | 267.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-05-01 00:00:00 | ||
图片预览



文档简介
四平市2007年高考化学模拟试题
(试卷总分:100分 考试时间:100分钟)
第I卷(选择题 共42分)
可能用到的相对原子质量:H-1 N-14 O-16 Na-23
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意。)
1.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是 ( )
A.在燃料煤中添加氧化钙
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机
2.某单质X能从盐溶液中置换出单质Y,由此可知 ( )
①当X、Y都是金属时,X一定比Y活泼;②当X、Y都是非金属时, X一定比Y活
泼;③当X是金属时,Y可能是金属,也可能是非金属;④当X是非金属时,Y可能
是金属,也可能是非金属
A.①②③ B.③④ C.①③ D.②③④
3.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与FeCl3溶液 ②Cu与HNO3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.②④ C.②③ D.①③④
4.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,
XX’型卤素互化物与卤素单质结构相似、性质相近。右图是部分
卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系
图。试推测ICl的沸点所处的范围 ( )
A.Cl2和BrCl之间 B.Br2和IBr之间
C.IBr和I2之间 D.BrCl和Br2之间
5.将钠投入下列溶液中,反应的剧烈程度由强到弱的是 ( )
①水 ②NaOH溶液 ③0.1 mol·L–1盐酸 ④0.1 mol·L–1硫酸铁溶液
A.④③②① B.④③①②
C.③④①② D.①③④②
6.下面是合成氨的简要流程示意图:
沿x路线回去的物质是 ( )
A. H2 B.催化剂 C.NH3 D.N2和H2
7. 下列实验操作中,所使用的仪器或试纸要求干燥的是( )
A. 配制一定物质的量浓度溶液时所用的容量瓶
B. 用氯化铵和熟石灰混合加热制氨气时收集气体所用的试管
C. 中和滴定所用的锥形瓶
D. 检验氨气所用的红色石蕊试纸
8.用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.1.0L 1.0mol·L1CH3COOH溶液中,CH3COOH分子数为NA
B.在同温同压时,相同体积的任何气体单质所含的原子数目相同
C.1molCH4分子中共价键总数为4NA
D.4.6g NO2和N2O4的混合物所含的分子数为1NA
9.下列反应的离子方程式正确的是 ( )
A.氯化铝溶液中加入过量氨水:Al3+ +4NH3 H2OAlO2+ 4NH4+ + 2H2O
B.用小苏打治疗胃酸过多:HCO3+H+CO2↑+H2O
C.把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3– + Ca2+ + OH–CaCO3↓+ H2O,
D.如将少量SO2通入漂白粉溶液中:H2O+SO2+Ca2++2ClO–CaSO3↓+2HClO
10.一些烷烃的燃烧热(kJ·mol1)如下表:
化合物 燃烧热 化合物 燃烧热
甲烷 891.0 正丁烷 2878.0
乙烷 1560.8 异丁烷 2869.6
丙烷 2221.5 2-甲基丁烷 3531.3
下列表达正确的是 ( )
A.热稳定性:正丁烷>异丁烷
B.正戊烷的燃烧热大约在3540 k J/mol左右
C.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);ΔH=-1560.8 kJ·mol1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
11.下列实验中,溶液颜色有明显变化的是
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO4溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
12.以为原料(其他无机试剂任选),可合成,下列有关说法正确的是 ( )
A、是苯的同系物
B、合成过程中涉及到的反应类型有4种
C、的分子式为C9H9O2
D、1mol可与5molH2发生加成反应
13.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下: ( )
实验次数 电极材料 水果品种 电极间距/cm 电压/mV
1 锌 铜 菠萝 3 900
2 锌 铜 苹果 3 650
3 锌 铜 柑 3 850
4 锌 铜 西红柿 3 750
5 锌 铝 菠萝 3 650
6 锌 铝 苹果 3 450
甲同学提出的问题,乙同学解释不正确的是 ( )
①甲:实验6中的负极电极反应如何写?乙:铝为负极:Al-3e-=Al 3+
②甲:实验1,5电流方向为什么相反?乙:1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关?乙:同学只跟水果的类型有关
A.③ B.① C.①②③ D.②③
14.下列叙述错误的是 ( )
A.将0.l mol·L1醋酸溶液加水稀释,溶液的pH增大
B.10 mL 0.02mol·L1HCl溶液与10 mL 0.02mol·L1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.多元酸、多元碱的导电性一定比一元酸、一元碱的导电能力强
D.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系是:
c(NH4+)>c(Cl)>c(OH)>c(H+)
第II卷(共58分)
二、(本大题2小题,共18分)
15.(7分)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装置实现多种用途。
图1 图2 图3
(1)利用图1装置,用两种不同的方法分别收集NO,试简述操作方法:
① ;② 。
(2)甲同学把试管底部钻出一小洞,并和广口瓶组成图2装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有 (填二种)。
(3)乙同学认为,可把图2装置做如图3的改动,用橡皮塞替代铁架台来固定试管。请判断乙同学的做法是否可行 ,理由是
。
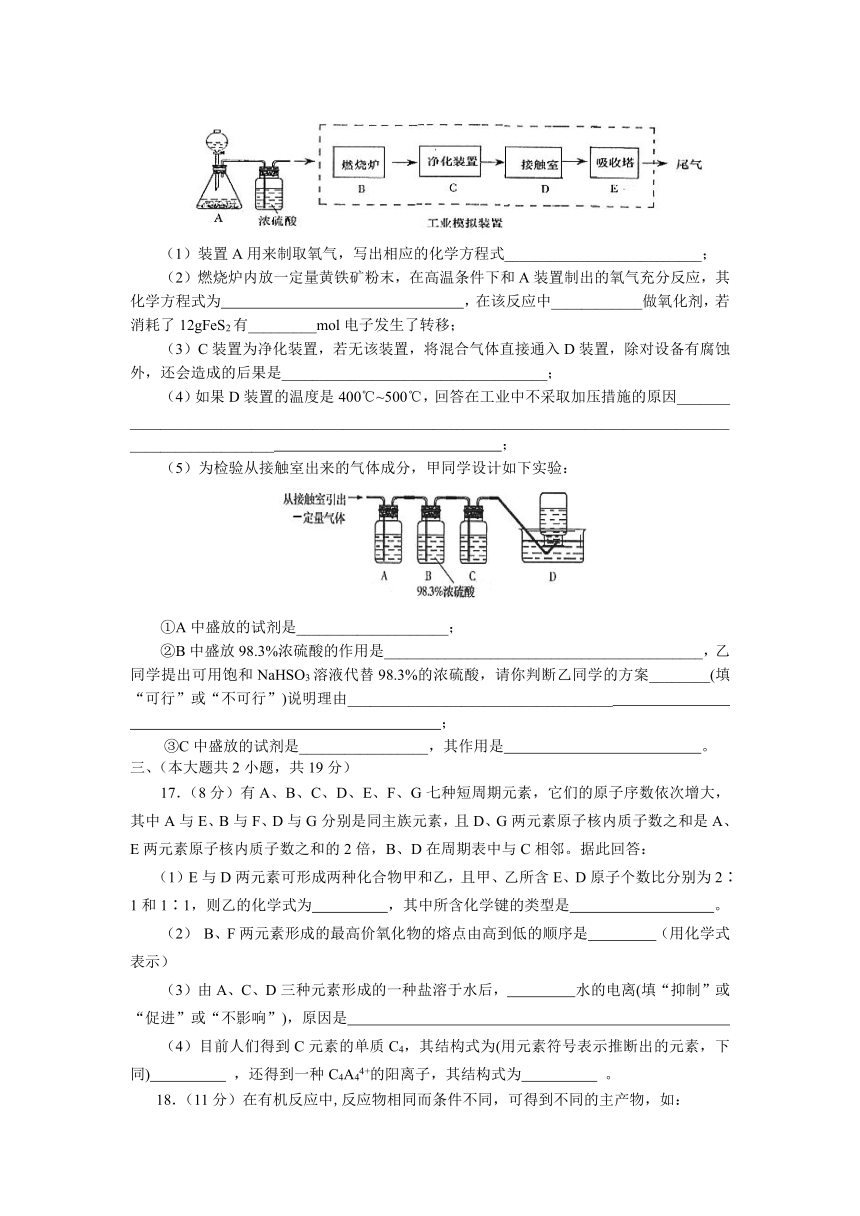
16.(14分)某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂,若消耗了12gFeS2有_________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是___________________________________;
(4)如果D装置的温度是400℃~500℃,回答在工业中不采取加压措施的原因_______
__________________________________________________________________________________________________ ;
(5)为检验从接触室出来的气体成分,甲同学设计如下实验:
①A中盛放的试剂是____________________;
②B中盛放98.3%浓硫酸的作用是__________________________________________,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案________(填“可行”或“不可行”)说明理由___________________________________
;
③C中盛放的试剂是_________________,其作用是 。
三、(本大题共2小题,共19分)
17.(8分)有A、B、C、D、E、F、G七种短周期元素,它们的原子序数依次增大,其中A与E、B与F、D与G分别是同主族元素,且D、G两元素原子核内质子数之和是A、E两元素原子核内质子数之和的2倍,B、D在周期表中与C相邻。据此回答:
(1)E与D两元素可形成两种化合物甲和乙,且甲、乙所含E、D原子个数比分别为2∶1和1∶1,则乙的化学式为 ,其中所含化学键的类型是 。
(2) B、F两元素形成的最高价氧化物的熔点由高到低的顺序是 (用化学式表示)
(3)由A、C、D三种元素形成的一种盐溶于水后, 水的电离(填“抑制”或“促进”或“不影响”),原因是
(4)目前人们得到C元素的单质C4,其结构式为(用元素符号表示推断出的元素,下同) ,还得到一种C4A44+的阳离子,其结构式为 。
18.(11分)在有机反应中,反应物相同而条件不同,可得到不同的主产物,如:
请根据以下框图回答问题:
已知物质A显酸性,F为七原子组成的环状物。
(1)写出下列物质的结构简式:
A:___________________________,G:__________________________。
(2)反应Ⅰ、Ⅱ、Ⅲ的反应类型分别为__________、_________、_________。
(3)写出化学方程式:
D+E→F:_______________________ 。
(4)写出C的同分异构体中属于酯类物质的结构简式:(任写两种)
________ 、________ 。
四、 (本大题共2小题,共18分)
19.(8分)加入0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g·mL1)中,在标准状况下放出气体的体积和时间的关系如右图所示。 B
(1)实验时放出气体的总体积是_______,放出气体所需时间为_______。
(2)A、B、C、D各点反应速率快慢的顺序为_________ ,解释反应速率变化的原因____________________ 。
(3)计算H2O2的初始物质的量浓度 。
20.(10分)据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:
取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0mL溶液,和13.5mL 1.00mol·L1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
1.D 解析:D项中,增加煤炭燃料的供应量,只能加剧环境污染程度,不利于“蓝天工程”的建设,D项错误。
知识点提示 考查对环保知识的认知程度。
2.A 解析:解题过程中注意盐可以是正盐,也可能是酸式盐,如NaHSO4溶液与Zn的反应,则是金属置换出非金属。
知识点提示 考查置换反应关系,借以考查对元素化合物知识的掌握程度。
3.C 解析:①的反应与浓度无关,②中浓HNO3与Cu反应同稀HNO3与Cu反应的反应产物(氮的氧化物)不同,③中硫酸的浓度不同,反应不同(浓硫酸有强氧化性,而稀硫酸仅有酸的通性,④中的反应与浓度无关。由此可知①③中两种酸的浓度不同发生不同的氧化还原反应。
知识点提示 外界条件的改变对反应方向的影响,借以考查对元素化合物知识的掌握程度。
4.B 解析:ICl属分子晶体,相对分子质量(162.5)介于Br2和IBr之间,故ICl的沸点介于Br2和IBr之间。
知识点提示 卤素互化物概念,分子晶体的沸点随着相对分子质量的增大而升高。
5.C 解析: c(H+)越大,反应速率越快,其中显酸性的是③④,但④是因Fe3+水解显弱酸性,故其排列顺序为:(HCl)>[Fe2(SO4)3]>10–7 mol·L–1,而②是碱溶液,c(H+)<10–7 mol·L–1,①中水呈中性,c(H+)=10–7 mol·L–1,所以c(H+)的大小顺序为:③>④>①>②,即为反应的剧烈程度由强到弱的顺序。
知识点提示 金属钠的性质
6.D 解析:反应混合气经过合成塔发生反应:N2+3H22NH3,成分变为N2、H2、NH3,经冷凝,NH3液化,N2、H2沸点很低,仍未液化,故再送入压缩机,循环使用,提高原料利用率。
知识点提示 合成氨工业常识。
7.B 解析:B所需要的试管必须干燥,因氨气极易溶于水,其余不需干燥。
知识点提示 化学实验基本操作
8.C 解析:A中的CH3COOH有部分发生电离使其分子数小于6.02×1023;B中在同温同压时,相同体积的任何气体单质所含的分子数目相同,而不是原子数目相同,如H2与氦气,B不正确;计算46gNO2和N2O4的物质的量总量用NO2的摩尔质量46g mol1还要考虑NO2和N2O4的平衡转化问题。
知识点提示 阿伏加德罗常数,特别注意一些陷阱的设置
9.B 解析:分析选项A时,应该注意到Al(OH)3不能溶于过量氨水,故此选项不正确;C项错在未考虑反应物中量的关系。应为:2HCO3– +Ca2+ +2OH– =CaCO3↓+2H2O +CO32–;D项错在忽略了HClO可以将+4价的硫氧化,应为:H2O+SO2 +Ca2+ +ClO– =CaSO4↓+2H+ + Cl–;只有B项正确。
知识点提示 离子方程式的书写方法和原则,借以考查对元素化合物知识的掌握程度
10.B 查表可知燃烧热(kJ·mol1):正丁烷:2878.0异丁烷:2869.6,故热稳定性:正丁烷<异丁烷,A选项错误;从表中信息可知,正戊烷的燃烧热应大于2-甲基丁烷,故B选项正确;C选项H2O应为液态,ΔH=-3121.6 kJ·mol1;相同质量的甲烷,燃烧放出的热量最多,故D错误。
知识点提示 考查热化学方程式书写,综合考查了数据、表格的灵活运用和分析处理,信息迁移、综合应用等能力。
答案B 解析:在A选项中,反应前后,溶液都为无色。在B选项中,向棕黄色的FeCl3溶液中滴加无色的KI溶液,由于Fe3+能将无色的I-氧化成褐色的I2,再加淀粉后,溶液变蓝。在C选项中,NaHSO4溶液无色,与Na2O2固体反应(实质是其中的水)后,生成NaOH,所以溶液前后均无色。在D选项中,两者不反应,所以除稀释外就没有明显的颜色的改变。
12.B 解析 苯的同系物在支链上烃基是饱和的,A不正确;由所进行的反应:
可得知B正确;的分子式为C9H8O2,C不正确;1mol可与4molH2发生加成反应,D不正确。本题也可用排除法来解,A、C、D明显错误,则B正确。
13.A 通过比较实验1、5,2、6分析得出:电压的高低与电极材料和水果介质有关。
知识点提示 原电池知识,着重考查对图表给出素材敏捷获取相关信息的能力。
14.C
解析:因醋酸是弱电解质,加水能促进其电离,平衡向右移动,但溶液中的c(H+)减小,A正确;B项中酸碱中和反应后,c(OH)==1×102 mol·L1,pH=12,B正确;有些多元酸、多元碱是弱电解质,电离的分子很少,其导电性远远小于强的一元酸、一元碱,C错误;pH=3的盐酸的浓度为103mol·L1,而pH=11的氨水的浓度大约为0.1 mol·L1远大于盐酸的浓度,故等体积混合后氨水过量,D正确。
知识点提示 弱电解质的电离平衡、电解质的导电能力、溶液的pH计算、离子浓度大小比较
15.(1)①广口瓶中盛满水,NO从B管通入;(1分)
②广口瓶中盛满CO2气体,NO从B管通人(1分)
(2)H2 CO2 H2S (填任意二种即可)(2分)
(3)否(1分) 由于广口瓶被橡皮塞密封后,瓶内的气压会随液体的排入而增大,使试管中的液体不能在关闭阀门时排入广口瓶中,因而不能使反应随时停止,甚至会由于容器中气压过高而发生危险。(2分)
知识点提示 化学实验基本操作及实验创新
16.(1)2H2O22H2O +O2↑(或2 Na2O2+ 2H2O4NaOH+O2↑) (2分)
(2)4FeS2+11O22Fe2O3+8SO2↑(1分) 氧气(1分) 1.1mol(1分)
(3)催化剂中毒(1分) (4)在常压下400℃~500℃时,SO2的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。(2分)
(5)①氯化钡溶液 ②除去SO3,排除SO3对SO2检验的干扰 不可行 虽然饱和NaHSO3溶液可除去SO3,但SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。 ③品红溶液(或溴水) 检验SO2 (每空1分)
知识点提示 硫酸的工业制法 氧化还原反应 化学平衡 SO2、SO3的性质实验
17.(1)Na2O2;离子键和共价键(每空1分) (2)SiO2>CO2(1分)
(3)促进(1分);
铵根离子与水电离产生的氢氧根离子结合成弱电解质,促进了水的电离(1分)
(4)(2分) ( )
知识点提示 考查元素周期律与周期表中元素“位、构、性”三者的关系
18.(1)CH2=CH—COOH (2分) (2分)
(2)加成反应、取代反应(或水解反应)、酯化反应(每空1分)
(3)(2分)
(4)(2分)
解析:已知物质A显酸性,故A为羧酸,故A的结构简式为CH2=CHCOOH。从题给信息知A与HBr发生加成反应,在不同条件下分别生成:2-溴丙酸和3-溴丙酸,因G能与银氨溶液发生银镜反应,故G为醛类,因而B为3-溴丙酸,C为2-溴丙酸
知识点提示 有机信息和有机框图题,解题时要吃透信息中“骨干”反应实质,与已学过的知识有机地结合起来,找准解题突破口,做出正确的推断。
19.(1)60 mL (1分) 1 min (1分)
(2)D>C>B>A (1分) 随着反应的进行,浓度减小,反应速率减慢 (1分)
(3)0.107 mol·L1(2分) (4)0.083%(2分)
解析:(3)根据H2O2分解的方程式,由生成的O2的物质的量可计算出H2O2的物质的量,由溶液的体积便可得:c(H2O2)==0.107 mol·L1
(4)由图知,2min后可生成15mLO2,是生成的O2总量的,则剩余的Na2O2的物质的量是Na2O2总量的,n(H2O2)(余)==1.34×103 mol,
m (H2O2)(余)=1.34×103 mol×34 g·mol1=4.55×102 g
w(H2O2)==×100%=0.083%
知识点提示 化学反应速率的概念,反应速率的表示方法,外界条件(浓度、温度、压强、催化剂等)对反应速率的影响。
20.解:n(Na)=0.500 mol (1分)
钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N。 (1分)
n(O2)==0.0100 mol (1分)
2Na2O2+2H2O4NaOH+O2↑
0.0200 mol 0.0100 mol
n(Na2O2)=0.0200mol (1分)
Na→NaOH,由Na守恒知
c(NaOH)=0.500mo1·L1,25 mL溶液中n(NaOH)=1.25×102mol
n(HCl)=1.35×102mol>n(NaOH),说明溶液中还有氨水。 (2分)
原l L溶液中n(NH3·H2O)=×(1.35×102一1.25×102) mo1=4.00×102mol
Na3N+4H2O3NaOH+NH3·H2O
4.00×102 mol 4.00×102mol
即:n(Na3N)=0.0400mo1 (2分)
n(Na2O)=(0.500 mo1一0.0400 mo1×3-0.020 mo1×2)/2=0.170 mo1 (2分)
知识点提示 钠及其化合物的性质,物质的量有关计算
(试卷总分:100分 考试时间:100分钟)
第I卷(选择题 共42分)
可能用到的相对原子质量:H-1 N-14 O-16 Na-23
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意。)
1.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是 ( )
A.在燃料煤中添加氧化钙
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机
2.某单质X能从盐溶液中置换出单质Y,由此可知 ( )
①当X、Y都是金属时,X一定比Y活泼;②当X、Y都是非金属时, X一定比Y活
泼;③当X是金属时,Y可能是金属,也可能是非金属;④当X是非金属时,Y可能
是金属,也可能是非金属
A.①②③ B.③④ C.①③ D.②③④
3.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与FeCl3溶液 ②Cu与HNO3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.②④ C.②③ D.①③④
4.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,
XX’型卤素互化物与卤素单质结构相似、性质相近。右图是部分
卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系
图。试推测ICl的沸点所处的范围 ( )
A.Cl2和BrCl之间 B.Br2和IBr之间
C.IBr和I2之间 D.BrCl和Br2之间
5.将钠投入下列溶液中,反应的剧烈程度由强到弱的是 ( )
①水 ②NaOH溶液 ③0.1 mol·L–1盐酸 ④0.1 mol·L–1硫酸铁溶液
A.④③②① B.④③①②
C.③④①② D.①③④②
6.下面是合成氨的简要流程示意图:
沿x路线回去的物质是 ( )
A. H2 B.催化剂 C.NH3 D.N2和H2
7. 下列实验操作中,所使用的仪器或试纸要求干燥的是( )
A. 配制一定物质的量浓度溶液时所用的容量瓶
B. 用氯化铵和熟石灰混合加热制氨气时收集气体所用的试管
C. 中和滴定所用的锥形瓶
D. 检验氨气所用的红色石蕊试纸
8.用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.1.0L 1.0mol·L1CH3COOH溶液中,CH3COOH分子数为NA
B.在同温同压时,相同体积的任何气体单质所含的原子数目相同
C.1molCH4分子中共价键总数为4NA
D.4.6g NO2和N2O4的混合物所含的分子数为1NA
9.下列反应的离子方程式正确的是 ( )
A.氯化铝溶液中加入过量氨水:Al3+ +4NH3 H2OAlO2+ 4NH4+ + 2H2O
B.用小苏打治疗胃酸过多:HCO3+H+CO2↑+H2O
C.把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3– + Ca2+ + OH–CaCO3↓+ H2O,
D.如将少量SO2通入漂白粉溶液中:H2O+SO2+Ca2++2ClO–CaSO3↓+2HClO
10.一些烷烃的燃烧热(kJ·mol1)如下表:
化合物 燃烧热 化合物 燃烧热
甲烷 891.0 正丁烷 2878.0
乙烷 1560.8 异丁烷 2869.6
丙烷 2221.5 2-甲基丁烷 3531.3
下列表达正确的是 ( )
A.热稳定性:正丁烷>异丁烷
B.正戊烷的燃烧热大约在3540 k J/mol左右
C.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);ΔH=-1560.8 kJ·mol1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
11.下列实验中,溶液颜色有明显变化的是
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO4溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
12.以为原料(其他无机试剂任选),可合成,下列有关说法正确的是 ( )
A、是苯的同系物
B、合成过程中涉及到的反应类型有4种
C、的分子式为C9H9O2
D、1mol可与5molH2发生加成反应
13.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下: ( )
实验次数 电极材料 水果品种 电极间距/cm 电压/mV
1 锌 铜 菠萝 3 900
2 锌 铜 苹果 3 650
3 锌 铜 柑 3 850
4 锌 铜 西红柿 3 750
5 锌 铝 菠萝 3 650
6 锌 铝 苹果 3 450
甲同学提出的问题,乙同学解释不正确的是 ( )
①甲:实验6中的负极电极反应如何写?乙:铝为负极:Al-3e-=Al 3+
②甲:实验1,5电流方向为什么相反?乙:1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关?乙:同学只跟水果的类型有关
A.③ B.① C.①②③ D.②③
14.下列叙述错误的是 ( )
A.将0.l mol·L1醋酸溶液加水稀释,溶液的pH增大
B.10 mL 0.02mol·L1HCl溶液与10 mL 0.02mol·L1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.多元酸、多元碱的导电性一定比一元酸、一元碱的导电能力强
D.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系是:
c(NH4+)>c(Cl)>c(OH)>c(H+)
第II卷(共58分)
二、(本大题2小题,共18分)
15.(7分)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装置实现多种用途。
图1 图2 图3
(1)利用图1装置,用两种不同的方法分别收集NO,试简述操作方法:
① ;② 。
(2)甲同学把试管底部钻出一小洞,并和广口瓶组成图2装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有 (填二种)。
(3)乙同学认为,可把图2装置做如图3的改动,用橡皮塞替代铁架台来固定试管。请判断乙同学的做法是否可行 ,理由是
。
16.(14分)某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂,若消耗了12gFeS2有_________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是___________________________________;
(4)如果D装置的温度是400℃~500℃,回答在工业中不采取加压措施的原因_______
__________________________________________________________________________________________________ ;
(5)为检验从接触室出来的气体成分,甲同学设计如下实验:
①A中盛放的试剂是____________________;
②B中盛放98.3%浓硫酸的作用是__________________________________________,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案________(填“可行”或“不可行”)说明理由___________________________________
;
③C中盛放的试剂是_________________,其作用是 。
三、(本大题共2小题,共19分)
17.(8分)有A、B、C、D、E、F、G七种短周期元素,它们的原子序数依次增大,其中A与E、B与F、D与G分别是同主族元素,且D、G两元素原子核内质子数之和是A、E两元素原子核内质子数之和的2倍,B、D在周期表中与C相邻。据此回答:
(1)E与D两元素可形成两种化合物甲和乙,且甲、乙所含E、D原子个数比分别为2∶1和1∶1,则乙的化学式为 ,其中所含化学键的类型是 。
(2) B、F两元素形成的最高价氧化物的熔点由高到低的顺序是 (用化学式表示)
(3)由A、C、D三种元素形成的一种盐溶于水后, 水的电离(填“抑制”或“促进”或“不影响”),原因是
(4)目前人们得到C元素的单质C4,其结构式为(用元素符号表示推断出的元素,下同) ,还得到一种C4A44+的阳离子,其结构式为 。
18.(11分)在有机反应中,反应物相同而条件不同,可得到不同的主产物,如:
请根据以下框图回答问题:
已知物质A显酸性,F为七原子组成的环状物。
(1)写出下列物质的结构简式:
A:___________________________,G:__________________________。
(2)反应Ⅰ、Ⅱ、Ⅲ的反应类型分别为__________、_________、_________。
(3)写出化学方程式:
D+E→F:_______________________ 。
(4)写出C的同分异构体中属于酯类物质的结构简式:(任写两种)
________ 、________ 。
四、 (本大题共2小题,共18分)
19.(8分)加入0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g·mL1)中,在标准状况下放出气体的体积和时间的关系如右图所示。 B
(1)实验时放出气体的总体积是_______,放出气体所需时间为_______。
(2)A、B、C、D各点反应速率快慢的顺序为_________ ,解释反应速率变化的原因____________________ 。
(3)计算H2O2的初始物质的量浓度 。
20.(10分)据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:
取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0mL溶液,和13.5mL 1.00mol·L1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
1.D 解析:D项中,增加煤炭燃料的供应量,只能加剧环境污染程度,不利于“蓝天工程”的建设,D项错误。
知识点提示 考查对环保知识的认知程度。
2.A 解析:解题过程中注意盐可以是正盐,也可能是酸式盐,如NaHSO4溶液与Zn的反应,则是金属置换出非金属。
知识点提示 考查置换反应关系,借以考查对元素化合物知识的掌握程度。
3.C 解析:①的反应与浓度无关,②中浓HNO3与Cu反应同稀HNO3与Cu反应的反应产物(氮的氧化物)不同,③中硫酸的浓度不同,反应不同(浓硫酸有强氧化性,而稀硫酸仅有酸的通性,④中的反应与浓度无关。由此可知①③中两种酸的浓度不同发生不同的氧化还原反应。
知识点提示 外界条件的改变对反应方向的影响,借以考查对元素化合物知识的掌握程度。
4.B 解析:ICl属分子晶体,相对分子质量(162.5)介于Br2和IBr之间,故ICl的沸点介于Br2和IBr之间。
知识点提示 卤素互化物概念,分子晶体的沸点随着相对分子质量的增大而升高。
5.C 解析: c(H+)越大,反应速率越快,其中显酸性的是③④,但④是因Fe3+水解显弱酸性,故其排列顺序为:(HCl)>[Fe2(SO4)3]>10–7 mol·L–1,而②是碱溶液,c(H+)<10–7 mol·L–1,①中水呈中性,c(H+)=10–7 mol·L–1,所以c(H+)的大小顺序为:③>④>①>②,即为反应的剧烈程度由强到弱的顺序。
知识点提示 金属钠的性质
6.D 解析:反应混合气经过合成塔发生反应:N2+3H22NH3,成分变为N2、H2、NH3,经冷凝,NH3液化,N2、H2沸点很低,仍未液化,故再送入压缩机,循环使用,提高原料利用率。
知识点提示 合成氨工业常识。
7.B 解析:B所需要的试管必须干燥,因氨气极易溶于水,其余不需干燥。
知识点提示 化学实验基本操作
8.C 解析:A中的CH3COOH有部分发生电离使其分子数小于6.02×1023;B中在同温同压时,相同体积的任何气体单质所含的分子数目相同,而不是原子数目相同,如H2与氦气,B不正确;计算46gNO2和N2O4的物质的量总量用NO2的摩尔质量46g mol1还要考虑NO2和N2O4的平衡转化问题。
知识点提示 阿伏加德罗常数,特别注意一些陷阱的设置
9.B 解析:分析选项A时,应该注意到Al(OH)3不能溶于过量氨水,故此选项不正确;C项错在未考虑反应物中量的关系。应为:2HCO3– +Ca2+ +2OH– =CaCO3↓+2H2O +CO32–;D项错在忽略了HClO可以将+4价的硫氧化,应为:H2O+SO2 +Ca2+ +ClO– =CaSO4↓+2H+ + Cl–;只有B项正确。
知识点提示 离子方程式的书写方法和原则,借以考查对元素化合物知识的掌握程度
10.B 查表可知燃烧热(kJ·mol1):正丁烷:2878.0异丁烷:2869.6,故热稳定性:正丁烷<异丁烷,A选项错误;从表中信息可知,正戊烷的燃烧热应大于2-甲基丁烷,故B选项正确;C选项H2O应为液态,ΔH=-3121.6 kJ·mol1;相同质量的甲烷,燃烧放出的热量最多,故D错误。
知识点提示 考查热化学方程式书写,综合考查了数据、表格的灵活运用和分析处理,信息迁移、综合应用等能力。
答案B 解析:在A选项中,反应前后,溶液都为无色。在B选项中,向棕黄色的FeCl3溶液中滴加无色的KI溶液,由于Fe3+能将无色的I-氧化成褐色的I2,再加淀粉后,溶液变蓝。在C选项中,NaHSO4溶液无色,与Na2O2固体反应(实质是其中的水)后,生成NaOH,所以溶液前后均无色。在D选项中,两者不反应,所以除稀释外就没有明显的颜色的改变。
12.B 解析 苯的同系物在支链上烃基是饱和的,A不正确;由所进行的反应:
可得知B正确;的分子式为C9H8O2,C不正确;1mol可与4molH2发生加成反应,D不正确。本题也可用排除法来解,A、C、D明显错误,则B正确。
13.A 通过比较实验1、5,2、6分析得出:电压的高低与电极材料和水果介质有关。
知识点提示 原电池知识,着重考查对图表给出素材敏捷获取相关信息的能力。
14.C
解析:因醋酸是弱电解质,加水能促进其电离,平衡向右移动,但溶液中的c(H+)减小,A正确;B项中酸碱中和反应后,c(OH)==1×102 mol·L1,pH=12,B正确;有些多元酸、多元碱是弱电解质,电离的分子很少,其导电性远远小于强的一元酸、一元碱,C错误;pH=3的盐酸的浓度为103mol·L1,而pH=11的氨水的浓度大约为0.1 mol·L1远大于盐酸的浓度,故等体积混合后氨水过量,D正确。
知识点提示 弱电解质的电离平衡、电解质的导电能力、溶液的pH计算、离子浓度大小比较
15.(1)①广口瓶中盛满水,NO从B管通入;(1分)
②广口瓶中盛满CO2气体,NO从B管通人(1分)
(2)H2 CO2 H2S (填任意二种即可)(2分)
(3)否(1分) 由于广口瓶被橡皮塞密封后,瓶内的气压会随液体的排入而增大,使试管中的液体不能在关闭阀门时排入广口瓶中,因而不能使反应随时停止,甚至会由于容器中气压过高而发生危险。(2分)
知识点提示 化学实验基本操作及实验创新
16.(1)2H2O22H2O +O2↑(或2 Na2O2+ 2H2O4NaOH+O2↑) (2分)
(2)4FeS2+11O22Fe2O3+8SO2↑(1分) 氧气(1分) 1.1mol(1分)
(3)催化剂中毒(1分) (4)在常压下400℃~500℃时,SO2的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。(2分)
(5)①氯化钡溶液 ②除去SO3,排除SO3对SO2检验的干扰 不可行 虽然饱和NaHSO3溶液可除去SO3,但SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。 ③品红溶液(或溴水) 检验SO2 (每空1分)
知识点提示 硫酸的工业制法 氧化还原反应 化学平衡 SO2、SO3的性质实验
17.(1)Na2O2;离子键和共价键(每空1分) (2)SiO2>CO2(1分)
(3)促进(1分);
铵根离子与水电离产生的氢氧根离子结合成弱电解质,促进了水的电离(1分)
(4)(2分) ( )
知识点提示 考查元素周期律与周期表中元素“位、构、性”三者的关系
18.(1)CH2=CH—COOH (2分) (2分)
(2)加成反应、取代反应(或水解反应)、酯化反应(每空1分)
(3)(2分)
(4)(2分)
解析:已知物质A显酸性,故A为羧酸,故A的结构简式为CH2=CHCOOH。从题给信息知A与HBr发生加成反应,在不同条件下分别生成:2-溴丙酸和3-溴丙酸,因G能与银氨溶液发生银镜反应,故G为醛类,因而B为3-溴丙酸,C为2-溴丙酸
知识点提示 有机信息和有机框图题,解题时要吃透信息中“骨干”反应实质,与已学过的知识有机地结合起来,找准解题突破口,做出正确的推断。
19.(1)60 mL (1分) 1 min (1分)
(2)D>C>B>A (1分) 随着反应的进行,浓度减小,反应速率减慢 (1分)
(3)0.107 mol·L1(2分) (4)0.083%(2分)
解析:(3)根据H2O2分解的方程式,由生成的O2的物质的量可计算出H2O2的物质的量,由溶液的体积便可得:c(H2O2)==0.107 mol·L1
(4)由图知,2min后可生成15mLO2,是生成的O2总量的,则剩余的Na2O2的物质的量是Na2O2总量的,n(H2O2)(余)==1.34×103 mol,
m (H2O2)(余)=1.34×103 mol×34 g·mol1=4.55×102 g
w(H2O2)==×100%=0.083%
知识点提示 化学反应速率的概念,反应速率的表示方法,外界条件(浓度、温度、压强、催化剂等)对反应速率的影响。
20.解:n(Na)=0.500 mol (1分)
钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N。 (1分)
n(O2)==0.0100 mol (1分)
2Na2O2+2H2O4NaOH+O2↑
0.0200 mol 0.0100 mol
n(Na2O2)=0.0200mol (1分)
Na→NaOH,由Na守恒知
c(NaOH)=0.500mo1·L1,25 mL溶液中n(NaOH)=1.25×102mol
n(HCl)=1.35×102mol>n(NaOH),说明溶液中还有氨水。 (2分)
原l L溶液中n(NH3·H2O)=×(1.35×102一1.25×102) mo1=4.00×102mol
Na3N+4H2O3NaOH+NH3·H2O
4.00×102 mol 4.00×102mol
即:n(Na3N)=0.0400mo1 (2分)
n(Na2O)=(0.500 mo1一0.0400 mo1×3-0.020 mo1×2)/2=0.170 mo1 (2分)
知识点提示 钠及其化合物的性质,物质的量有关计算
同课章节目录
