高三化学模拟(四)[下学期]
图片预览

文档简介
高三化学模拟(四)
6、引起下列环境污染的原因不正确的是( C )
A 重金属、农药和难分解有机木物等会造成水体污染
B 装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C SO2、NO2或CO2都会导致酸雨的形成
D CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
7、聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好,不易老化、耐擦洗、色泽亮丽等优点。右边是聚丙烯酸酯的结构简式,它属于( C )。
①无机化合物 ②有机化合物
③人工合成高分子 ④离子化合物 ⑤共价化合物
A.①③④ B.①③⑤
C.②③⑤ D.②③④
8、利尿酸在奥运会上被禁用,其结构简式如图所示,下列叙述正确的为( A )
A、利尿酸衍生物利尿酸甲酯的分子式是C14H14CI2O4
B、利尿酸分子内处于同一平面的原子不超过10个
C、1mol利尿酸能与7molH2发生加成反应
D、利尿酸能与FeCI3溶液发生显色反应
9、 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是(C)
A. 1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023
B. Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1022
C. 32 g S8单质中含有的S—S键个数为6.02×1023
D. 22.4 L N2中所含的分子个数为6.02×1023
10、锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是 (BD)
A. 锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x
B. 电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C. 锂离子电池放电时电池内部Li+向负极移动
D. 锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-=C6Li
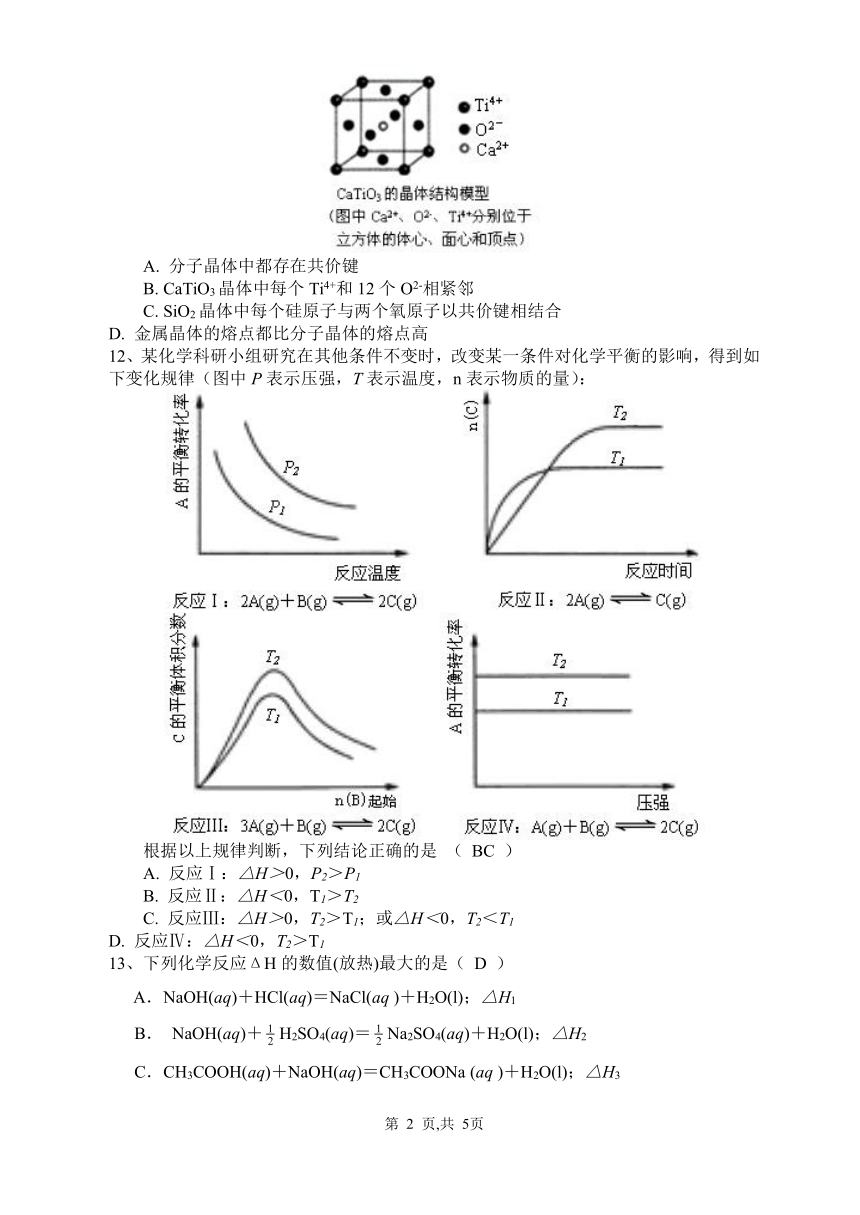
11、 下列关于晶体的说法一定正确的是( B )
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
12、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是 ( BC )
A. 反应Ⅰ:△H>0,P2>P1
B. 反应Ⅱ:△H<0,T1>T2
C. 反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D. 反应Ⅳ:△H<0,T2>T1
13、下列化学反应ΔH的数值(放热)最大的是( D )
A.NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1
B. NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l);△H2
C.CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3
D.NaOH(aq)+H2SO4(浓)=Na2SO4(aq)+H2O(l);△H4
26、(14分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH较难控制,可改用____________________。
26、(14分)
(1)烧杯 漏斗
(2)除去铁等不溶于碱的杂质
(3)取上层清夜,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全
(4)通入足量的CO2气体
27、(16分)香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
提示:
①CH3CH=CHCH2CH3CH3COOH+CH3CH2COOH
②R-CH=CH2R-CH2-CH2-Br
请回答下列问题:
⑴写出化合物C的结构简式_______________。
⑵化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有_______________种。
⑶在上述转化过程中,反应步骤B→C的目的是_______________。
⑷请设计合理方案从合成(用反应流程图表示,并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为
27、 (16分)
(1)
(2)9种
(3)保护酚羟基,使之不被氧化
(4)
28、(12分)如下图所示,各物质间存在如下相互转化关系,其中F为常见的金属,高温下与某些金属氧化物反应,是工业冶炼金属的方法之一。A为无色气体,B为淡黄色固体,C为无色液体。E和K为无色气体单质,其它物质均为化合物。
试回答下列问题:
⑴写出下列物质的化学式:A:_____F:____
⑵写出B的电子式_____;A属于_____(填“极性”或“非极性”)分子。
⑶写出J→L的离子反应方程式_________________。
28、⑴CO2 (3分) Al(3分)
⑵(3分) 非极性(3分)
⑶AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(3分)或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
29、(18分)(Ⅰ)现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1,M2,M3,并依次增加14。经分析,相对分子质量为M2的酯,其氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。请回答:
⑴相对分子质量为M2的酯的化学式为______。
⑵饱和一元羧酸的化学式分别为______,_______。
⑶参加反应的醇结构简式为_____、_____、_____、______(不必填满)。
⑷与相对分子质量为M1的酯互为同分异构体,能发生银镜反应、能与金属钠反应产生氢气的有机物的同分异构体有_____种。
(Ⅱ) (4分)在相同温度下,物质的量浓度相同的下列五种溶液:
①;②;③;
④;⑤
按由大到小的排列顺序是(填写序号)______________________。
29、(Ⅰ)⑴C5H10O2 2分) ⑵C2H4O2和C3H6O2(4分)
⑶CH3CH2CH2OH、CH3CH(OH)CH3、CH3CH2OH(6分)
⑷5种(2分)
L
+A
+A
+E
H
I
K
J
G
F
E
D
C
A
B
加热
PAGE
第 2 页,共 5页
6、引起下列环境污染的原因不正确的是( C )
A 重金属、农药和难分解有机木物等会造成水体污染
B 装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C SO2、NO2或CO2都会导致酸雨的形成
D CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
7、聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好,不易老化、耐擦洗、色泽亮丽等优点。右边是聚丙烯酸酯的结构简式,它属于( C )。
①无机化合物 ②有机化合物
③人工合成高分子 ④离子化合物 ⑤共价化合物
A.①③④ B.①③⑤
C.②③⑤ D.②③④
8、利尿酸在奥运会上被禁用,其结构简式如图所示,下列叙述正确的为( A )
A、利尿酸衍生物利尿酸甲酯的分子式是C14H14CI2O4
B、利尿酸分子内处于同一平面的原子不超过10个
C、1mol利尿酸能与7molH2发生加成反应
D、利尿酸能与FeCI3溶液发生显色反应
9、 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是(C)
A. 1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023
B. Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1022
C. 32 g S8单质中含有的S—S键个数为6.02×1023
D. 22.4 L N2中所含的分子个数为6.02×1023
10、锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是 (BD)
A. 锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x
B. 电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C. 锂离子电池放电时电池内部Li+向负极移动
D. 锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-=C6Li
11、 下列关于晶体的说法一定正确的是( B )
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
12、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是 ( BC )
A. 反应Ⅰ:△H>0,P2>P1
B. 反应Ⅱ:△H<0,T1>T2
C. 反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D. 反应Ⅳ:△H<0,T2>T1
13、下列化学反应ΔH的数值(放热)最大的是( D )
A.NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1
B. NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l);△H2
C.CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3
D.NaOH(aq)+H2SO4(浓)=Na2SO4(aq)+H2O(l);△H4
26、(14分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH较难控制,可改用____________________。
26、(14分)
(1)烧杯 漏斗
(2)除去铁等不溶于碱的杂质
(3)取上层清夜,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全
(4)通入足量的CO2气体
27、(16分)香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
提示:
①CH3CH=CHCH2CH3CH3COOH+CH3CH2COOH
②R-CH=CH2R-CH2-CH2-Br
请回答下列问题:
⑴写出化合物C的结构简式_______________。
⑵化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有_______________种。
⑶在上述转化过程中,反应步骤B→C的目的是_______________。
⑷请设计合理方案从合成(用反应流程图表示,并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为
27、 (16分)
(1)
(2)9种
(3)保护酚羟基,使之不被氧化
(4)
28、(12分)如下图所示,各物质间存在如下相互转化关系,其中F为常见的金属,高温下与某些金属氧化物反应,是工业冶炼金属的方法之一。A为无色气体,B为淡黄色固体,C为无色液体。E和K为无色气体单质,其它物质均为化合物。
试回答下列问题:
⑴写出下列物质的化学式:A:_____F:____
⑵写出B的电子式_____;A属于_____(填“极性”或“非极性”)分子。
⑶写出J→L的离子反应方程式_________________。
28、⑴CO2 (3分) Al(3分)
⑵(3分) 非极性(3分)
⑶AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(3分)或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
29、(18分)(Ⅰ)现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1,M2,M3,并依次增加14。经分析,相对分子质量为M2的酯,其氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。请回答:
⑴相对分子质量为M2的酯的化学式为______。
⑵饱和一元羧酸的化学式分别为______,_______。
⑶参加反应的醇结构简式为_____、_____、_____、______(不必填满)。
⑷与相对分子质量为M1的酯互为同分异构体,能发生银镜反应、能与金属钠反应产生氢气的有机物的同分异构体有_____种。
(Ⅱ) (4分)在相同温度下,物质的量浓度相同的下列五种溶液:
①;②;③;
④;⑤
按由大到小的排列顺序是(填写序号)______________________。
29、(Ⅰ)⑴C5H10O2 2分) ⑵C2H4O2和C3H6O2(4分)
⑶CH3CH2CH2OH、CH3CH(OH)CH3、CH3CH2OH(6分)
⑷5种(2分)
L
+A
+A
+E
H
I
K
J
G
F
E
D
C
A
B
加热
PAGE
第 2 页,共 5页
同课章节目录
