无锡市第三高级中学2007年4月高一化学期中考试试卷[下学期]
文档属性
| 名称 | 无锡市第三高级中学2007年4月高一化学期中考试试卷[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 206.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-05-07 09:20:00 | ||
图片预览


文档简介
无锡市第三高级中学高一化学期中考试试卷
可能用到的相对原子质量: H-1 O-16 Cl-35.5 Ca-40
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
1.下列各项中表达正确的是
A.NH3分子的电子式: B.CH4分子的比例模型
C.O原子的结构示意图: D.N2的结构式: N≡N
2.经过分析发现,某星体陨石中含有半衰期极短的镁的一种放射性同位素Mg,该同位素的原子核内的中子数是
A.12 B.14 C.16 D.18
3.决定主族元素在元素周期表中位置的是
A.电子层数和最外层电子数 B.次外层电子数
C.原子核内中子数 D.原子的相对原子质量
4.下列各物质汽化或熔化时,所克服的粒子间的作用力属于同种类型的是
A.碘和干冰的升华 B.氯化氨受热汽化和乙醇受热汽化
C.氯化钠和铁的熔化 D.二氧化硅和生石灰的熔化
5.下列各组物质的性质顺序,错误的是
A.酸性强弱:H2SiO4<H2CO3<H2SO4 B.热稳定性:HCl>HBr>HI
C.原子半径:Na<Mg<Al D.熔点:SiO2>NaCl>CO2
6.关于化学反应热效应的叙述中,正确的是
A.放热反应在常温下就一定很容易发生
B.放热反应中反应物的总能量大于生成物的总能量
C.化学反应中只伴随热量的变化
D.凡是需加热方能进行的反应—定是吸热反应
7.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法错误的是
A.Ds原子的电子层数为7 B.Ds是过渡元素
C.Ds原子的质量数为110 D.Ds为金属元素
8.可逆反应2A(g)+3B(g)2C(g)+D(g) 在四种不同条件下的反应速率分别为:
①υ(A)=0.5 mol·(L·min) ━1 ②υ(B)=0.6 mol·(L·min) ━1
③υ(C)=0.35 mol·(L·min) ━1 ④υ(D)=0.4 mol·(L·min) ━1
该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
9.短周期元素离子A2╋、B╋、C3━、D━都具有相同电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 D>C>B>A
C.离子半径 C>D>B>A D.最外层电子数 D>C>A>B
10.①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数就是质量数 上述说法中错误的是
A.①②④ B.③④ C.②③⑤⑥ D.①②⑤⑥
11.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)2Z(g) 能说明此反应已达到化学平衡的是
A.容器内气体质量不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内同时存在X、Y、Z
D.单位时间消耗0.1mol X同时消耗0.2mol Z
12.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式最可能表示为
A.B3A2 B.BA2 C.A3B2 D.AB2
13.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
14.下列叙述错误的是
A.钠、氯原子作用生成NaCl后,稳定性增强
B.在NaCl中,除Cl━ 和Na╋ 的静电吸引作用外,还存在电子之间、原子核之间的排斥作用
C.任何离子键,在形成过程中,必须有电子得失
D.由分子构成的物质中一定存在共价键
15.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.b、a、d、c C.d、b、a、c D.d、a、b、c
16.下列反应中生成H2的速率最快的是
金属
酸溶液
温度
A
Mg
6mol·L━1HNO3
20℃
B
Fe
1 mol·L━1HCl
20℃
C
Mg
1 mol·L━1HCl
20℃
D
Mg
0.5 mol·L━1H2SO4
30℃
17.目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na╋导电的β-Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx
以下说法正确的是
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生氧化反应
C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D.充电时,阴极发生的反应是 2Na╋+2e━=2Na
18.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=—890 kJ·mol━1。当一定量的CH4(g)完全燃烧生成CO2(g)和H2O(1)所放出的热量为89 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)
A.2.24 L B.4.48 L C.11.2 L D.22.4 L
无锡市第三高级中学高一化学期中考试试卷答卷
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
题号
15
16
17
18
答案
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共17分)
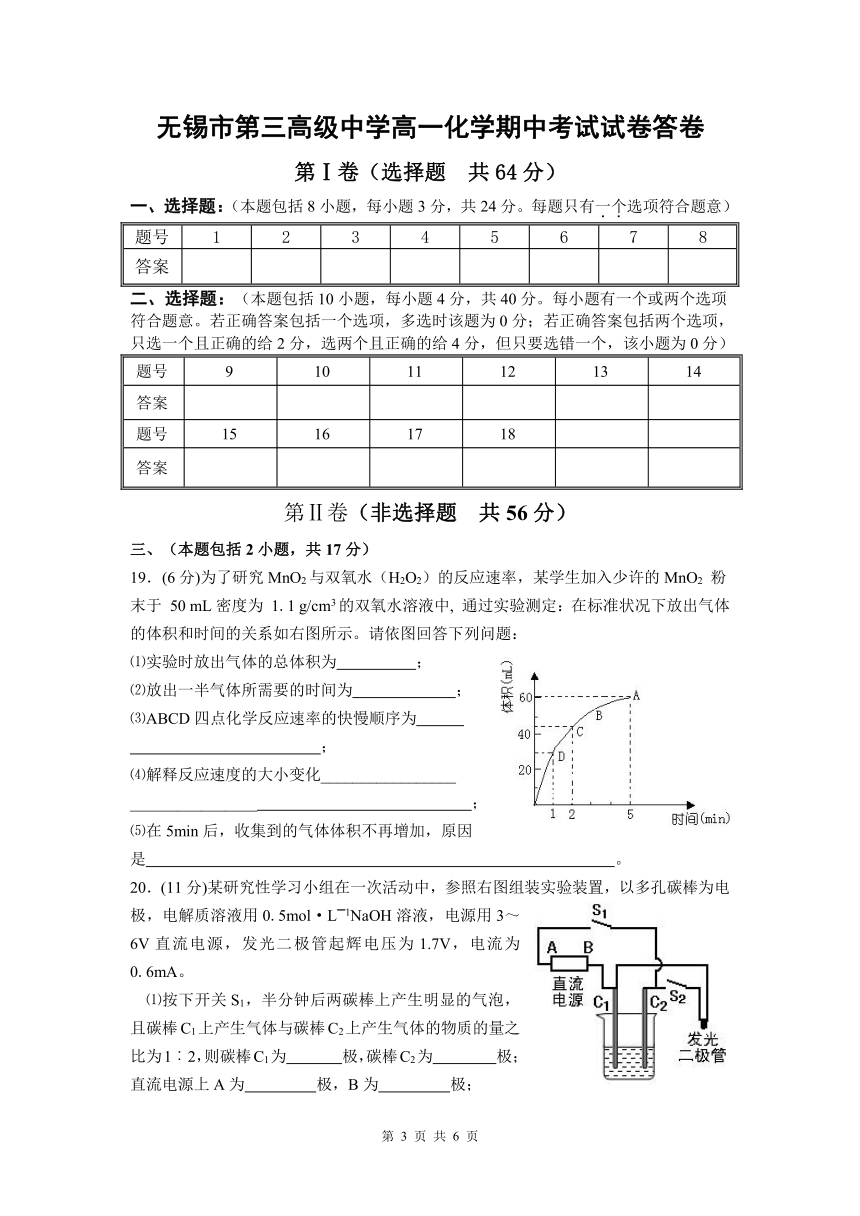
19.(6分)为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50 mL密度为 1.1 g/cm3的双氧水溶液中, 通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题:
⑴实验时放出气体的总体积为 ;
⑵放出一半气体所需要的时间为 ;
⑶ABCD四点化学反应速率的快慢顺序为
;
⑷解释反应速度的大小变化_________________
________________ ;
⑸在5min后,收集到的气体体积不再增加,原因是 。
20.(11分)某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol·L━1NaOH溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA。
⑴按下开关S1,半分钟后两碳棒上产生明显的气泡,且碳棒C1上产生气体与碳棒C2上产生气体的物质的量之比为1︰2,则碳棒C1为 极,碳棒C2为 极;直流电源上A为 极,B为 极;
⑵断开开关S1,按下开关S2,可观察到的明显现象为 ;碳棒C1为 极,电极反应式为 ;碳棒C2为 极,电极反应式为 。
四、(本题包括4小题,共27分)
21.(6分) 下图是元素周期表的框架图,请根据下面提问回答:
⑴在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
⑵在原子序数为1─18号元素中,请用化学式填写,与水反应最剧烈的金属元素是
;元素的气态氢化物最稳定是物质是 ;元素的最高价氧化物对应水化物酸性最强的物质是 ;密度最小的气体单质是 ;第三周期中,除稀有气体元素外,原子半径最小的元素的原子是 。
22.(8分) 如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
⑴其中代表金刚石的是(填编号字母,下同) ,金刚石属于 晶体。
⑵其中代表石墨的是 ,其晶体中碳原子呈 结构排列。
⑶其中代表NaCl的是 ,晶体中Na╋与Cl━ 之间通过 键结合起来。
⑷代表干冰的是 , CO2分子间通过 结合起来。
23.(6分)化合物A是一种不稳定的物质,它的分子组成可用OxFy来表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
⑴A的化学式是 ;
⑵已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,结构式是 。
24.(7分)有A、B、C、D、E五种元素,其原子序数大小关系为A>B>C>D>E,A、C同主族。已知将0.5mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子,当A的单质同盐酸充分反应放出0.02 g氢气时,用去0.4 gA单质。B元素原子的核外电子层数和C相同,且原子半径是同周期中最小的。D元素原子的最外层电子数是次外层电子数的3倍,E可与B、D两元素分别形成化合物EB4、ED2。试回答:
⑴C元素是 (写元素符号),在元素周期表中的位置
⑵写出EB4、ED2的电子式 、
⑶A与B的单质可反应生成化合物 (写化学式),用电子表示该化合物的形成过程 。
五、(本题包括2小题,共12分)
25.(6分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量/kJ
243
193
151
432
366
298
436
根据上述数据回答(1)~(3)题。
⑴下列氢化物中最稳定的是 ;
A.HCI B.HBr C.HI D.HF
⑵X2+H2=2HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应;
⑶相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 ;
⑷写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:
。
26.(6分) 某原子X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
⑴Z值和A值;
⑵X元素在周期表中的位置。
无锡市第三高级中学高一化学期中考试试卷答案
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
D
C
A
A
C
B
C
D
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
CD
D
BD
B
A
CD
题号
15
16
17
18
答案
D
D
BD
D
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共18分)
19.⑴60mL; ⑵1 min; ⑶D>C>B>A; ⑷随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小 ⑸此时双氧水已完全分解
20.⑴阳 阴 负 正
⑵发光二极管变亮 正 O2+4e━+2H2O=4OH━ 负 2H2-4e━+4OH━=4 H2O
四、(本题包括4小题,共23分)
21.⑴ b ⑵ Na HF HClO4 H2 ⑶ Cl
22.⑴ B 原子 ⑵ D 层状 ⑶ A 离子 ⑷ C 分子间作用力
23.⑴ O3F2 ⑵F—O—O—O—F
24.⑴Mg 第3周期第ⅡA族 ⑵
⑶ CaCl2
五、(本题包括2小题,共15分)
25.⑴ D ⑵ 吸热 ⑶Cl2
⑷ H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol━1
26.⑴Z=19 A=39 ⑵第4周期第ⅠA族
无锡市第三高级中学高一化学期中考试试卷
可能用到的相对原子质量: H-1 O-16 Cl-35.5 Ca-40
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
1.下列各项中表达正确的是
A.NH3分子的电子式: B.CH4分子的比例模型
C.O原子的结构示意图: D.N2的结构式: N≡N
2.经过分析发现,某星体陨石中含有半衰期极短的镁的一种放射性同位素Mg,该同位素的原子核内的中子数是
A.12 B.14 C.16 D.18
3.决定主族元素在元素周期表中位置的是
A.电子层数和最外层电子数 B.次外层电子数
C.原子核内中子数 D.原子的相对原子质量
4.下列各物质汽化或熔化时,所克服的粒子间的作用力属于同种类型的是
A.碘和干冰的升华 B.氯化氨受热汽化和乙醇受热汽化
C.氯化钠和铁的熔化 D.二氧化硅和生石灰的熔化
5.下列各组物质的性质顺序,错误的是
A.酸性强弱:H2SiO4<H2CO3<H2SO4 B.热稳定性:HCl>HBr>HI
C.原子半径:Na<Mg<Al D.熔点:SiO2>NaCl>CO2
6.关于化学反应热效应的叙述中,正确的是
A.放热反应在常温下就一定很容易发生
B.放热反应中反应物的总能量大于生成物的总能量
C.化学反应中只伴随热量的变化
D.凡是需加热方能进行的反应—定是吸热反应
7.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法错误的是
A.Ds原子的电子层数为7 B.Ds是过渡元素
C.Ds原子的质量数为110 D.Ds为金属元素
8.可逆反应2A(g)+3B(g)2C(g)+D(g) 在四种不同条件下的反应速率分别为:
①υ(A)=0.5 mol·(L·min) ━1 ②υ(B)=0.6 mol·(L·min) ━1
③υ(C)=0.35 mol·(L·min) ━1 ④υ(D)=0.4 mol·(L·min) ━1
该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
9.短周期元素离子A2╋、B╋、C3━、D━都具有相同电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 D>C>B>A
C.离子半径 C>D>B>A D.最外层电子数 D>C>A>B
10.①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数就是质量数 上述说法中错误的是
A.①②④ B.③④ C.②③⑤⑥ D.①②⑤⑥
11.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)2Z(g) 能说明此反应已达到化学平衡的是
A.容器内气体质量不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内同时存在X、Y、Z
D.单位时间消耗0.1mol X同时消耗0.2mol Z
12.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式最可能表示为
A.B3A2 B.BA2 C.A3B2 D.AB2
13.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
14.下列叙述错误的是
A.钠、氯原子作用生成NaCl后,稳定性增强
B.在NaCl中,除Cl━ 和Na╋ 的静电吸引作用外,还存在电子之间、原子核之间的排斥作用
C.任何离子键,在形成过程中,必须有电子得失
D.由分子构成的物质中一定存在共价键
15.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.b、a、d、c C.d、b、a、c D.d、a、b、c
16.下列反应中生成H2的速率最快的是
金属
酸溶液
温度
A
Mg
6mol·L━1HNO3
20℃
B
Fe
1 mol·L━1HCl
20℃
C
Mg
1 mol·L━1HCl
20℃
D
Mg
0.5 mol·L━1H2SO4
30℃
17.目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na╋导电的β-Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx
以下说法正确的是
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生氧化反应
C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D.充电时,阴极发生的反应是 2Na╋+2e━=2Na
18.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=—890 kJ·mol━1。当一定量的CH4(g)完全燃烧生成CO2(g)和H2O(1)所放出的热量为89 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)
A.2.24 L B.4.48 L C.11.2 L D.22.4 L
无锡市第三高级中学高一化学期中考试试卷答卷
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
题号
15
16
17
18
答案
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共17分)
19.(6分)为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50 mL密度为 1.1 g/cm3的双氧水溶液中, 通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题:
⑴实验时放出气体的总体积为 ;
⑵放出一半气体所需要的时间为 ;
⑶ABCD四点化学反应速率的快慢顺序为
;
⑷解释反应速度的大小变化_________________
________________ ;
⑸在5min后,收集到的气体体积不再增加,原因是 。
20.(11分)某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol·L━1NaOH溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA。
⑴按下开关S1,半分钟后两碳棒上产生明显的气泡,且碳棒C1上产生气体与碳棒C2上产生气体的物质的量之比为1︰2,则碳棒C1为 极,碳棒C2为 极;直流电源上A为 极,B为 极;
⑵断开开关S1,按下开关S2,可观察到的明显现象为 ;碳棒C1为 极,电极反应式为 ;碳棒C2为 极,电极反应式为 。
四、(本题包括4小题,共27分)
21.(6分) 下图是元素周期表的框架图,请根据下面提问回答:
⑴在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
⑵在原子序数为1─18号元素中,请用化学式填写,与水反应最剧烈的金属元素是
;元素的气态氢化物最稳定是物质是 ;元素的最高价氧化物对应水化物酸性最强的物质是 ;密度最小的气体单质是 ;第三周期中,除稀有气体元素外,原子半径最小的元素的原子是 。
22.(8分) 如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
⑴其中代表金刚石的是(填编号字母,下同) ,金刚石属于 晶体。
⑵其中代表石墨的是 ,其晶体中碳原子呈 结构排列。
⑶其中代表NaCl的是 ,晶体中Na╋与Cl━ 之间通过 键结合起来。
⑷代表干冰的是 , CO2分子间通过 结合起来。
23.(6分)化合物A是一种不稳定的物质,它的分子组成可用OxFy来表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
⑴A的化学式是 ;
⑵已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,结构式是 。
24.(7分)有A、B、C、D、E五种元素,其原子序数大小关系为A>B>C>D>E,A、C同主族。已知将0.5mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子,当A的单质同盐酸充分反应放出0.02 g氢气时,用去0.4 gA单质。B元素原子的核外电子层数和C相同,且原子半径是同周期中最小的。D元素原子的最外层电子数是次外层电子数的3倍,E可与B、D两元素分别形成化合物EB4、ED2。试回答:
⑴C元素是 (写元素符号),在元素周期表中的位置
⑵写出EB4、ED2的电子式 、
⑶A与B的单质可反应生成化合物 (写化学式),用电子表示该化合物的形成过程 。
五、(本题包括2小题,共12分)
25.(6分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量/kJ
243
193
151
432
366
298
436
根据上述数据回答(1)~(3)题。
⑴下列氢化物中最稳定的是 ;
A.HCI B.HBr C.HI D.HF
⑵X2+H2=2HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应;
⑶相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 ;
⑷写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:
。
26.(6分) 某原子X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
⑴Z值和A值;
⑵X元素在周期表中的位置。
无锡市第三高级中学高一化学期中考试试卷答案
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
D
C
A
A
C
B
C
D
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
CD
D
BD
B
A
CD
题号
15
16
17
18
答案
D
D
BD
D
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共18分)
19.⑴60mL; ⑵1 min; ⑶D>C>B>A; ⑷随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小 ⑸此时双氧水已完全分解
20.⑴阳 阴 负 正
⑵发光二极管变亮 正 O2+4e━+2H2O=4OH━ 负 2H2-4e━+4OH━=4 H2O
四、(本题包括4小题,共23分)
21.⑴ b ⑵ Na HF HClO4 H2 ⑶ Cl
22.⑴ B 原子 ⑵ D 层状 ⑶ A 离子 ⑷ C 分子间作用力
23.⑴ O3F2 ⑵F—O—O—O—F
24.⑴Mg 第3周期第ⅡA族 ⑵
⑶ CaCl2
五、(本题包括2小题,共15分)
25.⑴ D ⑵ 吸热 ⑶Cl2
⑷ H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol━1
26.⑴Z=19 A=39 ⑵第4周期第ⅠA族
可能用到的相对原子质量: H-1 O-16 Cl-35.5 Ca-40
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
1.下列各项中表达正确的是
A.NH3分子的电子式: B.CH4分子的比例模型
C.O原子的结构示意图: D.N2的结构式: N≡N
2.经过分析发现,某星体陨石中含有半衰期极短的镁的一种放射性同位素Mg,该同位素的原子核内的中子数是
A.12 B.14 C.16 D.18
3.决定主族元素在元素周期表中位置的是
A.电子层数和最外层电子数 B.次外层电子数
C.原子核内中子数 D.原子的相对原子质量
4.下列各物质汽化或熔化时,所克服的粒子间的作用力属于同种类型的是
A.碘和干冰的升华 B.氯化氨受热汽化和乙醇受热汽化
C.氯化钠和铁的熔化 D.二氧化硅和生石灰的熔化
5.下列各组物质的性质顺序,错误的是
A.酸性强弱:H2SiO4<H2CO3<H2SO4 B.热稳定性:HCl>HBr>HI
C.原子半径:Na<Mg<Al D.熔点:SiO2>NaCl>CO2
6.关于化学反应热效应的叙述中,正确的是
A.放热反应在常温下就一定很容易发生
B.放热反应中反应物的总能量大于生成物的总能量
C.化学反应中只伴随热量的变化
D.凡是需加热方能进行的反应—定是吸热反应
7.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法错误的是
A.Ds原子的电子层数为7 B.Ds是过渡元素
C.Ds原子的质量数为110 D.Ds为金属元素
8.可逆反应2A(g)+3B(g)2C(g)+D(g) 在四种不同条件下的反应速率分别为:
①υ(A)=0.5 mol·(L·min) ━1 ②υ(B)=0.6 mol·(L·min) ━1
③υ(C)=0.35 mol·(L·min) ━1 ④υ(D)=0.4 mol·(L·min) ━1
该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
9.短周期元素离子A2╋、B╋、C3━、D━都具有相同电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 D>C>B>A
C.离子半径 C>D>B>A D.最外层电子数 D>C>A>B
10.①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数就是质量数 上述说法中错误的是
A.①②④ B.③④ C.②③⑤⑥ D.①②⑤⑥
11.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)2Z(g) 能说明此反应已达到化学平衡的是
A.容器内气体质量不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内同时存在X、Y、Z
D.单位时间消耗0.1mol X同时消耗0.2mol Z
12.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式最可能表示为
A.B3A2 B.BA2 C.A3B2 D.AB2
13.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
14.下列叙述错误的是
A.钠、氯原子作用生成NaCl后,稳定性增强
B.在NaCl中,除Cl━ 和Na╋ 的静电吸引作用外,还存在电子之间、原子核之间的排斥作用
C.任何离子键,在形成过程中,必须有电子得失
D.由分子构成的物质中一定存在共价键
15.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.b、a、d、c C.d、b、a、c D.d、a、b、c
16.下列反应中生成H2的速率最快的是
金属
酸溶液
温度
A
Mg
6mol·L━1HNO3
20℃
B
Fe
1 mol·L━1HCl
20℃
C
Mg
1 mol·L━1HCl
20℃
D
Mg
0.5 mol·L━1H2SO4
30℃
17.目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na╋导电的β-Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx
以下说法正确的是
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生氧化反应
C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D.充电时,阴极发生的反应是 2Na╋+2e━=2Na
18.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=—890 kJ·mol━1。当一定量的CH4(g)完全燃烧生成CO2(g)和H2O(1)所放出的热量为89 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)
A.2.24 L B.4.48 L C.11.2 L D.22.4 L
无锡市第三高级中学高一化学期中考试试卷答卷
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
题号
15
16
17
18
答案
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共17分)
19.(6分)为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50 mL密度为 1.1 g/cm3的双氧水溶液中, 通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题:
⑴实验时放出气体的总体积为 ;
⑵放出一半气体所需要的时间为 ;
⑶ABCD四点化学反应速率的快慢顺序为
;
⑷解释反应速度的大小变化_________________
________________ ;
⑸在5min后,收集到的气体体积不再增加,原因是 。
20.(11分)某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol·L━1NaOH溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA。
⑴按下开关S1,半分钟后两碳棒上产生明显的气泡,且碳棒C1上产生气体与碳棒C2上产生气体的物质的量之比为1︰2,则碳棒C1为 极,碳棒C2为 极;直流电源上A为 极,B为 极;
⑵断开开关S1,按下开关S2,可观察到的明显现象为 ;碳棒C1为 极,电极反应式为 ;碳棒C2为 极,电极反应式为 。
四、(本题包括4小题,共27分)
21.(6分) 下图是元素周期表的框架图,请根据下面提问回答:
⑴在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
⑵在原子序数为1─18号元素中,请用化学式填写,与水反应最剧烈的金属元素是
;元素的气态氢化物最稳定是物质是 ;元素的最高价氧化物对应水化物酸性最强的物质是 ;密度最小的气体单质是 ;第三周期中,除稀有气体元素外,原子半径最小的元素的原子是 。
22.(8分) 如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
⑴其中代表金刚石的是(填编号字母,下同) ,金刚石属于 晶体。
⑵其中代表石墨的是 ,其晶体中碳原子呈 结构排列。
⑶其中代表NaCl的是 ,晶体中Na╋与Cl━ 之间通过 键结合起来。
⑷代表干冰的是 , CO2分子间通过 结合起来。
23.(6分)化合物A是一种不稳定的物质,它的分子组成可用OxFy来表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
⑴A的化学式是 ;
⑵已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,结构式是 。
24.(7分)有A、B、C、D、E五种元素,其原子序数大小关系为A>B>C>D>E,A、C同主族。已知将0.5mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子,当A的单质同盐酸充分反应放出0.02 g氢气时,用去0.4 gA单质。B元素原子的核外电子层数和C相同,且原子半径是同周期中最小的。D元素原子的最外层电子数是次外层电子数的3倍,E可与B、D两元素分别形成化合物EB4、ED2。试回答:
⑴C元素是 (写元素符号),在元素周期表中的位置
⑵写出EB4、ED2的电子式 、
⑶A与B的单质可反应生成化合物 (写化学式),用电子表示该化合物的形成过程 。
五、(本题包括2小题,共12分)
25.(6分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量/kJ
243
193
151
432
366
298
436
根据上述数据回答(1)~(3)题。
⑴下列氢化物中最稳定的是 ;
A.HCI B.HBr C.HI D.HF
⑵X2+H2=2HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应;
⑶相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 ;
⑷写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:
。
26.(6分) 某原子X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
⑴Z值和A值;
⑵X元素在周期表中的位置。
无锡市第三高级中学高一化学期中考试试卷答案
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
D
C
A
A
C
B
C
D
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
CD
D
BD
B
A
CD
题号
15
16
17
18
答案
D
D
BD
D
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共18分)
19.⑴60mL; ⑵1 min; ⑶D>C>B>A; ⑷随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小 ⑸此时双氧水已完全分解
20.⑴阳 阴 负 正
⑵发光二极管变亮 正 O2+4e━+2H2O=4OH━ 负 2H2-4e━+4OH━=4 H2O
四、(本题包括4小题,共23分)
21.⑴ b ⑵ Na HF HClO4 H2 ⑶ Cl
22.⑴ B 原子 ⑵ D 层状 ⑶ A 离子 ⑷ C 分子间作用力
23.⑴ O3F2 ⑵F—O—O—O—F
24.⑴Mg 第3周期第ⅡA族 ⑵
⑶ CaCl2
五、(本题包括2小题,共15分)
25.⑴ D ⑵ 吸热 ⑶Cl2
⑷ H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol━1
26.⑴Z=19 A=39 ⑵第4周期第ⅠA族
无锡市第三高级中学高一化学期中考试试卷
可能用到的相对原子质量: H-1 O-16 Cl-35.5 Ca-40
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
1.下列各项中表达正确的是
A.NH3分子的电子式: B.CH4分子的比例模型
C.O原子的结构示意图: D.N2的结构式: N≡N
2.经过分析发现,某星体陨石中含有半衰期极短的镁的一种放射性同位素Mg,该同位素的原子核内的中子数是
A.12 B.14 C.16 D.18
3.决定主族元素在元素周期表中位置的是
A.电子层数和最外层电子数 B.次外层电子数
C.原子核内中子数 D.原子的相对原子质量
4.下列各物质汽化或熔化时,所克服的粒子间的作用力属于同种类型的是
A.碘和干冰的升华 B.氯化氨受热汽化和乙醇受热汽化
C.氯化钠和铁的熔化 D.二氧化硅和生石灰的熔化
5.下列各组物质的性质顺序,错误的是
A.酸性强弱:H2SiO4<H2CO3<H2SO4 B.热稳定性:HCl>HBr>HI
C.原子半径:Na<Mg<Al D.熔点:SiO2>NaCl>CO2
6.关于化学反应热效应的叙述中,正确的是
A.放热反应在常温下就一定很容易发生
B.放热反应中反应物的总能量大于生成物的总能量
C.化学反应中只伴随热量的变化
D.凡是需加热方能进行的反应—定是吸热反应
7.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法错误的是
A.Ds原子的电子层数为7 B.Ds是过渡元素
C.Ds原子的质量数为110 D.Ds为金属元素
8.可逆反应2A(g)+3B(g)2C(g)+D(g) 在四种不同条件下的反应速率分别为:
①υ(A)=0.5 mol·(L·min) ━1 ②υ(B)=0.6 mol·(L·min) ━1
③υ(C)=0.35 mol·(L·min) ━1 ④υ(D)=0.4 mol·(L·min) ━1
该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
9.短周期元素离子A2╋、B╋、C3━、D━都具有相同电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 D>C>B>A
C.离子半径 C>D>B>A D.最外层电子数 D>C>A>B
10.①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数就是质量数 上述说法中错误的是
A.①②④ B.③④ C.②③⑤⑥ D.①②⑤⑥
11.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)2Z(g) 能说明此反应已达到化学平衡的是
A.容器内气体质量不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内同时存在X、Y、Z
D.单位时间消耗0.1mol X同时消耗0.2mol Z
12.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式最可能表示为
A.B3A2 B.BA2 C.A3B2 D.AB2
13.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
14.下列叙述错误的是
A.钠、氯原子作用生成NaCl后,稳定性增强
B.在NaCl中,除Cl━ 和Na╋ 的静电吸引作用外,还存在电子之间、原子核之间的排斥作用
C.任何离子键,在形成过程中,必须有电子得失
D.由分子构成的物质中一定存在共价键
15.有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.b、a、d、c C.d、b、a、c D.d、a、b、c
16.下列反应中生成H2的速率最快的是
金属
酸溶液
温度
A
Mg
6mol·L━1HNO3
20℃
B
Fe
1 mol·L━1HCl
20℃
C
Mg
1 mol·L━1HCl
20℃
D
Mg
0.5 mol·L━1H2SO4
30℃
17.目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na╋导电的β-Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx
以下说法正确的是
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生氧化反应
C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D.充电时,阴极发生的反应是 2Na╋+2e━=2Na
18.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=—890 kJ·mol━1。当一定量的CH4(g)完全燃烧生成CO2(g)和H2O(1)所放出的热量为89 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)
A.2.24 L B.4.48 L C.11.2 L D.22.4 L
无锡市第三高级中学高一化学期中考试试卷答卷
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
题号
15
16
17
18
答案
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共17分)
19.(6分)为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于 50 mL密度为 1.1 g/cm3的双氧水溶液中, 通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题:
⑴实验时放出气体的总体积为 ;
⑵放出一半气体所需要的时间为 ;
⑶ABCD四点化学反应速率的快慢顺序为
;
⑷解释反应速度的大小变化_________________
________________ ;
⑸在5min后,收集到的气体体积不再增加,原因是 。
20.(11分)某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol·L━1NaOH溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA。
⑴按下开关S1,半分钟后两碳棒上产生明显的气泡,且碳棒C1上产生气体与碳棒C2上产生气体的物质的量之比为1︰2,则碳棒C1为 极,碳棒C2为 极;直流电源上A为 极,B为 极;
⑵断开开关S1,按下开关S2,可观察到的明显现象为 ;碳棒C1为 极,电极反应式为 ;碳棒C2为 极,电极反应式为 。
四、(本题包括4小题,共27分)
21.(6分) 下图是元素周期表的框架图,请根据下面提问回答:
⑴在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
⑵在原子序数为1─18号元素中,请用化学式填写,与水反应最剧烈的金属元素是
;元素的气态氢化物最稳定是物质是 ;元素的最高价氧化物对应水化物酸性最强的物质是 ;密度最小的气体单质是 ;第三周期中,除稀有气体元素外,原子半径最小的元素的原子是 。
22.(8分) 如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
⑴其中代表金刚石的是(填编号字母,下同) ,金刚石属于 晶体。
⑵其中代表石墨的是 ,其晶体中碳原子呈 结构排列。
⑶其中代表NaCl的是 ,晶体中Na╋与Cl━ 之间通过 键结合起来。
⑷代表干冰的是 , CO2分子间通过 结合起来。
23.(6分)化合物A是一种不稳定的物质,它的分子组成可用OxFy来表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
⑴A的化学式是 ;
⑵已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,结构式是 。
24.(7分)有A、B、C、D、E五种元素,其原子序数大小关系为A>B>C>D>E,A、C同主族。已知将0.5mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子,当A的单质同盐酸充分反应放出0.02 g氢气时,用去0.4 gA单质。B元素原子的核外电子层数和C相同,且原子半径是同周期中最小的。D元素原子的最外层电子数是次外层电子数的3倍,E可与B、D两元素分别形成化合物EB4、ED2。试回答:
⑴C元素是 (写元素符号),在元素周期表中的位置
⑵写出EB4、ED2的电子式 、
⑶A与B的单质可反应生成化合物 (写化学式),用电子表示该化合物的形成过程 。
五、(本题包括2小题,共12分)
25.(6分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量/kJ
243
193
151
432
366
298
436
根据上述数据回答(1)~(3)题。
⑴下列氢化物中最稳定的是 ;
A.HCI B.HBr C.HI D.HF
⑵X2+H2=2HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应;
⑶相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 ;
⑷写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:
。
26.(6分) 某原子X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
⑴Z值和A值;
⑵X元素在周期表中的位置。
无锡市第三高级中学高一化学期中考试试卷答案
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
答案
D
C
A
A
C
B
C
D
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题为0分)
题号
9
10
11
12
13
14
答案
CD
D
BD
B
A
CD
题号
15
16
17
18
答案
D
D
BD
D
第Ⅱ卷(非选择题 共56分)
三、(本题包括2小题,共18分)
19.⑴60mL; ⑵1 min; ⑶D>C>B>A; ⑷随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小 ⑸此时双氧水已完全分解
20.⑴阳 阴 负 正
⑵发光二极管变亮 正 O2+4e━+2H2O=4OH━ 负 2H2-4e━+4OH━=4 H2O
四、(本题包括4小题,共23分)
21.⑴ b ⑵ Na HF HClO4 H2 ⑶ Cl
22.⑴ B 原子 ⑵ D 层状 ⑶ A 离子 ⑷ C 分子间作用力
23.⑴ O3F2 ⑵F—O—O—O—F
24.⑴Mg 第3周期第ⅡA族 ⑵
⑶ CaCl2
五、(本题包括2小题,共15分)
25.⑴ D ⑵ 吸热 ⑶Cl2
⑷ H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol━1
26.⑴Z=19 A=39 ⑵第4周期第ⅠA族
同课章节目录
