人教版高中化学选修四 4.2 化学电源 课件(26张)
文档属性
| 名称 | 人教版高中化学选修四 4.2 化学电源 课件(26张) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-01 00:00:00 | ||
图片预览







文档简介
课件26张PPT。第二章 化学反应与能量 第2节 化学能与电能 教学目标
1.掌握每一类典型电池的正负极、电极反应;
2.了解每一类电池的优缺点;
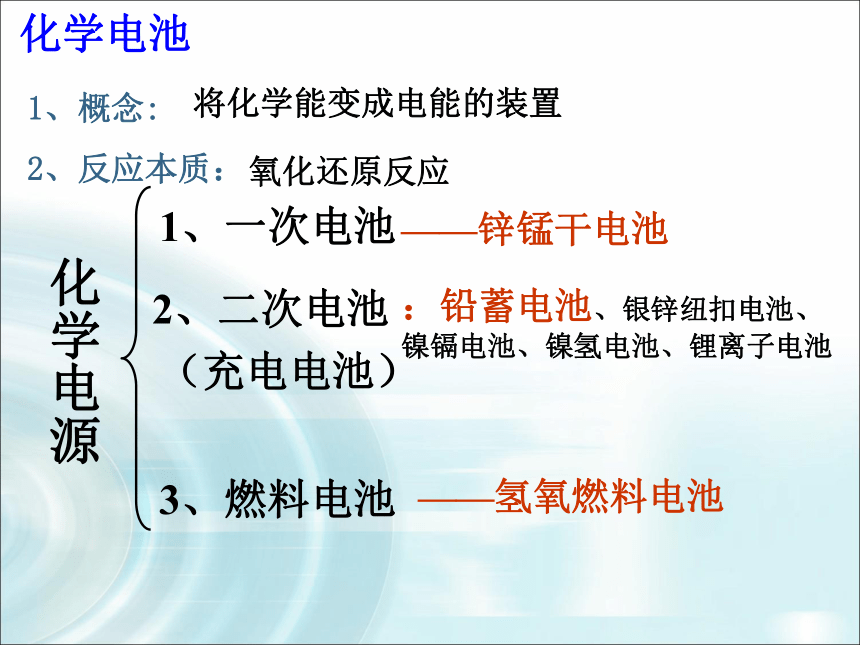
3.对其它电池有初步的认识,知道正负极。化学电源1、一次电池2、二次电池
3、燃料电池——锌锰干电池:铅蓄电池、银锌纽扣电池、
镍镉电池、镍氢电池、锂离子电池——氢氧燃料电池化学电池1、概念:
2、反应本质:将化学能变成电能的装置氧化还原反应(充电电池)负极(锌筒):Zn-2e-=Zn2+
正极(石墨):2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
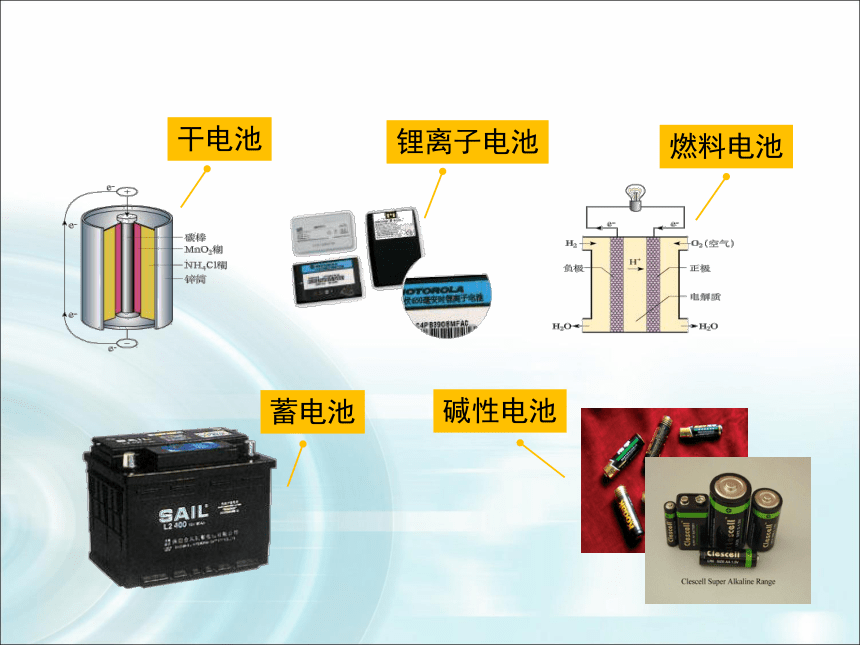
总反应:Zn+ 2MnO2+2NH4+=Zn2++ Mn2O3+2NH3+H2O干电池—— 普通锌锰干电池1、一次电池干电池构造示意优点:制作简单、价格便宜。
缺点:放电时间短,电压下降快。电解质:NH4Cl锌锰干电池即使不用,放置过久,也会失效(作为电解质的糊状NH4Cl显酸性),为了充分而有效地利用锌锰干电池,在购买、保存和使用方面你有何经验与建议?请与同学交流分享。碱性电池碱性锌锰干电池缺点:多数只能一次使用,不能充电;价格较贵优点:比能量和储存时间有所提高,适用于大电流和连
续放电1、一次电池MnO(OH)
氢氧化氧锰充电电池1、充电电池:氧化还原反应在充电时可以
逆向进行。2、充电电池又称二次电池,能够重复使用至一定
的周期。放电:原电池2、二次电池铅蓄电池电解液: 30%的H2SO4溶液电极反应式:Pb -2e- + SO42- =PbSO4PbO2 + 2e - + 4H+ + SO42- =PbSO4 +2H2O总电池反应:
PbO2 + Pb +2H2SO4= 2PbSO4↓+ 2H2O 拓展创新Ⅱ.铅蓄电池(二次电池)负极(Pb):正极(PbO2):铅蓄电池的充放电过程放电:原电池②镍镉电池
以 为负极, 为正极,以 为电解质
优点:寿命比铅蓄电池
缺点:镉是致癌物质,废弃镍镉电池如不回收,会严重污染环境;镍氢电池解决了这个问题。
③碱金属中的 是最轻的金属,活动性 ,是制造电池的理想物质。 电池是新一代可充电的绿色电池。CdNiO(OH)KOH长Li极强锂离子
氢氧化氧镍锂离子电池镍镉电池镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料( )Cd(OH)2+2Ni(OH)2放电充电A. CdAB. NiO(OH) D. Ni(OH)2C. Cd(OH)2正极: 2NiO(OH) +2e- +2H2O=2Ni(OH)2+2OH-负极: Cd - 2e- + 2OH-=Cd(OH)2 2.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的镉镍电池。氢镍电池的总反应式是
根据此反应式判断,下列叙述中正确的是
(A)电池放电时,电池负极周围溶液pH不断增大 (B)电池放电时,镍元素被氧化 (C)电池放电时,氢在负极反应C1.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为
Li + MnO2=LiMnO2,下列说法正确的是( )
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+BCd石墨棒KOHPbO2H2SO4NiO(OH)KOHPb锌筒锌粉石墨棒NH4Cl小结Ⅲ.燃料电池——高效、环境友好的化学电池它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等
(电极本身不参与反应) 燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。1.氢氧燃料电池
负极:
正极:
总反应:
2H2-4e-=4H+O2+2H2O+4e-==4OH-2H2 + O2 == 2H2O(1)中性介质酸性电解质(H2SO4)
负极(Pt):
正极(Pt):
电池总反应:
碱性电解质(KOH)
负极(Pt):
正极(Pt):
电池总反应:(1)氢氧燃料电池 2H2-4e-=4H+O2+4H++4e-=2H2O2H2+O2=2H2O2H2-4e-+4OH-=4H2OO2+2H2O+4e-=4OH-2H2+O2=2H2O 电解质溶液的酸碱性对电极反应的影响(有效地防止电解质溶液对外壳的腐蚀)使用氢氧燃料电池动力
的法国产标致TAXI
同济大学研制的燃料电池汽车-超越3号我国自主研发的燃料电池车神舟十号燃料电池发电系统例1:写出甲烷燃料电池(电解质溶液为稀硫酸溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 8H+ === 4H2O负极: CH4 -8e- + 2H2O === CO2 + 8H+总反应:CH4 + 2O2 === CO2 + 2H2O 正极: O2 + 4e- + 4H+ === 2H2O反应后溶液的pH如何变化?溶液稀释,PH值增加例2:写出甲烷燃料电池(电解质溶液为氢氧
化钾溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 4H2O === 8OH-负极: CH4 -8e + 10OH- === CO32- + 7H2O总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O 反应后溶液的pH如何变化?PH值降低正极: O2 + 4e- + 4H+ === 2H2O1、通入的气体在电极表面反应(燃料在负极反应,氧气在正极反应),电极本身不参与反应,电池只是作为一个反应器。
2、与其它电池区别:电极不参与反应,反应物不
是储存在电池内。
小结燃料电池:其他电池废电池对环境的危害电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严重的污染。上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。减少污染 节约资源废电池污染治理刻不容缓1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极B
1.掌握每一类典型电池的正负极、电极反应;
2.了解每一类电池的优缺点;
3.对其它电池有初步的认识,知道正负极。化学电源1、一次电池2、二次电池
3、燃料电池——锌锰干电池:铅蓄电池、银锌纽扣电池、
镍镉电池、镍氢电池、锂离子电池——氢氧燃料电池化学电池1、概念:
2、反应本质:将化学能变成电能的装置氧化还原反应(充电电池)负极(锌筒):Zn-2e-=Zn2+
正极(石墨):2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
总反应:Zn+ 2MnO2+2NH4+=Zn2++ Mn2O3+2NH3+H2O干电池—— 普通锌锰干电池1、一次电池干电池构造示意优点:制作简单、价格便宜。
缺点:放电时间短,电压下降快。电解质:NH4Cl锌锰干电池即使不用,放置过久,也会失效(作为电解质的糊状NH4Cl显酸性),为了充分而有效地利用锌锰干电池,在购买、保存和使用方面你有何经验与建议?请与同学交流分享。碱性电池碱性锌锰干电池缺点:多数只能一次使用,不能充电;价格较贵优点:比能量和储存时间有所提高,适用于大电流和连
续放电1、一次电池MnO(OH)
氢氧化氧锰充电电池1、充电电池:氧化还原反应在充电时可以
逆向进行。2、充电电池又称二次电池,能够重复使用至一定
的周期。放电:原电池2、二次电池铅蓄电池电解液: 30%的H2SO4溶液电极反应式:Pb -2e- + SO42- =PbSO4PbO2 + 2e - + 4H+ + SO42- =PbSO4 +2H2O总电池反应:
PbO2 + Pb +2H2SO4= 2PbSO4↓+ 2H2O 拓展创新Ⅱ.铅蓄电池(二次电池)负极(Pb):正极(PbO2):铅蓄电池的充放电过程放电:原电池②镍镉电池
以 为负极, 为正极,以 为电解质
优点:寿命比铅蓄电池
缺点:镉是致癌物质,废弃镍镉电池如不回收,会严重污染环境;镍氢电池解决了这个问题。
③碱金属中的 是最轻的金属,活动性 ,是制造电池的理想物质。 电池是新一代可充电的绿色电池。CdNiO(OH)KOH长Li极强锂离子
氢氧化氧镍锂离子电池镍镉电池镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料( )Cd(OH)2+2Ni(OH)2放电充电A. CdAB. NiO(OH) D. Ni(OH)2C. Cd(OH)2正极: 2NiO(OH) +2e- +2H2O=2Ni(OH)2+2OH-负极: Cd - 2e- + 2OH-=Cd(OH)2 2.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的镉镍电池。氢镍电池的总反应式是
根据此反应式判断,下列叙述中正确的是
(A)电池放电时,电池负极周围溶液pH不断增大 (B)电池放电时,镍元素被氧化 (C)电池放电时,氢在负极反应C1.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为
Li + MnO2=LiMnO2,下列说法正确的是( )
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+BCd石墨棒KOHPbO2H2SO4NiO(OH)KOHPb锌筒锌粉石墨棒NH4Cl小结Ⅲ.燃料电池——高效、环境友好的化学电池它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等
(电极本身不参与反应) 燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。1.氢氧燃料电池
负极:
正极:
总反应:
2H2-4e-=4H+O2+2H2O+4e-==4OH-2H2 + O2 == 2H2O(1)中性介质酸性电解质(H2SO4)
负极(Pt):
正极(Pt):
电池总反应:
碱性电解质(KOH)
负极(Pt):
正极(Pt):
电池总反应:(1)氢氧燃料电池 2H2-4e-=4H+O2+4H++4e-=2H2O2H2+O2=2H2O2H2-4e-+4OH-=4H2OO2+2H2O+4e-=4OH-2H2+O2=2H2O 电解质溶液的酸碱性对电极反应的影响(有效地防止电解质溶液对外壳的腐蚀)使用氢氧燃料电池动力
的法国产标致TAXI
同济大学研制的燃料电池汽车-超越3号我国自主研发的燃料电池车神舟十号燃料电池发电系统例1:写出甲烷燃料电池(电解质溶液为稀硫酸溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 8H+ === 4H2O负极: CH4 -8e- + 2H2O === CO2 + 8H+总反应:CH4 + 2O2 === CO2 + 2H2O 正极: O2 + 4e- + 4H+ === 2H2O反应后溶液的pH如何变化?溶液稀释,PH值增加例2:写出甲烷燃料电池(电解质溶液为氢氧
化钾溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 4H2O === 8OH-负极: CH4 -8e + 10OH- === CO32- + 7H2O总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O 反应后溶液的pH如何变化?PH值降低正极: O2 + 4e- + 4H+ === 2H2O1、通入的气体在电极表面反应(燃料在负极反应,氧气在正极反应),电极本身不参与反应,电池只是作为一个反应器。
2、与其它电池区别:电极不参与反应,反应物不
是储存在电池内。
小结燃料电池:其他电池废电池对环境的危害电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严重的污染。上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。减少污染 节约资源废电池污染治理刻不容缓1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极B
