人教版高中化学选修四:1.1 化学反应与能量的变化23张PPT
文档属性
| 名称 | 人教版高中化学选修四:1.1 化学反应与能量的变化23张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 383.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-02 18:53:33 | ||
图片预览





文档简介
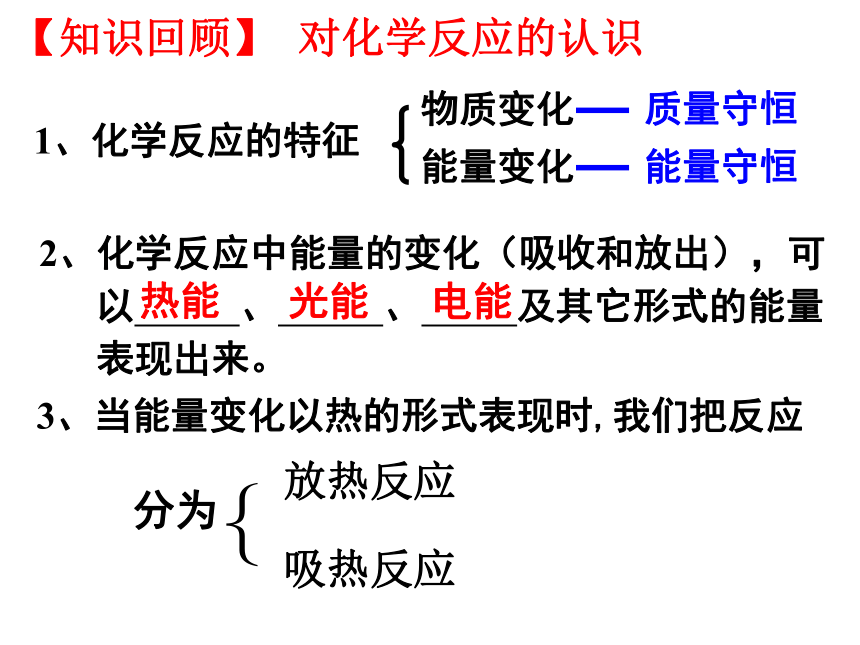
课件23张PPT。第一章 化学反应与能量 第一节 化学反应与能量的变化【知识回顾】 对化学反应的认识1、化学反应的特征物质变化能量变化质量守恒能量守恒2、化学反应中能量的变化(吸收和放出),可
以 、 、 及其它形式的能量
表现出来。光能热能电能3、当能量变化以热的形式表现时,我们把反应
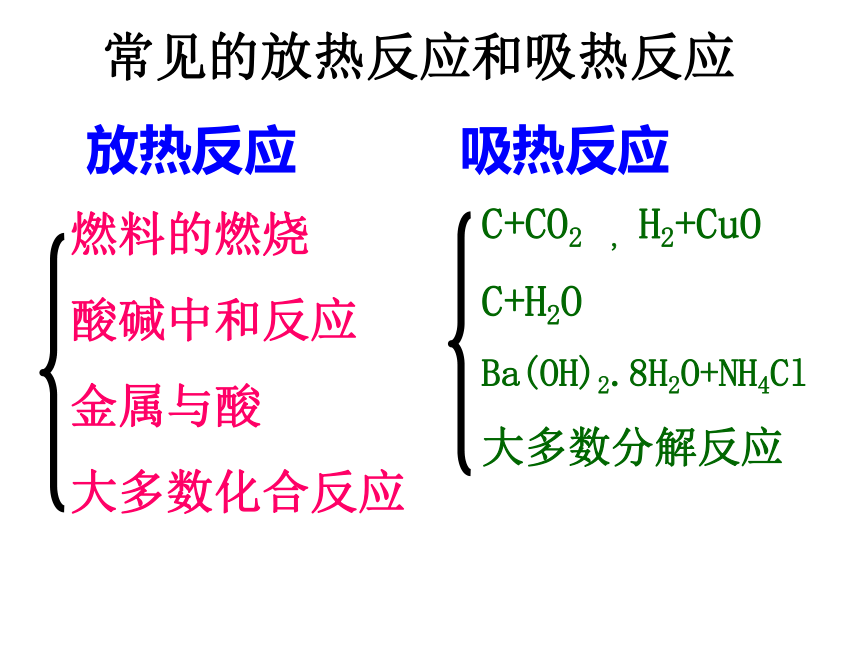
分为{放热反应吸热反应放热反应吸热反应燃料的燃烧
酸碱中和反应
金属与酸
大多数化合反应C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
大多数分解反应常见的放热反应和吸热反应一、反应热 焓变1、定义:2、符号:△H3、单位:kJ/mol 或kJ·mol-1焓变:由生成物与反应物的焓值差 化学反应过程中放出或吸收的热量叫做化学反应的反应热。注:单位中的每mol是与整个反应对应的,
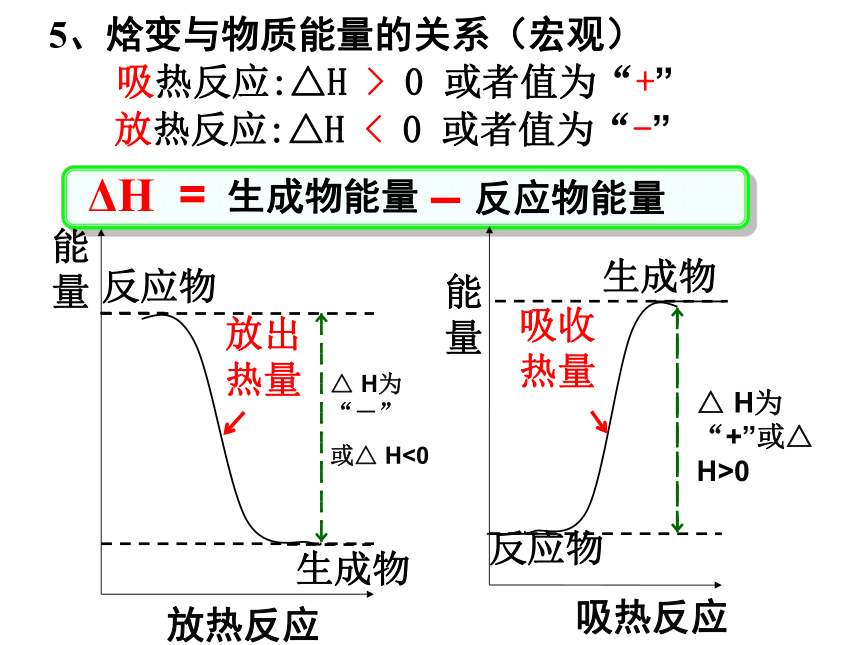
即反应热表示每mol反应放出或吸收的热量。4、在一定条件下,判断某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定 △H = H生成物-H反应物5、焓变与物质能量的关系(宏观)ΔH = 生成物能量反应物能量–生成物能量 吸热反应:△H > 0 或者值为“+”
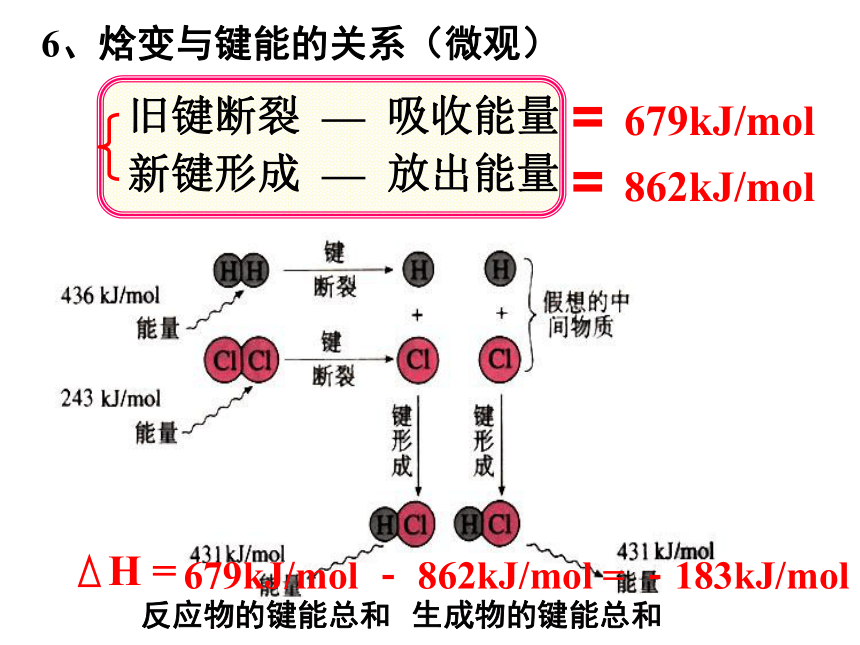
放热反应:△H < 0 或者值为“-”旧键断裂 — 吸收能量新键形成 — 放出能量==679kJ/mol862kJ/mol679kJ/mol - 862kJ/mol = -183kJ/mol反应物的键能总和生成物的键能总和6、焓变与键能的关系(微观)名词解释 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。6、焓变与键能的关系(微观)ΔH = 反应物的键能总和生成物的键能总和–练习 :拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1mol N2生成NH3的反应热为 ,
则1mol H2生成NH3的反应热为 。 -92.0 kJ/mol-30.67 kJ/mol相当于 1/3 mol N2小 结一、反应热、焓变
从焓变角度看:ΔH=生成物的焓-反应物的焓从反应热角度看:ΔH=生成物能量-反应物能量从键能角度看:ΔH=反应物总键能-生成物总键能任何一个化学反应都包括物质的变化和能量的变化。那么,有什么表达式能正确地把这两种变化都表示出来?思考二、热化学方程式:
概念:能够表示反应热的化学方程式叫做热化学方程式。热化学方程式H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol200℃
101kPa 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。物质变化能量变化表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。书写热化学方程式的注意事项1、化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”,单位是kJ/mol注意:“+”不能省写C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/molH2(g)+I2(g)===== 2HI(g) △H=-14.9kJ/mol200℃
101kPa2、热化学方程式需注明测定时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。(普通化学方程式不需注明温度和压强。)如不注明条件,即指: 25℃ 1.01×105Pa;H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol200℃
101kPa书写热化学方程式的注意事项3、热化学方程式需注明各物质的状态。
(普通化学方程式不需注明物质的状态。)注:物质后需标聚集状态
s(固体)、l (液体) 、g (气体) 、aq(稀溶液)书写热化学方程式的注意事项能量增加熔化蒸发固态
液态吸热气态吸热吸热4、热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。5、若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变书写热化学方程式的注意事项热化学方程式表示的意义1、反应物和生成物的种类、聚集状态
2、反应中各物质的物质的量比和质量比
3、反应中放出或吸收的热量。综上所述 热化学方程式中各物质前的化学计量数不表示分子个数,表示对应物质的物质的量。
?H(kJ/mol)它表示每摩尔反应所放出的热量,?H的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其?H不同。热化学方程式的书写步骤:1、写出化学反应方程式
2、注明反应物和生成物的状态
3、标明反应热△H(注意单位和+、-)
4、注明反应的温度和压强(不注明指常温常压)
5、检查小结:【练习】书写下列反应的热化学方程式
①1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
②2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;
③1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
N2(g)+O2(g)=2NO (g) △H=+68kJ/mol2Cu(s)+O2(g)=2CuO (s) △H=-314kJ/molS(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol实验:中和热的测定整个装置:量热计主要仪器:
温度计
环形玻璃搅拌棒
大小烧杯辅助用品:
碎泡沫塑料泡沫塑料板 在稀溶液中,强酸跟强碱发生中和反应生成
1 mol水时的反应热叫做中和热。 实验注意事项:①保温效果一定要好,小烧杯和大烧杯的杯口要相平。
②盐酸和氢氧化钠溶液的浓度要准确,所用盐酸或氢氧化钠溶液稍过量。
③宜用有0.1分度的温度计,温度计水解球应浸没在溶液中。
④测量完盐酸的温度后,应将温度计用蒸馏水洗后,再去测NaOH溶液的温度。
⑤每次实验仅可能测得反应混合液的最高温度;平行做2-3次实验,其温度采用平均值进行计算。
⑥计算式:△H=-0.418(T2-T1)/(cV) kJ/mol 课堂练习
以 、 、 及其它形式的能量
表现出来。光能热能电能3、当能量变化以热的形式表现时,我们把反应
分为{放热反应吸热反应放热反应吸热反应燃料的燃烧
酸碱中和反应
金属与酸
大多数化合反应C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
大多数分解反应常见的放热反应和吸热反应一、反应热 焓变1、定义:2、符号:△H3、单位:kJ/mol 或kJ·mol-1焓变:由生成物与反应物的焓值差 化学反应过程中放出或吸收的热量叫做化学反应的反应热。注:单位中的每mol是与整个反应对应的,
即反应热表示每mol反应放出或吸收的热量。4、在一定条件下,判断某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定 △H = H生成物-H反应物5、焓变与物质能量的关系(宏观)ΔH = 生成物能量反应物能量–生成物能量 吸热反应:△H > 0 或者值为“+”
放热反应:△H < 0 或者值为“-”旧键断裂 — 吸收能量新键形成 — 放出能量==679kJ/mol862kJ/mol679kJ/mol - 862kJ/mol = -183kJ/mol反应物的键能总和生成物的键能总和6、焓变与键能的关系(微观)名词解释 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。6、焓变与键能的关系(微观)ΔH = 反应物的键能总和生成物的键能总和–练习 :拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1mol N2生成NH3的反应热为 ,
则1mol H2生成NH3的反应热为 。 -92.0 kJ/mol-30.67 kJ/mol相当于 1/3 mol N2小 结一、反应热、焓变
从焓变角度看:ΔH=生成物的焓-反应物的焓从反应热角度看:ΔH=生成物能量-反应物能量从键能角度看:ΔH=反应物总键能-生成物总键能任何一个化学反应都包括物质的变化和能量的变化。那么,有什么表达式能正确地把这两种变化都表示出来?思考二、热化学方程式:
概念:能够表示反应热的化学方程式叫做热化学方程式。热化学方程式H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol200℃
101kPa 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。物质变化能量变化表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。书写热化学方程式的注意事项1、化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”,单位是kJ/mol注意:“+”不能省写C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/molH2(g)+I2(g)===== 2HI(g) △H=-14.9kJ/mol200℃
101kPa2、热化学方程式需注明测定时的温度和压强。对于 25℃ 101kPa时进行的反应可不注明。(普通化学方程式不需注明温度和压强。)如不注明条件,即指: 25℃ 1.01×105Pa;H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol200℃
101kPa书写热化学方程式的注意事项3、热化学方程式需注明各物质的状态。
(普通化学方程式不需注明物质的状态。)注:物质后需标聚集状态
s(固体)、l (液体) 、g (气体) 、aq(稀溶液)书写热化学方程式的注意事项能量增加熔化蒸发固态
液态吸热气态吸热吸热4、热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。5、若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变书写热化学方程式的注意事项热化学方程式表示的意义1、反应物和生成物的种类、聚集状态
2、反应中各物质的物质的量比和质量比
3、反应中放出或吸收的热量。综上所述 热化学方程式中各物质前的化学计量数不表示分子个数,表示对应物质的物质的量。
?H(kJ/mol)它表示每摩尔反应所放出的热量,?H的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其?H不同。热化学方程式的书写步骤:1、写出化学反应方程式
2、注明反应物和生成物的状态
3、标明反应热△H(注意单位和+、-)
4、注明反应的温度和压强(不注明指常温常压)
5、检查小结:【练习】书写下列反应的热化学方程式
①1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
②2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;
③1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
N2(g)+O2(g)=2NO (g) △H=+68kJ/mol2Cu(s)+O2(g)=2CuO (s) △H=-314kJ/molS(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol实验:中和热的测定整个装置:量热计主要仪器:
温度计
环形玻璃搅拌棒
大小烧杯辅助用品:
碎泡沫塑料泡沫塑料板 在稀溶液中,强酸跟强碱发生中和反应生成
1 mol水时的反应热叫做中和热。 实验注意事项:①保温效果一定要好,小烧杯和大烧杯的杯口要相平。
②盐酸和氢氧化钠溶液的浓度要准确,所用盐酸或氢氧化钠溶液稍过量。
③宜用有0.1分度的温度计,温度计水解球应浸没在溶液中。
④测量完盐酸的温度后,应将温度计用蒸馏水洗后,再去测NaOH溶液的温度。
⑤每次实验仅可能测得反应混合液的最高温度;平行做2-3次实验,其温度采用平均值进行计算。
⑥计算式:△H=-0.418(T2-T1)/(cV) kJ/mol 课堂练习
