人教版高中化学选修四4.4 金属的电化学腐蚀与防护
文档属性
| 名称 | 人教版高中化学选修四4.4 金属的电化学腐蚀与防护 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-02 18:54:48 | ||
图片预览





文档简介
课件21张PPT。第四节
金属的电化学腐蚀与防护钢铁铜器金属制品腐蚀的调查 全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元。
资料在线 据有关专家介绍,全球每一分钟就有1吨钢腐蚀成铁锈。
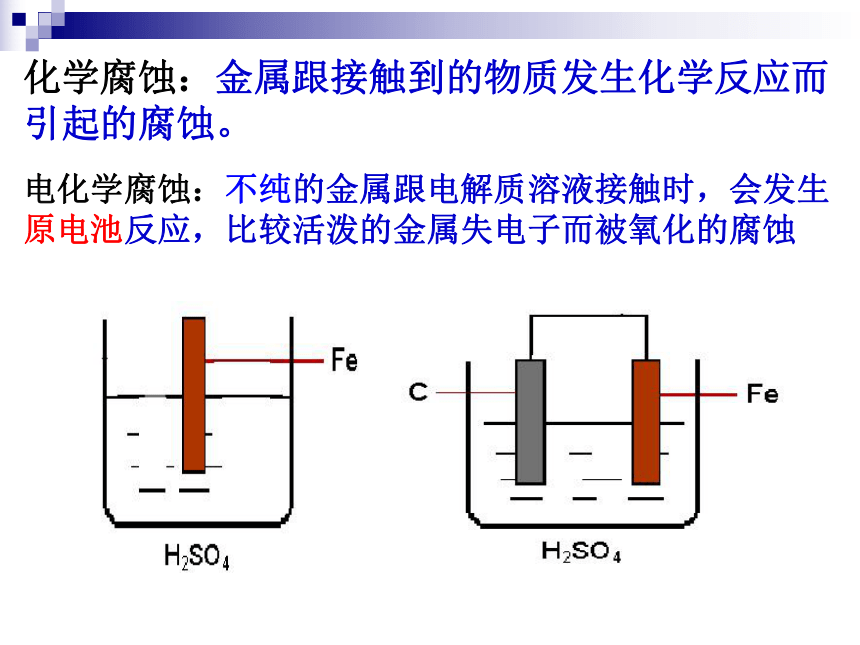
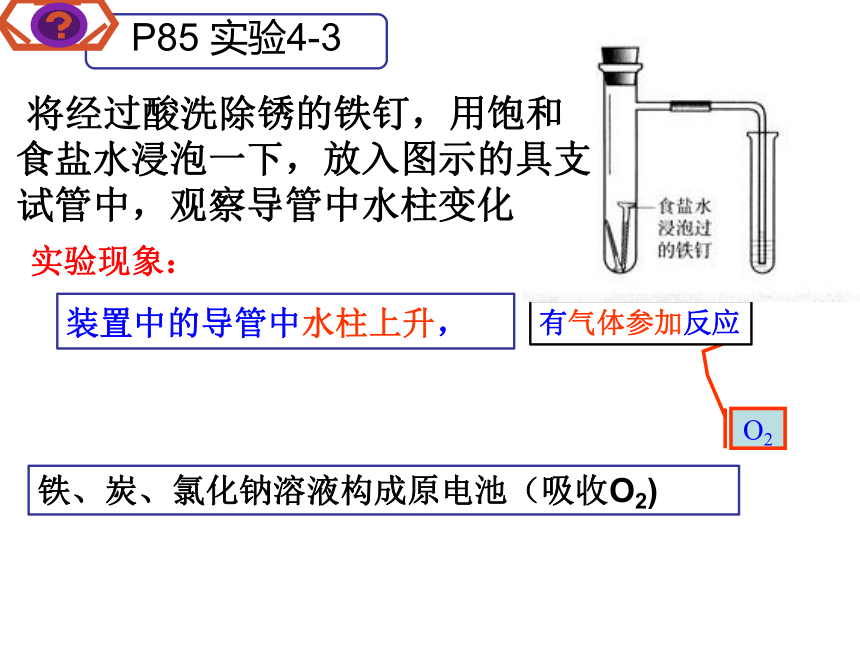
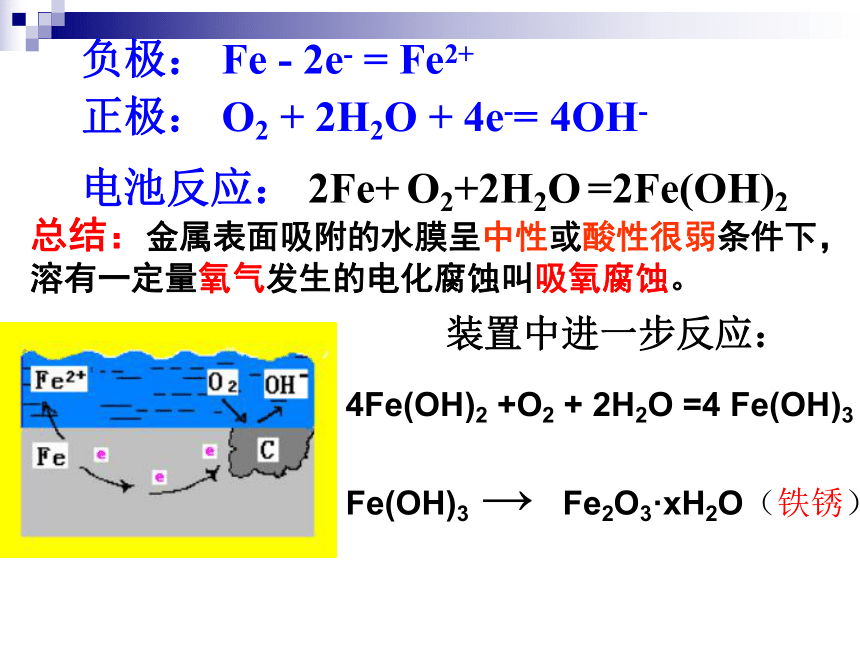
是指金属或合金跟周围的气体或液体发生氧化还原反应而引起损耗的现象。3.金属腐蚀的类型化学腐蚀一、 金属腐蚀2.金属腐蚀的本质:1. 金属腐蚀:阅读课本 P84思考问题:什么是金属腐蚀?本质是什么?电化学腐蚀化学腐蚀:金属跟接触到的物质发生化学反应而引起的腐蚀。电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化的腐蚀实验现象:O2装置中的导管中水柱上升,铁、炭、氯化钠溶液构成原电池(吸收O2)有气体参加反应 将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入图示的具支试管中,观察导管中水柱变化负极: Fe - 2e- = Fe2+正极: O2 + 2H2O + 4e-= 4OH-电池反应: 2Fe+ O2+2H2O =2Fe(OH)2总结:金属表面吸附的水膜呈中性或酸性很弱条件下,溶有一定量氧气发生的电化腐蚀叫吸氧腐蚀。装置中进一步反应:4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
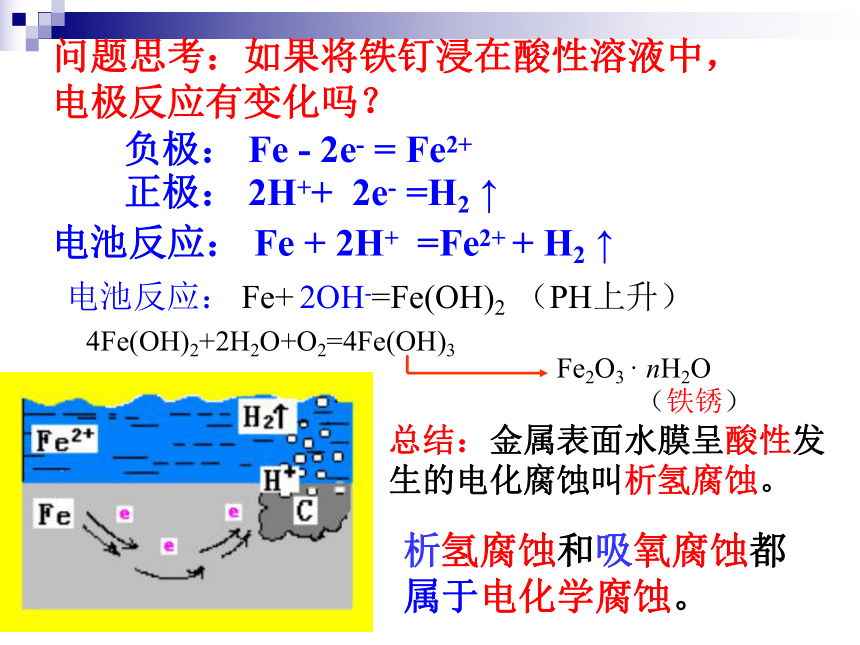
Fe(OH)3 → Fe2O3·xH2O(铁锈)正极: 2H++ 2e- =H2 ↑负极: Fe - 2e- = Fe2+电池反应: Fe + 2H+ =Fe2+ + H2 ↑总结:金属表面水膜呈酸性发生的电化腐蚀叫析氢腐蚀。问题思考:如果将铁钉浸在酸性溶液中,
电极反应有变化吗?析氢腐蚀和吸氧腐蚀都属于电化学腐蚀。2、析氢腐蚀与吸氧腐蚀(以Fe为例) 2H++ 2e- =H2 O2 + 2H2O + 4e-= 4OH- Fe - 2e- = Fe2+ Fe2++ 2OH- =Fe(OH)2
4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3
2Fe(OH)3=Fe2O3·nH2O+(3-n) H2O(铁锈)水膜酸性较强水膜酸性很弱或中性 吸氧腐蚀比析氢腐蚀更普遍3、化学腐蚀与电化腐蚀金属的电化学腐蚀12/2/20181课堂练习1、如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若试管中液面上升,则溶液呈 性,
发生 腐蚀,电极反应式为:负极:
正极:若试管液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:负极:
正极: (2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 请解释下列有关铁腐蚀现象的原因。2.用于连接铜板的铁螺丝容易生锈。 是由于铁与铜吸收空气中的水蒸汽形成水膜构成了原电池, 较活泼的铁作原电池的负极,因此铁易被腐蚀而生锈。1.炒完菜的铁锅放置后锅内什么位置容易生锈,为什么? 炒菜的铁锅有残存的氯化钠,放置后水滴容易聚集到
锅底,与水接触的界面构成吸氧腐蚀,形成铁锈。思考与交流 讨论自行车的不同构件如链条、钢圈、支架和齿轮等分别采取了什么防锈措施? 二、金属的防护②改变金属的内部结构①在金属表面覆盖“保护膜”③电化学防护——合金(不锈钢)利用“原电池”和“电解池”保护金属——电镀、涂油脂二、金属的电化学防护1、牺牲阳极的阴极保护法:利用“原电池原理”保护 极金属正2、外加电流的阴极保护法: 二、金属的电化学防护利用“ 原理”保护 极金属电解池阴例:下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4) 在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀 防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件保护>无防腐条件 一.金属的腐蚀 1.定义 2.本质 3.分类 化学腐蚀电化学腐蚀(主)钢铁的析氢腐蚀(次要)钢铁的吸氧腐蚀(主要)二.金属的防护
1.在金属表面覆盖保护层
2.改善金属的内部组织结构(内因)
3.电化学保护法
课堂小结 课堂巩固1、为保护地下钢管不被腐蚀,可使它与( )
A、直流电源负极相连
B、铜板相连
C、锌板相连
D、直流电源正极相连2、以下现象与电化学腐蚀无关的是( )
A、铜锌合金制作的铜锣不易产生铜锈
B、生铁比纯铁更容易生锈
C、铁质器件附有铜配件,在接触处易生锈
D、银制物品久置表面变暗
金属的电化学腐蚀与防护钢铁铜器金属制品腐蚀的调查 全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元。
资料在线 据有关专家介绍,全球每一分钟就有1吨钢腐蚀成铁锈。
是指金属或合金跟周围的气体或液体发生氧化还原反应而引起损耗的现象。3.金属腐蚀的类型化学腐蚀一、 金属腐蚀2.金属腐蚀的本质:1. 金属腐蚀:阅读课本 P84思考问题:什么是金属腐蚀?本质是什么?电化学腐蚀化学腐蚀:金属跟接触到的物质发生化学反应而引起的腐蚀。电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化的腐蚀实验现象:O2装置中的导管中水柱上升,铁、炭、氯化钠溶液构成原电池(吸收O2)有气体参加反应 将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入图示的具支试管中,观察导管中水柱变化负极: Fe - 2e- = Fe2+正极: O2 + 2H2O + 4e-= 4OH-电池反应: 2Fe+ O2+2H2O =2Fe(OH)2总结:金属表面吸附的水膜呈中性或酸性很弱条件下,溶有一定量氧气发生的电化腐蚀叫吸氧腐蚀。装置中进一步反应:4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
Fe(OH)3 → Fe2O3·xH2O(铁锈)正极: 2H++ 2e- =H2 ↑负极: Fe - 2e- = Fe2+电池反应: Fe + 2H+ =Fe2+ + H2 ↑总结:金属表面水膜呈酸性发生的电化腐蚀叫析氢腐蚀。问题思考:如果将铁钉浸在酸性溶液中,
电极反应有变化吗?析氢腐蚀和吸氧腐蚀都属于电化学腐蚀。2、析氢腐蚀与吸氧腐蚀(以Fe为例) 2H++ 2e- =H2 O2 + 2H2O + 4e-= 4OH- Fe - 2e- = Fe2+ Fe2++ 2OH- =Fe(OH)2
4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3
2Fe(OH)3=Fe2O3·nH2O+(3-n) H2O(铁锈)水膜酸性较强水膜酸性很弱或中性 吸氧腐蚀比析氢腐蚀更普遍3、化学腐蚀与电化腐蚀金属的电化学腐蚀12/2/20181课堂练习1、如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若试管中液面上升,则溶液呈 性,
发生 腐蚀,电极反应式为:负极:
正极:若试管液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:负极:
正极: (2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 请解释下列有关铁腐蚀现象的原因。2.用于连接铜板的铁螺丝容易生锈。 是由于铁与铜吸收空气中的水蒸汽形成水膜构成了原电池, 较活泼的铁作原电池的负极,因此铁易被腐蚀而生锈。1.炒完菜的铁锅放置后锅内什么位置容易生锈,为什么? 炒菜的铁锅有残存的氯化钠,放置后水滴容易聚集到
锅底,与水接触的界面构成吸氧腐蚀,形成铁锈。思考与交流 讨论自行车的不同构件如链条、钢圈、支架和齿轮等分别采取了什么防锈措施? 二、金属的防护②改变金属的内部结构①在金属表面覆盖“保护膜”③电化学防护——合金(不锈钢)利用“原电池”和“电解池”保护金属——电镀、涂油脂二、金属的电化学防护1、牺牲阳极的阴极保护法:利用“原电池原理”保护 极金属正2、外加电流的阴极保护法: 二、金属的电化学防护利用“ 原理”保护 极金属电解池阴例:下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4) 在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀 防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件保护>无防腐条件 一.金属的腐蚀 1.定义 2.本质 3.分类 化学腐蚀电化学腐蚀(主)钢铁的析氢腐蚀(次要)钢铁的吸氧腐蚀(主要)二.金属的防护
1.在金属表面覆盖保护层
2.改善金属的内部组织结构(内因)
3.电化学保护法
课堂小结 课堂巩固1、为保护地下钢管不被腐蚀,可使它与( )
A、直流电源负极相连
B、铜板相连
C、锌板相连
D、直流电源正极相连2、以下现象与电化学腐蚀无关的是( )
A、铜锌合金制作的铜锣不易产生铜锈
B、生铁比纯铁更容易生锈
C、铁质器件附有铜配件,在接触处易生锈
D、银制物品久置表面变暗
