人教版高中化学选修四第二章第三节 化学平衡状态 课件
文档属性
| 名称 | 人教版高中化学选修四第二章第三节 化学平衡状态 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 255.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-02 18:48:37 | ||
图片预览





文档简介
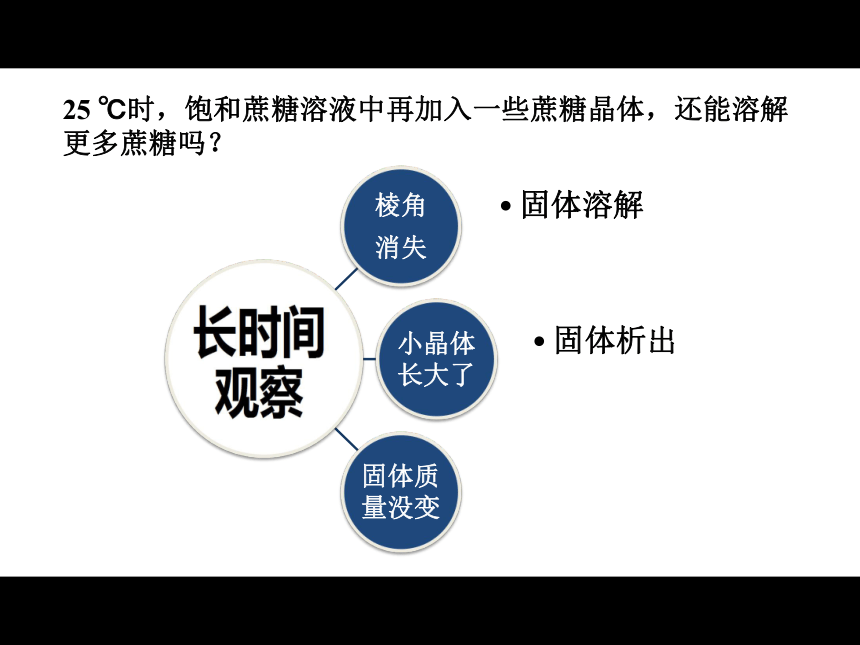
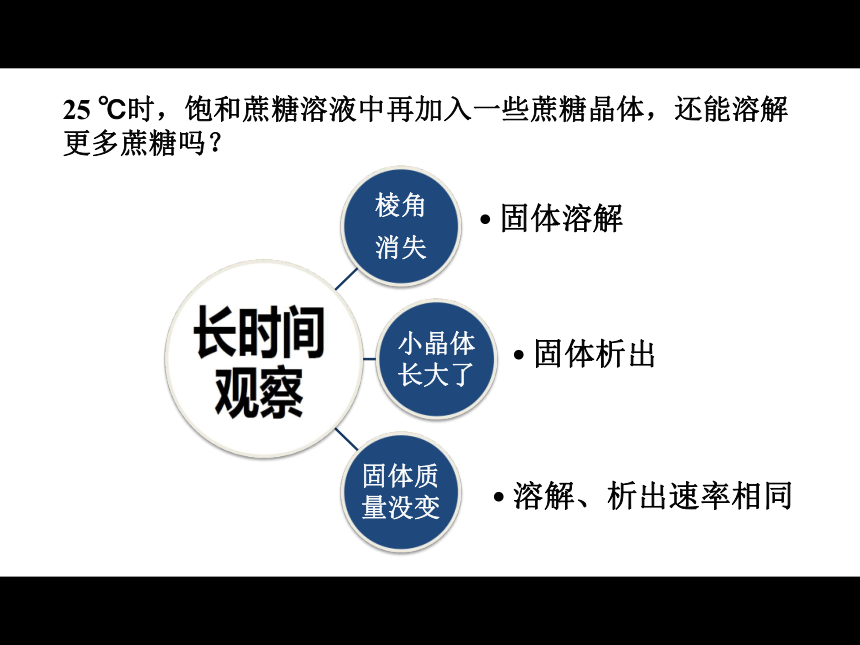
课件17张PPT。 化学平衡状态人教版高中化学选修四第二章第三节25 ℃时,饱和蔗糖溶液中再加入一些蔗糖晶体,还能溶解更多蔗糖吗?固体溶解固体析出可逆过程:相同条件下,同一体系中同时存在的两个相反的过程。25 ℃时,饱和蔗糖溶液中再加入一些蔗糖晶体,还能溶解更多蔗糖吗?固体溶解固体析出溶解、析出速率相同溶解平衡状态:在饱和溶液中,溶质溶解、析出速率相同时的状态。N2 + 3H2 ? 2NH32SO2 + O2 ? 2SO3 Cl2 + H2O ? HCl + HClOCO2 + H2O ? H2CO3 SO2 + H2O ? H2SO3 NH3 + H2O ? NH3· H2O 可逆反应:相同条件下,同一体系中正向反应(反应物→生成物)和逆向反应(反应物←生成物)能同时进行的反应。不可逆反应中,随着反应的进行,反应物不断转化为生成物,反应物浓度________,反应速率_________,最终反应物浓度_________________,反应速率_________。不断减小不断减小至少有一种物质为零变为零回顾: 在一个可逆反应中,开始只加入了反应物。反应开始后:2、正反应速率、逆反应速率会怎么变化?为什么?思考并讨论:1、反应物、生成物的浓度会怎么变化?为什么?3、最终正、逆反应速率会有什么关系?4、最终反应物、生成物的浓度会怎么变化?为什么?化学平衡状态:在一定条件下,当正、逆两个方向的反应速率相等时,反应体系中所有参加反应的物质的质量和浓度可以保持恒定。这时的状态称之为化学平衡状态。在1L固定容积的恒温密闭容器中,能发生反应N2 + 3H2 ? 2NH3 。开始时,只充入 N2 和H2 ,用v-t图像表示反应过程中v正 、v逆 的变化情况。实例分析:化学平衡状态有何特征?逆:只有可逆反应才可能存在化学平衡状态;等: v正 = v逆;动:动态平衡,v正 = v逆 ≠ 0;定:各物质的各种量恒定不变;变:如果改变了影响平衡的条件,平衡就会 破坏,再建立一个新的平衡。在体积固定的密闭容器中,对于N2(g)+3H2(g) ? 2NH3(g) ΔH<0的反应,达到平衡的标志是________。
A.生成NH3的速率与NH3的分解速率相等
B.断开一个N≡N键的同时有6个N-H键生成
C.N2、H2、NH3百分含量不再变化
D.总压强不变E.N2、H2、NH3分子数之比为1∶3∶2的状态
F.N2、H2、NH3的浓度相等
G.N2、H2不再起反应
H.v(N2)=v(H2)
I.混合气体密度不变
J.混合气平均相对分子质量不变
K.反应放出的热量等于反应吸收的热量本节小结谢谢
A.生成NH3的速率与NH3的分解速率相等
B.断开一个N≡N键的同时有6个N-H键生成
C.N2、H2、NH3百分含量不再变化
D.总压强不变E.N2、H2、NH3分子数之比为1∶3∶2的状态
F.N2、H2、NH3的浓度相等
G.N2、H2不再起反应
H.v(N2)=v(H2)
I.混合气体密度不变
J.混合气平均相对分子质量不变
K.反应放出的热量等于反应吸收的热量本节小结谢谢
