人教版高中化学选修四第三章第一节《弱电解质的电离》教学课件
文档属性
| 名称 | 人教版高中化学选修四第三章第一节《弱电解质的电离》教学课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-02 19:08:45 | ||
图片预览










文档简介
课件49张PPT。第三章 水溶液中的离子平衡第一节 弱电解质的电离人教版选修4 · 化学反应原理【考纲点击】
1.了解强、弱电解质的概念.
2.了解弱电解质在水溶液中的电离平衡.
3.了解水的电离、离子积常数.电解质:在水溶液中或熔融状态下能够导电的化合物。非电解质:在水溶液中和熔融状态下都不能够导电的化合物。复习(酸、碱、盐、金属氧化物、水)(大多数有机物、非金属氧化物、某些非金属氢化物)练习:下列物质中,属于电解质的是_____________,属于非电解质的是__________,能导电的是_________,
A 、二氧化硫 B 、氨气 C 、铜 D、 硫酸钡晶体 E、硫酸 F、甲烷 G、饱和食盐水 H、 蔗糖 I 、乙醇 J、熔融的氯化钠 K、冰醋酸 L、氧化钠D E J KLA B F H I C G J一、电解质和非电解质注意电解质非电解质化合物纯净物物 质混合物单 质强电解质
弱电解质练习1:下列物质的水溶液能导电,但属于
非电解质的是( )
A.CH3CH2COOH B.Cl2
C.NH4HCO3 D.SO2D 1.醋酸和盐酸是常见的两种酸,根据你的经验,你认为它们的电离程度有无差异?请说出你的理由。
2.你能设计实验验证你的猜想吗?请写出实验方案并与同学交流。
3.若按如下方案(或按你自己设计的方案)进行实验,请记录实验现象。
(1)测量物质的量浓度均为1mol·L-1的盐酸和醋酸的pH。
(2) 在两只锥形瓶中分别加入等体积、物质的量浓度均为1mol·L-1 的盐酸和醋酸,在两个气球中分别加入经砂纸打磨过的长度相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察、比较气球鼓起的快慢等现象,将实验现象和你对实验现象的解释填入表3-1。【实验探究反应剧烈反应较慢PH较小(0)PH较大(2.4)实验3-1现象分析:镁无论是与盐酸还是与醋酸反应,其实质都是与溶液中的____反应
镁与盐酸反应比镁与醋酸反应剧烈,说明 ________________
反应剧烈程度的不同,是由于溶液中的_____不同而引起的
pH (盐酸)< pH( 醋酸),证明_____________________H+H+浓度c( H+盐酸)> c( H+醋酸) c( H+盐酸)> c( H+醋酸) 实验结果:相同浓度的盐酸与醋酸,其溶液中
c( H+盐酸)> c( H+醋酸) 。
说明:HCl和CH3COOH的电离程度不同。
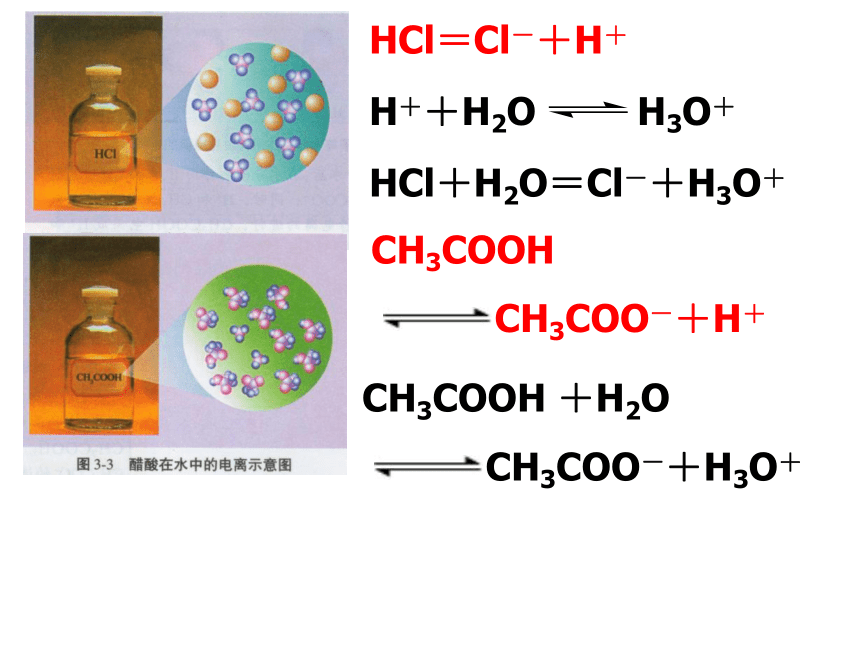
盐酸与醋酸在水中的电离示意图观察两种溶液中溶质微粒有多少种?盐酸在水中的电离示意图醋酸在水中的电离示意图说明 HCl分子在水中完全电离
醋酸分子在水中部分电离 HCl=Cl-+H+HCl+H2O=Cl-+H3O+CH3COOH
CH3COO-+H+CH3COOH +H2O
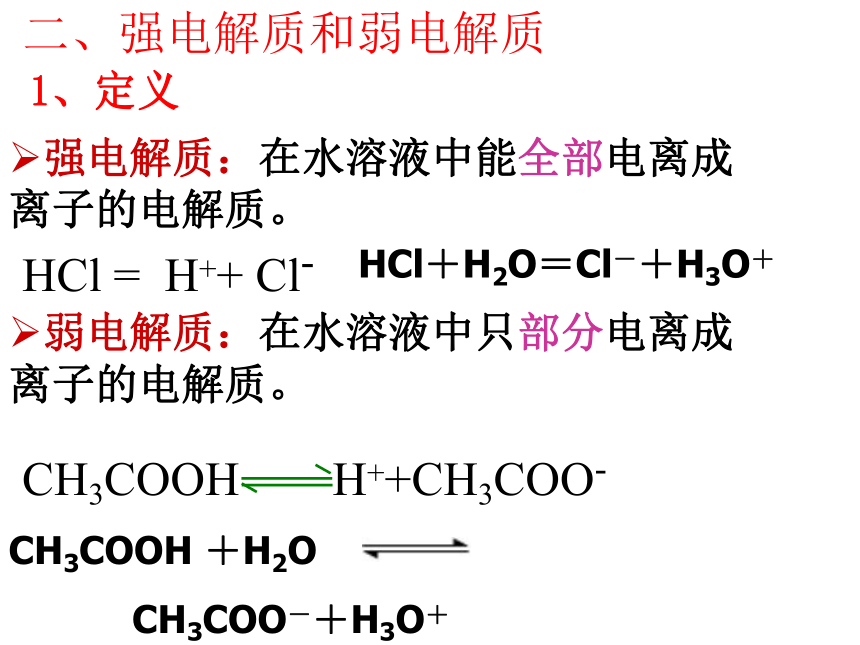
CH3COO-+H3O+H++H2O H3O+二、强电解质和弱电解质强电解质:在水溶液中能全部电离成 离子的电解质。弱电解质:在水溶液中只部分电离成 离子的电解质。1、定义HCl = H++ Cl-HCl+H2O=Cl-+H3O+CH3COOH +H2O
CH3COO-+H3O+二、强电解质和弱电解质电解质强电解质强碱大部分盐强酸弱电解质 弱碱弱酸水H2SO4 HCl HNO3 HBr HI HClO4NaOH KOH Ca(OH)2 Ba(OH)2CH3COOH HF H2S HClO H3PO4 H2SO3 H2SiO3NH3·H2O Al(OH)3 Fe(OH)3 Cu(OH)2完全电离部分电离离子化合物大部分的盐类强 碱共价化合物强 酸弱 酸弱 碱 水弱
电
解
质强电解质离子型氧化物电解质非
电
解
质多数有机物某些非金属氧化物化合物小结:强弱电解质与结构的关系 下列电解质中, ① NaCl、 ② NaOH,
③ NH3·H2O、 ④ CH3COOH, ⑤ BaSO4 、
⑥ AgCl 、 ⑦ Na2O 、 ⑧ K2O, ⑨ H2O
哪些是强电解质,那些是弱电解质?强电解质: ① ② ⑤ ⑥ ⑦ ⑧弱电解质:③ ④ ⑨练习与实践 电解质溶于水或者受热熔化时,离解成自由移动的离子的过程叫做电离。三、电解质的电离1、电离2、电离方程式用来表示电离过程的式子叫做电离方程式。3、电离方程式的书写: (1)式子左边用电离物质的化学式表示,右边用离子符号表示。
(2)强电解质用“=”表示电离过程,弱电解质用“ ” 表示电离过程。电离方程式书写:(4)多元弱碱则一步书写.
如: Cu(OH)2 Cu2+ + 2OH-(3)多元弱酸的电离要分步。
写出H3PO4在水溶液中的电离方程式H3PO4H+ + H2PO4- (1)H2PO4-H+ + HPO42- (2)HPO42-H+ + PO43- (3)试写出NaHSO4、NaHCO3的在水溶液中及熔融状态下的电离方程式?在水溶液中:NaHSO4=Na+ + H+ + SO42-
NaHCO3=Na+ + HCO3-
HCO3- H+ + CO32-熔融状态:NaHSO4=Na+ + HSO4-另外,氢氧化铝双向电离:
H++AlO2-+H2O Al(OH)3 Al3++3OH- NaHCO3=Na+ + HCO3- 完全电离部分电离不可逆过程可逆过程电离方程式用等号电离方程式用可逆符号离子分子、离子离子符号或化学式分子式强酸、强碱、多数盐、
部分碱性氧化物弱酸、弱碱、水强电解质与弱电解质的比较练习1. 写出下列物质的电离方程式
(1) HClO
(2) KHSO3
(3) CaCO3
(4) Fe(OH)2
H++ClO-=K++HSO3-=Ca2++CO32-Fe2++2OH-练习2:1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
①开始反应时产生氢气的速率
②最终收集到的氢气的物质的量
硫酸>盐酸>醋酸硫酸>盐酸=醋酸1.强电解质溶液离子浓度大,而弱电解质溶液离子浓度小,是否正确?为什么?
2.强电解质溶液导电能力大,而弱电解质溶液导电能力小,是否正确?为什么? 问题探究 溶液的导电能力取决于溶液中总离子
浓度的大小。因此强电解质的导电能力不 一定比弱电解质强。在同一浓度时,强电解质一定比弱电解质的导电能力强。 问题结论 你能解释下列事实吗?部分电器外壳上有禁止触摸标记 2.电解水制H2、02时,需要向水中加入少量的Na0H溶液或H2SO4溶液。1.潮湿的手触摸正在工作的电器,可能会发生触电事故。手上的汗水中含有电解质,使水溶液具有较强的导电能力 纯水的导电能力太弱,加入NaOH或H2SO4可使溶液中离子浓度增大,导电能力增强。 DDBD1.下列关于强弱电解质的叙述错误的是 ( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电
能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其
导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电B解析:强电解质和弱电解质是依据电离程度划分的,电解质的强弱和其溶液的导电能力强弱没有必然的对应关系,所以错误的叙述是B项.D项如熔融的氯化钠导电,而液态纯硫酸不导电.第二课时 弱电解质的电离醋酸在电离过程中各微粒浓度的变化1、弱电解质的电离 CH3COOH CH3COO - + H+00最大不变不变不变画出这个过程的V~t图吗?反应速率V(电离)V(结合)V(电离) = V(结合) 电离平衡状态弱电解质电离平衡状态建立示意图时间2、电离平衡状态建立电离平衡是一种
化学平衡电离平衡状态是指
在一定条件下(如温度、浓度等)的弱电解质的溶液中,
弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,
溶液中各分子、离子的浓度保持不变的状态。 前提实质标志 3.定义:4、特点:电离平衡是一种动态平衡 条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子 条件改变时,电离平衡发生移动。 弱电解质的电离①逆:
②等:
③动: ④定:
⑤变: 思考与交流(教材p41)根据化学平衡理论,分析一元弱酸(设为HA)、一元弱碱(设为BOH)的电离平衡过程,并完成下列问题:
1)、写出弱酸、弱碱的电离方程式:
2)、结合图3-3填写下表00最大最大0不变不变不变最大达到电离平衡时影响电离平衡的因素①温度②浓度③同离子效应④化学反应内因:电解质本身的性质。
通常电解质越弱电离程度越小。外
因当外界条件改变时符合“勒夏特列原理”电离过程是吸热过程,升高温度,平衡向电离方向移动 当电离达到平衡时,加水稀释向电离的方向移动,电离程度增大,增加弱电解质浓度,向电离的方向移动,但电离程度减小,加入同弱电解质电离所产生的离子相同离子,电离平衡向逆方向移动加入能与弱电解质电离产生的离子反应的物质时,使电离平衡向电离方向移动 例:在氨水中存在怎样的电离平衡?若向其中分别加入:
①升高温度 ②加氨气
③水 ④ NH4Cl溶液
⑤NaOH溶液 ⑥适量的盐酸
对上述电离平衡有什么影响?思考与讨论: NH3+H2O NH3·H2O NH4+ + OH -练习1完成表格:正向增大增大减小逆向增大减小增大正向减小增大减小逆向减小增大增大正向增大增大增大正向减小减小减小增大减小增大增大减小减小 0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动练习2B1.弱电解质加水稀释时,电离程度_____,离子浓度______? (填变大、变小、不变或不能确定)画出用水稀释冰醋酸时离子浓度、导电能力随加水量的变化曲线。
变大不能确定 导电能力探究讨论例:冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如下变化关系:试回答:a﹥c﹥ b C 相等⑴“0”点导电能力为0的理由是: ⑵a、b、c三点对应溶液的[H+]值由大到小的顺序是 ⑶a、b、c三点中电离程度最大的是 。电离平衡常数的关系 .①加碱②加碳酸钠③加镁或锌
第三课时三、电离平衡常数(K)
看课本自学相关内容并思考:
(1)什么叫电离平衡常数?
(2)电离平衡常数的化学含义是什么?
(3)怎样用电离平衡常数比较弱电解质的相对强弱?
(4)影响电离平衡常数的因素是什么?弱电解质电离程度相对大小的参数一
1、电离平衡常数(K)对于一元弱酸 HA H++A-,平衡时对于一元弱碱 MOH M++OH-,平衡时2、意义:K值越大,电离程度越大,相应酸 (或碱)的酸(或碱)性越强。K值只随温度变化。多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……,为什么? 多元弱酸是分步电离的,K1》K2》K3…..
(一般要相差105)。
3、对于多元酸:多元弱酸的酸性由第一步电离决定。第二步和第三步的电离分别受到第一步和第二步、第三步的抑制。酸性:醋酸>碳酸>硼酸
电离常数:醋酸>碳酸>硼酸 探究活动比较它们的相对强弱4、电离常数的应用草酸>磷酸>柠檬酸>碳酸 A>BA>BA=B1)、等体积,等浓度的盐酸和醋酸2)、体积、PH相同的盐酸(A)与醋酸(B)分别与锌反应ABA>BA=BA反应开始时产生H2的速率 ,
在相同条件下,产生H2的体积 。
(相等、不相等)不相等相等练习(1)相同温度、相同浓度的一元强酸和一元弱酸,导电能力弱
的为弱酸.
(2)相同浓度的一元强酸与弱酸,强酸的pH小.如0.01 mol/L
的酸HA溶液pH>2,说明酸HA在水溶液中没有完全电离,
HA是弱酸;0.01 mol/L的酸HB溶液pH=2,说明酸HB是强酸.
(3)相同pH的强酸、弱酸分别加水稀释相同的倍数,溶液的pH
变化小的是弱酸,变化大的是强酸.
(4)将pH相等的一元强酸和一元弱酸溶液稀释,稀释后溶液的pH
仍然相等,则加水多的为弱酸.2.根据强、弱电解质的定义或强、弱电解质的比较进行判断问题:如何证明某酸为弱酸?(5)向相同pH的强酸、弱酸中分别加该酸的钠盐,溶液的pH
增大的是弱酸,几乎不变的是强酸.
(6)pH相同,体积相同的强酸和弱酸分别与碱反应时,消耗
碱多的为弱酸;与Zn或Na2CO3反应产生气体多的是弱酸.
(7)取酸的钠盐溶于水,测溶液的酸碱性.若pH=7,则对
应的酸为强酸;若pH>7,则对应的酸为弱酸.
(8)采用实验证明存在电离平衡.如醋酸溶液中滴入石蕊试
液变红,再加CH3COONH4,颜色变浅.
1.了解强、弱电解质的概念.
2.了解弱电解质在水溶液中的电离平衡.
3.了解水的电离、离子积常数.电解质:在水溶液中或熔融状态下能够导电的化合物。非电解质:在水溶液中和熔融状态下都不能够导电的化合物。复习(酸、碱、盐、金属氧化物、水)(大多数有机物、非金属氧化物、某些非金属氢化物)练习:下列物质中,属于电解质的是_____________,属于非电解质的是__________,能导电的是_________,
A 、二氧化硫 B 、氨气 C 、铜 D、 硫酸钡晶体 E、硫酸 F、甲烷 G、饱和食盐水 H、 蔗糖 I 、乙醇 J、熔融的氯化钠 K、冰醋酸 L、氧化钠D E J KLA B F H I C G J一、电解质和非电解质注意电解质非电解质化合物纯净物物 质混合物单 质强电解质
弱电解质练习1:下列物质的水溶液能导电,但属于
非电解质的是( )
A.CH3CH2COOH B.Cl2
C.NH4HCO3 D.SO2D 1.醋酸和盐酸是常见的两种酸,根据你的经验,你认为它们的电离程度有无差异?请说出你的理由。
2.你能设计实验验证你的猜想吗?请写出实验方案并与同学交流。
3.若按如下方案(或按你自己设计的方案)进行实验,请记录实验现象。
(1)测量物质的量浓度均为1mol·L-1的盐酸和醋酸的pH。
(2) 在两只锥形瓶中分别加入等体积、物质的量浓度均为1mol·L-1 的盐酸和醋酸,在两个气球中分别加入经砂纸打磨过的长度相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察、比较气球鼓起的快慢等现象,将实验现象和你对实验现象的解释填入表3-1。【实验探究反应剧烈反应较慢PH较小(0)PH较大(2.4)实验3-1现象分析:镁无论是与盐酸还是与醋酸反应,其实质都是与溶液中的____反应
镁与盐酸反应比镁与醋酸反应剧烈,说明 ________________
反应剧烈程度的不同,是由于溶液中的_____不同而引起的
pH (盐酸)< pH( 醋酸),证明_____________________H+H+浓度c( H+盐酸)> c( H+醋酸) c( H+盐酸)> c( H+醋酸) 实验结果:相同浓度的盐酸与醋酸,其溶液中
c( H+盐酸)> c( H+醋酸) 。
说明:HCl和CH3COOH的电离程度不同。
盐酸与醋酸在水中的电离示意图观察两种溶液中溶质微粒有多少种?盐酸在水中的电离示意图醋酸在水中的电离示意图说明 HCl分子在水中完全电离
醋酸分子在水中部分电离 HCl=Cl-+H+HCl+H2O=Cl-+H3O+CH3COOH
CH3COO-+H+CH3COOH +H2O
CH3COO-+H3O+H++H2O H3O+二、强电解质和弱电解质强电解质:在水溶液中能全部电离成 离子的电解质。弱电解质:在水溶液中只部分电离成 离子的电解质。1、定义HCl = H++ Cl-HCl+H2O=Cl-+H3O+CH3COOH +H2O
CH3COO-+H3O+二、强电解质和弱电解质电解质强电解质强碱大部分盐强酸弱电解质 弱碱弱酸水H2SO4 HCl HNO3 HBr HI HClO4NaOH KOH Ca(OH)2 Ba(OH)2CH3COOH HF H2S HClO H3PO4 H2SO3 H2SiO3NH3·H2O Al(OH)3 Fe(OH)3 Cu(OH)2完全电离部分电离离子化合物大部分的盐类强 碱共价化合物强 酸弱 酸弱 碱 水弱
电
解
质强电解质离子型氧化物电解质非
电
解
质多数有机物某些非金属氧化物化合物小结:强弱电解质与结构的关系 下列电解质中, ① NaCl、 ② NaOH,
③ NH3·H2O、 ④ CH3COOH, ⑤ BaSO4 、
⑥ AgCl 、 ⑦ Na2O 、 ⑧ K2O, ⑨ H2O
哪些是强电解质,那些是弱电解质?强电解质: ① ② ⑤ ⑥ ⑦ ⑧弱电解质:③ ④ ⑨练习与实践 电解质溶于水或者受热熔化时,离解成自由移动的离子的过程叫做电离。三、电解质的电离1、电离2、电离方程式用来表示电离过程的式子叫做电离方程式。3、电离方程式的书写: (1)式子左边用电离物质的化学式表示,右边用离子符号表示。
(2)强电解质用“=”表示电离过程,弱电解质用“ ” 表示电离过程。电离方程式书写:(4)多元弱碱则一步书写.
如: Cu(OH)2 Cu2+ + 2OH-(3)多元弱酸的电离要分步。
写出H3PO4在水溶液中的电离方程式H3PO4H+ + H2PO4- (1)H2PO4-H+ + HPO42- (2)HPO42-H+ + PO43- (3)试写出NaHSO4、NaHCO3的在水溶液中及熔融状态下的电离方程式?在水溶液中:NaHSO4=Na+ + H+ + SO42-
NaHCO3=Na+ + HCO3-
HCO3- H+ + CO32-熔融状态:NaHSO4=Na+ + HSO4-另外,氢氧化铝双向电离:
H++AlO2-+H2O Al(OH)3 Al3++3OH- NaHCO3=Na+ + HCO3- 完全电离部分电离不可逆过程可逆过程电离方程式用等号电离方程式用可逆符号离子分子、离子离子符号或化学式分子式强酸、强碱、多数盐、
部分碱性氧化物弱酸、弱碱、水强电解质与弱电解质的比较练习1. 写出下列物质的电离方程式
(1) HClO
(2) KHSO3
(3) CaCO3
(4) Fe(OH)2
H++ClO-=K++HSO3-=Ca2++CO32-Fe2++2OH-练习2:1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
①开始反应时产生氢气的速率
②最终收集到的氢气的物质的量
硫酸>盐酸>醋酸硫酸>盐酸=醋酸1.强电解质溶液离子浓度大,而弱电解质溶液离子浓度小,是否正确?为什么?
2.强电解质溶液导电能力大,而弱电解质溶液导电能力小,是否正确?为什么? 问题探究 溶液的导电能力取决于溶液中总离子
浓度的大小。因此强电解质的导电能力不 一定比弱电解质强。在同一浓度时,强电解质一定比弱电解质的导电能力强。 问题结论 你能解释下列事实吗?部分电器外壳上有禁止触摸标记 2.电解水制H2、02时,需要向水中加入少量的Na0H溶液或H2SO4溶液。1.潮湿的手触摸正在工作的电器,可能会发生触电事故。手上的汗水中含有电解质,使水溶液具有较强的导电能力 纯水的导电能力太弱,加入NaOH或H2SO4可使溶液中离子浓度增大,导电能力增强。 DDBD1.下列关于强弱电解质的叙述错误的是 ( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电
能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其
导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电B解析:强电解质和弱电解质是依据电离程度划分的,电解质的强弱和其溶液的导电能力强弱没有必然的对应关系,所以错误的叙述是B项.D项如熔融的氯化钠导电,而液态纯硫酸不导电.第二课时 弱电解质的电离醋酸在电离过程中各微粒浓度的变化1、弱电解质的电离 CH3COOH CH3COO - + H+00最大不变不变不变画出这个过程的V~t图吗?反应速率V(电离)V(结合)V(电离) = V(结合) 电离平衡状态弱电解质电离平衡状态建立示意图时间2、电离平衡状态建立电离平衡是一种
化学平衡电离平衡状态是指
在一定条件下(如温度、浓度等)的弱电解质的溶液中,
弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,
溶液中各分子、离子的浓度保持不变的状态。 前提实质标志 3.定义:4、特点:电离平衡是一种动态平衡 条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子 条件改变时,电离平衡发生移动。 弱电解质的电离①逆:
②等:
③动: ④定:
⑤变: 思考与交流(教材p41)根据化学平衡理论,分析一元弱酸(设为HA)、一元弱碱(设为BOH)的电离平衡过程,并完成下列问题:
1)、写出弱酸、弱碱的电离方程式:
2)、结合图3-3填写下表00最大最大0不变不变不变最大达到电离平衡时影响电离平衡的因素①温度②浓度③同离子效应④化学反应内因:电解质本身的性质。
通常电解质越弱电离程度越小。外
因当外界条件改变时符合“勒夏特列原理”电离过程是吸热过程,升高温度,平衡向电离方向移动 当电离达到平衡时,加水稀释向电离的方向移动,电离程度增大,增加弱电解质浓度,向电离的方向移动,但电离程度减小,加入同弱电解质电离所产生的离子相同离子,电离平衡向逆方向移动加入能与弱电解质电离产生的离子反应的物质时,使电离平衡向电离方向移动 例:在氨水中存在怎样的电离平衡?若向其中分别加入:
①升高温度 ②加氨气
③水 ④ NH4Cl溶液
⑤NaOH溶液 ⑥适量的盐酸
对上述电离平衡有什么影响?思考与讨论: NH3+H2O NH3·H2O NH4+ + OH -练习1完成表格:正向增大增大减小逆向增大减小增大正向减小增大减小逆向减小增大增大正向增大增大增大正向减小减小减小增大减小增大增大减小减小 0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动练习2B1.弱电解质加水稀释时,电离程度_____,离子浓度______? (填变大、变小、不变或不能确定)画出用水稀释冰醋酸时离子浓度、导电能力随加水量的变化曲线。
变大不能确定 导电能力探究讨论例:冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如下变化关系:试回答:a﹥c﹥ b C 相等⑴“0”点导电能力为0的理由是: ⑵a、b、c三点对应溶液的[H+]值由大到小的顺序是 ⑶a、b、c三点中电离程度最大的是 。电离平衡常数的关系 .①加碱②加碳酸钠③加镁或锌
第三课时三、电离平衡常数(K)
看课本自学相关内容并思考:
(1)什么叫电离平衡常数?
(2)电离平衡常数的化学含义是什么?
(3)怎样用电离平衡常数比较弱电解质的相对强弱?
(4)影响电离平衡常数的因素是什么?弱电解质电离程度相对大小的参数一
1、电离平衡常数(K)对于一元弱酸 HA H++A-,平衡时对于一元弱碱 MOH M++OH-,平衡时2、意义:K值越大,电离程度越大,相应酸 (或碱)的酸(或碱)性越强。K值只随温度变化。多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……,为什么? 多元弱酸是分步电离的,K1》K2》K3…..
(一般要相差105)。
3、对于多元酸:多元弱酸的酸性由第一步电离决定。第二步和第三步的电离分别受到第一步和第二步、第三步的抑制。酸性:醋酸>碳酸>硼酸
电离常数:醋酸>碳酸>硼酸 探究活动比较它们的相对强弱4、电离常数的应用草酸>磷酸>柠檬酸>碳酸 A>BA>BA=B1)、等体积,等浓度的盐酸和醋酸2)、体积、PH相同的盐酸(A)与醋酸(B)分别与锌反应A
在相同条件下,产生H2的体积 。
(相等、不相等)不相等相等练习(1)相同温度、相同浓度的一元强酸和一元弱酸,导电能力弱
的为弱酸.
(2)相同浓度的一元强酸与弱酸,强酸的pH小.如0.01 mol/L
的酸HA溶液pH>2,说明酸HA在水溶液中没有完全电离,
HA是弱酸;0.01 mol/L的酸HB溶液pH=2,说明酸HB是强酸.
(3)相同pH的强酸、弱酸分别加水稀释相同的倍数,溶液的pH
变化小的是弱酸,变化大的是强酸.
(4)将pH相等的一元强酸和一元弱酸溶液稀释,稀释后溶液的pH
仍然相等,则加水多的为弱酸.2.根据强、弱电解质的定义或强、弱电解质的比较进行判断问题:如何证明某酸为弱酸?(5)向相同pH的强酸、弱酸中分别加该酸的钠盐,溶液的pH
增大的是弱酸,几乎不变的是强酸.
(6)pH相同,体积相同的强酸和弱酸分别与碱反应时,消耗
碱多的为弱酸;与Zn或Na2CO3反应产生气体多的是弱酸.
(7)取酸的钠盐溶于水,测溶液的酸碱性.若pH=7,则对
应的酸为强酸;若pH>7,则对应的酸为弱酸.
(8)采用实验证明存在电离平衡.如醋酸溶液中滴入石蕊试
液变红,再加CH3COONH4,颜色变浅.
