人教版高中化学必修2 2.1化学能与热能 课件:31张PPT
文档属性
| 名称 | 人教版高中化学必修2 2.1化学能与热能 课件:31张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 00:00:00 | ||
图片预览







文档简介
课件31张PPT。1第二章 化学反应与能量第一节 化学能与热能磷的
燃烧氨的
燃烧[补充实验]镁条在空气中的燃烧化学反应中的能量变化不仅表现为热量的变化,也可以有其他形式,如光能、电能等 任何化学变化一定伴有能量变化,能量变化的形式有多种,但主要以化学能与热能的转变为主,
所以:若忽略其他能量形式变化,
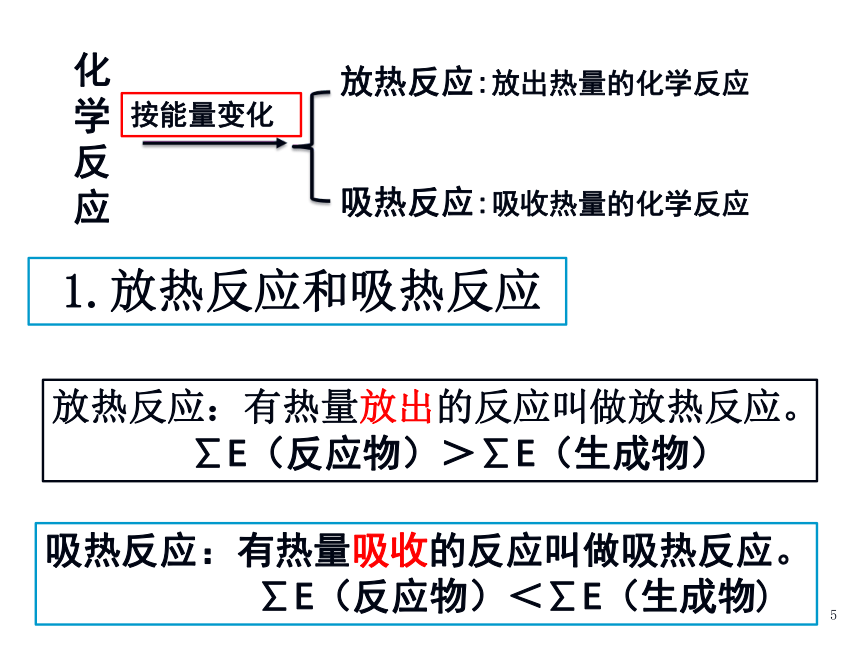
则:反应中吸收/放出能量≈吸收/放出热量化学能与热能的相互转化示例实验2-1 盐酸与铝片反应 实验2-2 氢氧化钡晶体与氯化铵反应 该反应是放热反应。有气泡放出,温度升高有刺激性气味,烧杯壁变冷,玻璃片与烧杯粘在一起,混合物呈糊状该反应是吸热反应。Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 实验2-3 盐酸与氢氧化钠反应 混合后溶液比原两种溶液的温度高该反应是放热反应。5 1.放热反应和吸热反应放热反应:有热量放出的反应叫做放热反应。
∑E(反应物)>∑E(生成物)吸热反应:有热量吸收的反应叫做吸热反应。
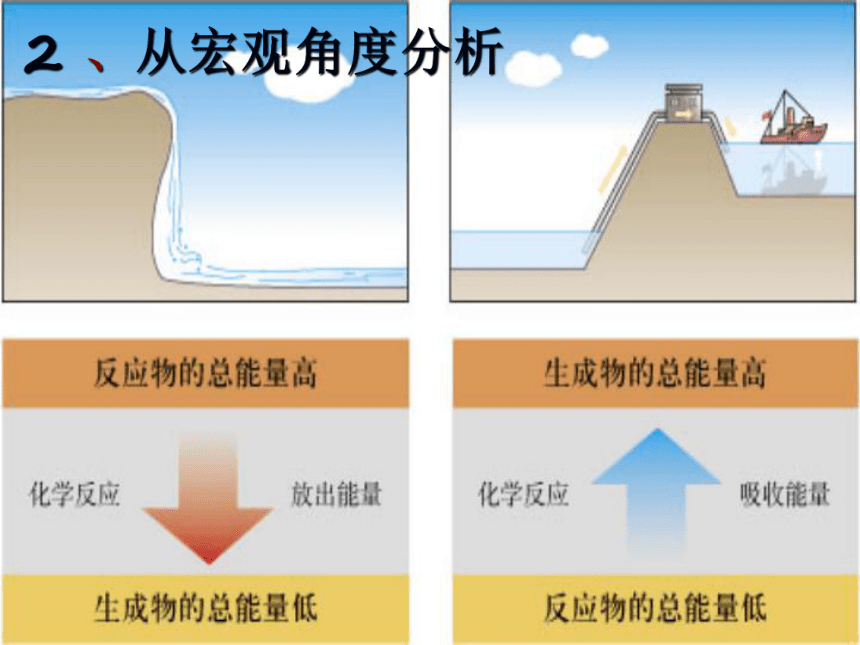
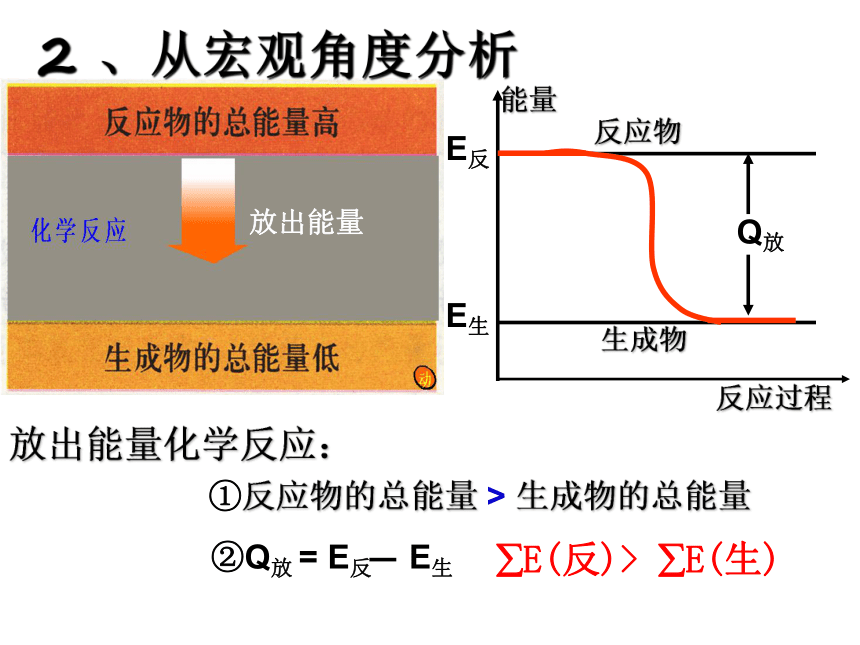
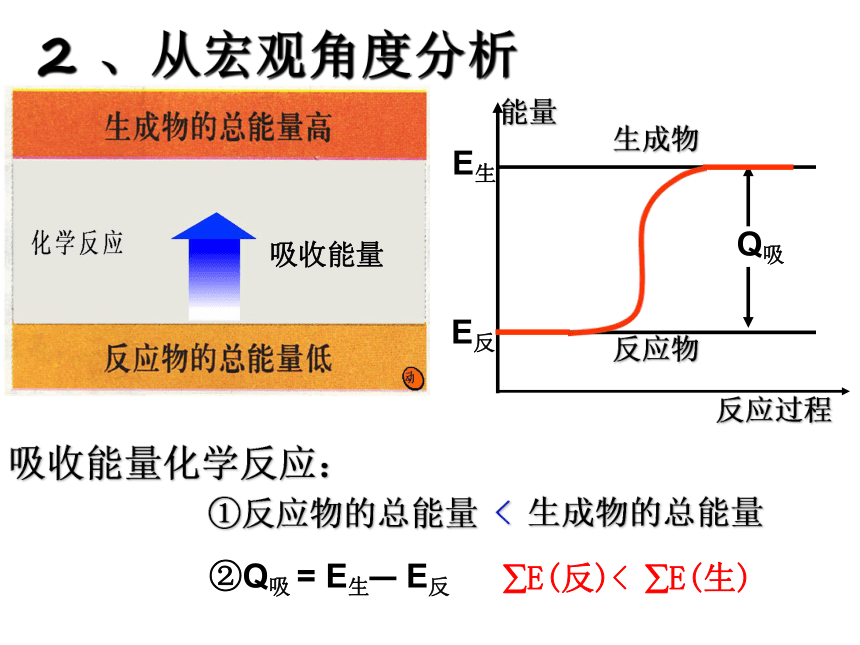
∑E(反应物)<∑E(生成物)2 、从宏观角度分析放出能量能量反应过程反应物生成物E生E反Q放放出能量化学反应:①反应物的总能量 > 生成物的总能量?E(反)> ?E(生)2 、从宏观角度分析能量反应过程反应物生成物E生E反Q吸吸收能量化学反应:①反应物的总能量 < 生成物的总能量吸收能量?E(反)< ?E(生)2 、从宏观角度分析判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.氧化钙与水的反应。
3.甲烷在氧气中的燃烧
4.炸药爆炸
5.Ba(OH)2·8H2O和NH4Cl的反应
Ba(OH)2 8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3(g)+10H2O(l)
6.高温煅烧石灰石(主要成分是CaC03)制生石灰(CaO)。
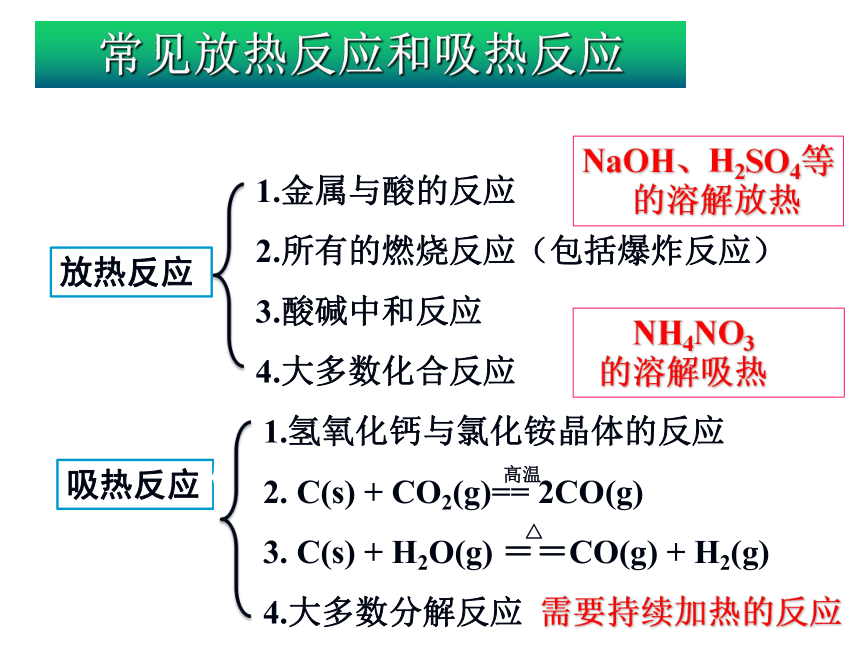
7.高温下木炭与二氧化碳反应生成一氧化碳C(s)+CO2 (g)2CO(g)实际题目怎样判断1.金属与酸的反应
2.所有的燃烧反应(包括爆炸反应)
3.酸碱中和反应
4.大多数化合反应需要持续加热的反应NaOH、H2SO4等
的溶解放热 NH4NO3
的溶解吸热常见放热反应和吸热反应1.需要加热的反应一定就是吸热反应吗?
反应条件(加热)和反应吸放热是否有必然的联系?答:需要加热的反应不一定就是吸热反应。
因需要加热才能进行的反应可能是放热反应。如铝热反应、燃烧反应等(加热启动反应)。
只有那些需要持续加热才能维持的反应才是吸热反应。
所以:反应条件(加热)和反应吸放热没有必然的联系。2.能自发(自动发生)的反应一定是放热反应吗?答:能自发的反应不一定是放热反应,如吸热反应
Ba(OH)2· 8H2O与NH4Cl的反应常温下可自发进行! 关于吸热反应和放热反应,下列说法中错误的是 ( )
A.需要加热才能进行的化学反应一定是吸热反应
B.化学反应中能量变化,除了热量外,还可以是光能、电能等
C.化学反应过程中的能量变化,也服从能量守恒定律
D.反应物的总能量高于生成物的总能量时,发生放热反应A(如铝热反应为放热反应)1、化学反应的本质:旧键断裂,新键形成的过程。释放能量862kJ
吸收能量679kJ,
故反应最终放热
Q=862KJ-679KJ=183KJ。 436KJ/mol243KJ/mol431KJ/mol吸热放热反应物中化学键断裂吸收的能量>形成化学键放出的能量,吸热反应反应物中化学键断裂吸收的能量<形成化学键放出的能量,放热反应 二、化学键与化学反应中能量变化的关系符号:△H单位:kJ·mol-1恒温、恒压下,化学反应过程中所吸收或释放的热量称为反应的焓变。1、反应热:2、焓变:三、反应热和焓变在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量.放出能量862.6kJ
吸收能量679.1kJ,
故反应最终放热。 436KJ/mol243KJ/mol431KJ/mol吸热放热放出热量为431kJ×2-(436kJ+243kJ)=183kJ△H = -183KJ/mol请计算△H 值为多少?一、反应热和焓变△H淘宝能量变化值为反应物与生成物化学键键能之差的绝对值。题2 已知下列化学键的键能:3H2 + N2 === 2 NH33H-H求该条件下合成氨反应生成1mol氨放出多少能量?解析:Q吸=3mol×aKJ/mol+1mol×bKJ/mol=(3a+b)KJQ放=2mol×3×cKJ/mol=6cKJ故该反应生成1mol氨放出能量为Q放: 已知键能: N≡N 946KJ/mol, H-H 436KJ/mol,
H-N 391KJ/mol,写出合成氨反应的热化学方程式。N2(g)+3H2(g)==2NH3(g) △H=-92kJ·mol-1练习:写出下列反应的热化学方程式(25℃,101kPa时).
放热反应:ΔH<0或 ΔH为“-”吸热反应:ΔH>0 或ΔH为“+”放热△H<0ΔH=生成物总能量-反应物总能量吸热△H>019 3.热化学方程式:(1)定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。例如:
H2(g)+Cl2(g) = 2HCl(g);△H = -183KJ/mol怎样来表示化学反应中放出或吸收的热量呢?2H2(g)+ O2(g)=2H2O(l) △H=-571.6KJ·mol-1H2(g)+1/2 O2(g)=H2O(l) △H=-285.8KJ·mol-11、化学计量数的意义2H2 + O2 = 2H2O 1、热化学方程式中的化学计量数可以是整数,也可以是分数。它表示的是物质的量. 2、△H与参加反应的物质的物质的量有关,化学计量数加倍,△H也要加倍。热化学方程式与化学方程式的差别2、聚集状态2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ·mol-12H2(g)+O2(g)=2H2O(g) △H=-483.6KJ ·mol-13、热化学方程式中必须注明物质的聚集状态:气态(g)、液态(l)、固态(s)、溶液(aq)反应的焓变与反应物及生成物的聚集状态有关,聚集状态与温度、压强有关,4、热化学方程式中必须注明温度、压强(若不注明则表示在250C(298K)、101kPa下).[思考]N2(g)+3H2(g)=2NH3(g);△H = -92.38kJ/mol
298K,101kPa时,取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,测得反应放出的热量总是少于92.38kJ?该反应是可逆反应,在密闭容器中进行该反应将达到平衡状态, 1 mol N2(g)和3 mol H2(g)不能完全反应生成2 mol NH3(g),因而放出的热量总小于92.38kJ(4)注明反应的温度和压强(若不注明则表示在298K、101kPa下) ;7、热化学方程式书写步骤【例题】N2 (g)与H2 (g)反应生成1molNH3 (g) ,放出 46.1KJ热量。(1)正确写出配平的化学方程式;(2)注明反应物和生成物的状态;(3)标明反应的焓变△H(单位KJ/mol,△H的数值与系数成比例)1、下列热化学方程式书写正确的是A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol 练习:C2、典型例题 判断热化学方程式的正误;(2015年)已知在1×105 Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出 484kJ热量,下列热化学方程式
正确的是 A.H2O(g)=H2 (g)+1/2O2 (g) ;ΔH=+242kJ·mol-1 B.2H2(g)+O2(g)=2H2O(l) ;ΔH=-484kJ·mol-1 C.H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=+242kJ·mol-1 D.2H2 (g)+O2 (g)=2H2O(g) ;ΔH=+484kJ·mol-1
A注意:①物质聚集状态②吸放热与ΔH 的“+”、“-”
③吸放热的量与系数对应化学反应原理P62、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol?1):P—P:198 P—O:360 O=O:498则反应P4(白磷)+3O2= P4O6的反应热△H为 ( )
A.-1638 kJ·mol?1
B.+1638 kJ·mol?1
C.-126 kJ·mol?1
D.+126 kJ·mol?1A[练习1]写出下列反应的热化学方程式: 1、 1molC(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收131.3KJ热量。[练习2]写出下列反应的热化学方程式:
2、 1molNaOH(aq)与1molHCl(aq)发生
中和反应,放出48.6KJ热量。对热化学方程式H2(g)+ I2(g)=2HI(g);△H = +26kJ·mol-1的叙述中,正确的是 ( )
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量
D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量练习:1. 下列反应属于放热反应的是( )
A. NaOH与HCl反应 B. C和CO2共热
C. 碳酸钙的分解 D. 制备水煤气的反应 巩固练习A2.已知1molH2反应:H2(g)+Cl2(g)=2HCl(g) 放热Q1 ;
H2(g)+Br2(g)=2HBr(g) 放热Q2
有关上述反应的叙述正确的是 ( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.1 mol HBr(g)的化学能小于1 mol HCl(g)的化学能 A3.在相同温度和压强下,将等质量的硫分别在足量的
纯氧气和空气中燃烧,设前者放出的能量为Q1,后者
放出的能量为Q2,则下列对Q1和Q2的相对大小的判断
正确的是( )
A.Q1=Q2 B.Q1>Q2 C.Q1<Q2 D.无法判断 纯氧中: S(s)+O2(g)=SO2(g) + Q1
空气中: S(s)+O2(g)=SO2(g) + Q2A变式:在相同温度和压强下,将等质量的硫分别在足量的纯氧气和空气中燃烧,设前者放出的热量为Q1,后者放出的热量为Q2,则下列对Q1和Q2的相对大小的判断正确的是( )
A.Q1=Q2 B.Q1>Q2 C.Q1<Q2 D.无法判断 C?纯氧中燃烧更剧烈,释放热能更多。A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2分析:反应物存储能量相同,生成物由于气态水存储能量比液态水要多,∴Q2>Q14.相同条件下,比较下列反应放出热量Q1、Q2的大小B: S(g)+O2(g)=SO2(g)+Q1
S(S)+O2(g)=SO2(g)+Q2C: C(S)+1/2O2(g)=CO(g)+Q1
C(S) + O2(g) = CO2(g)+Q2D: H2(g)+Cl2(g)=2HCl(g)+Q1
1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2Q1﹤Q2Q1>Q2Q1﹤Q2Q1>Q2
燃烧氨的
燃烧[补充实验]镁条在空气中的燃烧化学反应中的能量变化不仅表现为热量的变化,也可以有其他形式,如光能、电能等 任何化学变化一定伴有能量变化,能量变化的形式有多种,但主要以化学能与热能的转变为主,
所以:若忽略其他能量形式变化,
则:反应中吸收/放出能量≈吸收/放出热量化学能与热能的相互转化示例实验2-1 盐酸与铝片反应 实验2-2 氢氧化钡晶体与氯化铵反应 该反应是放热反应。有气泡放出,温度升高有刺激性气味,烧杯壁变冷,玻璃片与烧杯粘在一起,混合物呈糊状该反应是吸热反应。Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 实验2-3 盐酸与氢氧化钠反应 混合后溶液比原两种溶液的温度高该反应是放热反应。5 1.放热反应和吸热反应放热反应:有热量放出的反应叫做放热反应。
∑E(反应物)>∑E(生成物)吸热反应:有热量吸收的反应叫做吸热反应。
∑E(反应物)<∑E(生成物)2 、从宏观角度分析放出能量能量反应过程反应物生成物E生E反Q放放出能量化学反应:①反应物的总能量 > 生成物的总能量?E(反)> ?E(生)2 、从宏观角度分析能量反应过程反应物生成物E生E反Q吸吸收能量化学反应:①反应物的总能量 < 生成物的总能量吸收能量?E(反)< ?E(生)2 、从宏观角度分析判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.氧化钙与水的反应。
3.甲烷在氧气中的燃烧
4.炸药爆炸
5.Ba(OH)2·8H2O和NH4Cl的反应
Ba(OH)2 8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3(g)+10H2O(l)
6.高温煅烧石灰石(主要成分是CaC03)制生石灰(CaO)。
7.高温下木炭与二氧化碳反应生成一氧化碳C(s)+CO2 (g)2CO(g)实际题目怎样判断1.金属与酸的反应
2.所有的燃烧反应(包括爆炸反应)
3.酸碱中和反应
4.大多数化合反应需要持续加热的反应NaOH、H2SO4等
的溶解放热 NH4NO3
的溶解吸热常见放热反应和吸热反应1.需要加热的反应一定就是吸热反应吗?
反应条件(加热)和反应吸放热是否有必然的联系?答:需要加热的反应不一定就是吸热反应。
因需要加热才能进行的反应可能是放热反应。如铝热反应、燃烧反应等(加热启动反应)。
只有那些需要持续加热才能维持的反应才是吸热反应。
所以:反应条件(加热)和反应吸放热没有必然的联系。2.能自发(自动发生)的反应一定是放热反应吗?答:能自发的反应不一定是放热反应,如吸热反应
Ba(OH)2· 8H2O与NH4Cl的反应常温下可自发进行! 关于吸热反应和放热反应,下列说法中错误的是 ( )
A.需要加热才能进行的化学反应一定是吸热反应
B.化学反应中能量变化,除了热量外,还可以是光能、电能等
C.化学反应过程中的能量变化,也服从能量守恒定律
D.反应物的总能量高于生成物的总能量时,发生放热反应A(如铝热反应为放热反应)1、化学反应的本质:旧键断裂,新键形成的过程。释放能量862kJ
吸收能量679kJ,
故反应最终放热
Q=862KJ-679KJ=183KJ。 436KJ/mol243KJ/mol431KJ/mol吸热放热反应物中化学键断裂吸收的能量>形成化学键放出的能量,吸热反应反应物中化学键断裂吸收的能量<形成化学键放出的能量,放热反应 二、化学键与化学反应中能量变化的关系符号:△H单位:kJ·mol-1恒温、恒压下,化学反应过程中所吸收或释放的热量称为反应的焓变。1、反应热:2、焓变:三、反应热和焓变在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量.放出能量862.6kJ
吸收能量679.1kJ,
故反应最终放热。 436KJ/mol243KJ/mol431KJ/mol吸热放热放出热量为431kJ×2-(436kJ+243kJ)=183kJ△H = -183KJ/mol请计算△H 值为多少?一、反应热和焓变△H淘宝能量变化值为反应物与生成物化学键键能之差的绝对值。题2 已知下列化学键的键能:3H2 + N2 === 2 NH33H-H求该条件下合成氨反应生成1mol氨放出多少能量?解析:Q吸=3mol×aKJ/mol+1mol×bKJ/mol=(3a+b)KJQ放=2mol×3×cKJ/mol=6cKJ故该反应生成1mol氨放出能量为Q放: 已知键能: N≡N 946KJ/mol, H-H 436KJ/mol,
H-N 391KJ/mol,写出合成氨反应的热化学方程式。N2(g)+3H2(g)==2NH3(g) △H=-92kJ·mol-1练习:写出下列反应的热化学方程式(25℃,101kPa时).
放热反应:ΔH<0或 ΔH为“-”吸热反应:ΔH>0 或ΔH为“+”放热△H<0ΔH=生成物总能量-反应物总能量吸热△H>019 3.热化学方程式:(1)定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。例如:
H2(g)+Cl2(g) = 2HCl(g);△H = -183KJ/mol怎样来表示化学反应中放出或吸收的热量呢?2H2(g)+ O2(g)=2H2O(l) △H=-571.6KJ·mol-1H2(g)+1/2 O2(g)=H2O(l) △H=-285.8KJ·mol-11、化学计量数的意义2H2 + O2 = 2H2O 1、热化学方程式中的化学计量数可以是整数,也可以是分数。它表示的是物质的量. 2、△H与参加反应的物质的物质的量有关,化学计量数加倍,△H也要加倍。热化学方程式与化学方程式的差别2、聚集状态2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ·mol-12H2(g)+O2(g)=2H2O(g) △H=-483.6KJ ·mol-13、热化学方程式中必须注明物质的聚集状态:气态(g)、液态(l)、固态(s)、溶液(aq)反应的焓变与反应物及生成物的聚集状态有关,聚集状态与温度、压强有关,4、热化学方程式中必须注明温度、压强(若不注明则表示在250C(298K)、101kPa下).[思考]N2(g)+3H2(g)=2NH3(g);△H = -92.38kJ/mol
298K,101kPa时,取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,测得反应放出的热量总是少于92.38kJ?该反应是可逆反应,在密闭容器中进行该反应将达到平衡状态, 1 mol N2(g)和3 mol H2(g)不能完全反应生成2 mol NH3(g),因而放出的热量总小于92.38kJ(4)注明反应的温度和压强(若不注明则表示在298K、101kPa下) ;7、热化学方程式书写步骤【例题】N2 (g)与H2 (g)反应生成1molNH3 (g) ,放出 46.1KJ热量。(1)正确写出配平的化学方程式;(2)注明反应物和生成物的状态;(3)标明反应的焓变△H(单位KJ/mol,△H的数值与系数成比例)1、下列热化学方程式书写正确的是A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol 练习:C2、典型例题 判断热化学方程式的正误;(2015年)已知在1×105 Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出 484kJ热量,下列热化学方程式
正确的是 A.H2O(g)=H2 (g)+1/2O2 (g) ;ΔH=+242kJ·mol-1 B.2H2(g)+O2(g)=2H2O(l) ;ΔH=-484kJ·mol-1 C.H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=+242kJ·mol-1 D.2H2 (g)+O2 (g)=2H2O(g) ;ΔH=+484kJ·mol-1
A注意:①物质聚集状态②吸放热与ΔH 的“+”、“-”
③吸放热的量与系数对应化学反应原理P62、化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol?1):P—P:198 P—O:360 O=O:498则反应P4(白磷)+3O2= P4O6的反应热△H为 ( )
A.-1638 kJ·mol?1
B.+1638 kJ·mol?1
C.-126 kJ·mol?1
D.+126 kJ·mol?1A[练习1]写出下列反应的热化学方程式: 1、 1molC(石墨)与适量H2O (g)反应生成CO (g)和H2 (g) ,吸收131.3KJ热量。[练习2]写出下列反应的热化学方程式:
2、 1molNaOH(aq)与1molHCl(aq)发生
中和反应,放出48.6KJ热量。对热化学方程式H2(g)+ I2(g)=2HI(g);△H = +26kJ·mol-1的叙述中,正确的是 ( )
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量
D.1molH2(g)与1molI2(g)完全反应放出26kJ的热量练习:1. 下列反应属于放热反应的是( )
A. NaOH与HCl反应 B. C和CO2共热
C. 碳酸钙的分解 D. 制备水煤气的反应 巩固练习A2.已知1molH2反应:H2(g)+Cl2(g)=2HCl(g) 放热Q1 ;
H2(g)+Br2(g)=2HBr(g) 放热Q2
有关上述反应的叙述正确的是 ( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.1 mol HBr(g)的化学能小于1 mol HCl(g)的化学能 A3.在相同温度和压强下,将等质量的硫分别在足量的
纯氧气和空气中燃烧,设前者放出的能量为Q1,后者
放出的能量为Q2,则下列对Q1和Q2的相对大小的判断
正确的是( )
A.Q1=Q2 B.Q1>Q2 C.Q1<Q2 D.无法判断 纯氧中: S(s)+O2(g)=SO2(g) + Q1
空气中: S(s)+O2(g)=SO2(g) + Q2A变式:在相同温度和压强下,将等质量的硫分别在足量的纯氧气和空气中燃烧,设前者放出的热量为Q1,后者放出的热量为Q2,则下列对Q1和Q2的相对大小的判断正确的是( )
A.Q1=Q2 B.Q1>Q2 C.Q1<Q2 D.无法判断 C?纯氧中燃烧更剧烈,释放热能更多。A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2分析:反应物存储能量相同,生成物由于气态水存储能量比液态水要多,∴Q2>Q14.相同条件下,比较下列反应放出热量Q1、Q2的大小B: S(g)+O2(g)=SO2(g)+Q1
S(S)+O2(g)=SO2(g)+Q2C: C(S)+1/2O2(g)=CO(g)+Q1
C(S) + O2(g) = CO2(g)+Q2D: H2(g)+Cl2(g)=2HCl(g)+Q1
1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2Q1﹤Q2Q1>Q2Q1﹤Q2Q1>Q2
