人教版高中化学必修2 2.3 化学反应速率和限度 课件:20张PPT
文档属性
| 名称 | 人教版高中化学必修2 2.3 化学反应速率和限度 课件:20张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 1009.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 00:00:00 | ||
图片预览





文档简介
课件20张PPT。
第二章第三节
化学反应速率和限度
CO第三节第二课时
化学反应的限度
1、认识可逆反应及其特征,了解化学反应的限度,形成化学平衡状态的概念。
2、初步了解化学反应条件的控制
3、培养学生独立思考能力及与人合作的团队精神,激发学生学习兴趣
重点难点:
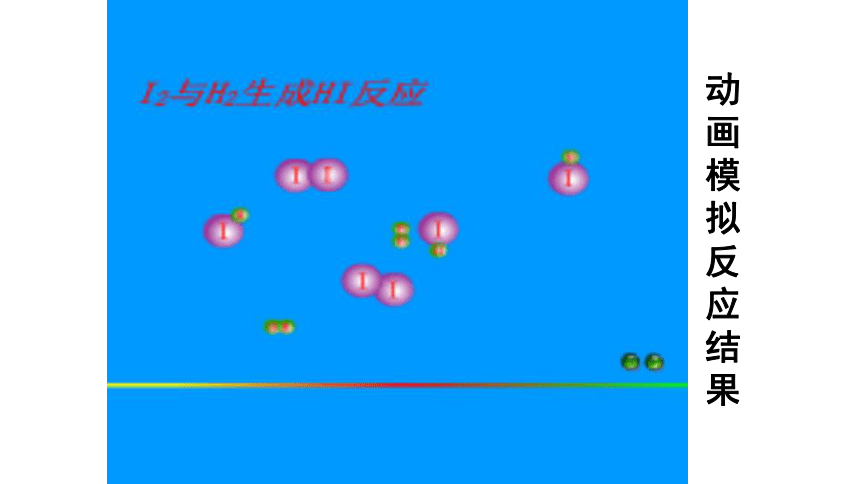
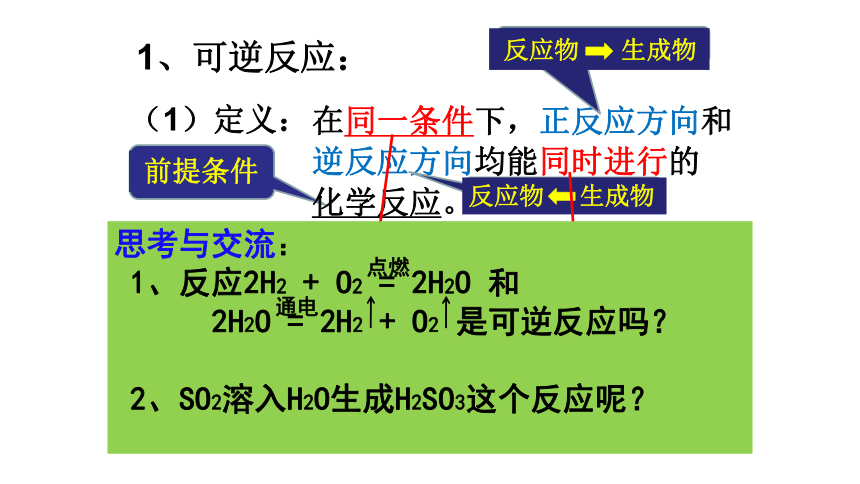
化学反应限度的涵义及有关化学平衡状态的判断。三维目标:动画模拟反应结果1、可逆反应:在同一条件下,正反应方向和逆反应方向均能同时进行的
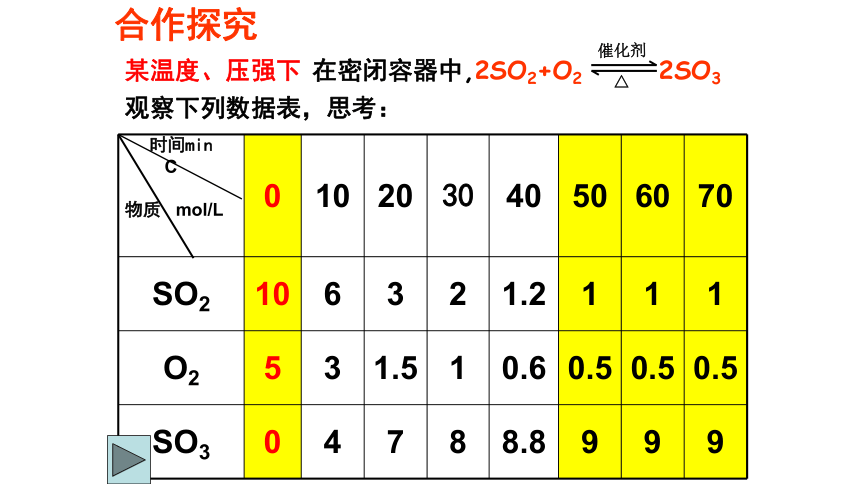
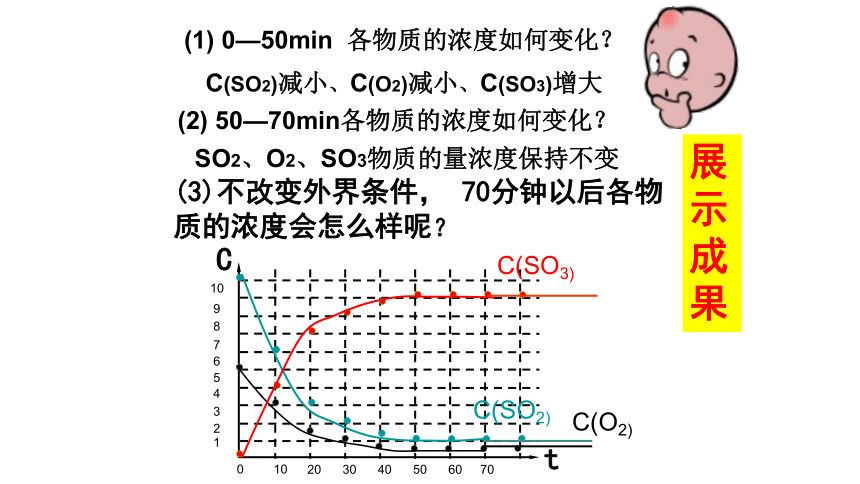
化学反应。(2)特点:(3)表示: (1)定义: ? 同一条件 同时进行某温度、压强下 在密闭容器中,2SO2+O2 2SO3 观察下列数据表,思考:合作探究70CC(SO3)C(SO2)C(O2)t(2) 50—70min各物质的浓度如何变化? (1) 0—50min 各物质的浓度如何变化?C(SO2)减小、C(O2)减小、C(SO3)增大SO2、O2、SO3物质的量浓度保持不变
(3)不改变外界条件, 70分钟以后各物质的浓度会怎么样呢?展示成果二、化学反应的限度1.定义:在——————下化学反应所能达到或完成的——————知识点给定条件最大程度(1)反应刚开始时,由于C(SO2)= , C (O2)= ,C(SO3)= ,所以化学反应速 率V(正)最 ,而V(逆)最 。
(2)0---50min,各物质浓度的变化趋势为: C(SO2) ,C(O2) ,C(SO3) ,从而化学反应速率的变化为V(正) ,V(逆) 。
(3)当反应进行到V (正)与V(逆) 时,反应物、生成物的浓度不再变化(如图50—70min)。
(4)试着在坐标系中画出任一反应物的正、逆反应速率 随时间的变化图像10mol/L5mol/L 0大 小(为零)减小减小增大增大减小 相等
再次合作探究
开始阶段有什么特征?正反应速率最大,v(逆)=0反应速率v(正)v(逆)时间(t)0二、化学反应的限度瞬间过后有什么特征?正逆反应都进行,v(逆) ≠0,v(正)> v(逆) 10一定时间段内有什么特征?V(正)= v(逆) ≠050化学平衡状态70精讲归纳(2)概念:在 ————下,一个————进行到一定程度时,—————和—————相等,反应物和生成物的浓度均保持不变的状态。前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在特点:反应物和生成物的浓度不变2、化学平衡状态二、化学反应的限度给定条件可逆反应逆反应速率正反应速率(3)特征④定:①逆: ③动:⑤变:条件改变,平衡会改变②等: 可逆反应 V正=V逆 V正=V逆≠0,动态平衡。反应物和生成物的浓度一定可逆反应达到平衡状态时,下列说法正确的是( )
A、正、逆反应速率相等,且都为零
B、单位时间内反应物减少的分子数等于生
成物增加的分子数
C、反应物和生成物的浓度相等
D、反应物和生成物的浓度保持不变D小试牛刀 可逆反应的限度都是相同的吗?请同学们认真观察表中数据。
结论:
不同的化学反应,限度不同
相同的化学反应,条件不同时限度也可能 不同
化学反应限度可以通过改变条件而改变。 思考与交流:
阅读教材P52 :提高煤的燃烧效率三、化学反应条件的控制思考与交流:
1:控制化学反应条件的意义?
2:提高煤的燃烧效率可以 采取哪些措施?
二、化学反应条件的控制
1.控制化学反应条件的意义
通过化学反应条件的控制,改变化学反应 和化学反应的 ,促进对人类有利的化学反应,抑制有害的化学反应。
2.“提高煤的燃烧效率”的研究
(1)燃料燃烧的条件
①燃料与 或氧气接触;
②温度达到燃料的 。速率限度空气着火点学以致用(2)提高燃料燃烧效率的措施
①尽可能使燃料 ,提高能量的转化率。 关键是燃料与空气或氧气尽可能_________ ,且空气要 。
②尽可能充分地利用燃料燃烧所释放出的热能,提高 。 充分燃烧充分接触适当过量热能的利用率定义化学反应可逆反应不可逆反应化学平衡状态特征概念建立判断标志你的收获 作业
1.完成学案巩固练习
2.完成对灶具改进的 调查报告特点表示给定条件下的最大限度直观比喻
化学反应的限度
1、认识可逆反应及其特征,了解化学反应的限度,形成化学平衡状态的概念。
2、初步了解化学反应条件的控制
3、培养学生独立思考能力及与人合作的团队精神,激发学生学习兴趣
重点难点:
化学反应限度的涵义及有关化学平衡状态的判断。三维目标:动画模拟反应结果1、可逆反应:在同一条件下,正反应方向和逆反应方向均能同时进行的
化学反应。(2)特点:(3)表示: (1)定义: ? 同一条件 同时进行某温度、压强下 在密闭容器中,2SO2+O2 2SO3 观察下列数据表,思考:合作探究70CC(SO3)C(SO2)C(O2)t(2) 50—70min各物质的浓度如何变化? (1) 0—50min 各物质的浓度如何变化?C(SO2)减小、C(O2)减小、C(SO3)增大SO2、O2、SO3物质的量浓度保持不变
(3)不改变外界条件, 70分钟以后各物质的浓度会怎么样呢?展示成果二、化学反应的限度1.定义:在——————下化学反应所能达到或完成的——————知识点给定条件最大程度(1)反应刚开始时,由于C(SO2)= , C (O2)= ,C(SO3)= ,所以化学反应速 率V(正)最 ,而V(逆)最 。
(2)0---50min,各物质浓度的变化趋势为: C(SO2) ,C(O2) ,C(SO3) ,从而化学反应速率的变化为V(正) ,V(逆) 。
(3)当反应进行到V (正)与V(逆) 时,反应物、生成物的浓度不再变化(如图50—70min)。
(4)试着在坐标系中画出任一反应物的正、逆反应速率 随时间的变化图像10mol/L5mol/L 0大 小(为零)减小减小增大增大减小 相等
再次合作探究
开始阶段有什么特征?正反应速率最大,v(逆)=0反应速率v(正)v(逆)时间(t)0二、化学反应的限度瞬间过后有什么特征?正逆反应都进行,v(逆) ≠0,v(正)> v(逆) 10一定时间段内有什么特征?V(正)= v(逆) ≠050化学平衡状态70精讲归纳(2)概念:在 ————下,一个————进行到一定程度时,—————和—————相等,反应物和生成物的浓度均保持不变的状态。前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在特点:反应物和生成物的浓度不变2、化学平衡状态二、化学反应的限度给定条件可逆反应逆反应速率正反应速率(3)特征④定:①逆: ③动:⑤变:条件改变,平衡会改变②等: 可逆反应 V正=V逆 V正=V逆≠0,动态平衡。反应物和生成物的浓度一定可逆反应达到平衡状态时,下列说法正确的是( )
A、正、逆反应速率相等,且都为零
B、单位时间内反应物减少的分子数等于生
成物增加的分子数
C、反应物和生成物的浓度相等
D、反应物和生成物的浓度保持不变D小试牛刀 可逆反应的限度都是相同的吗?请同学们认真观察表中数据。
结论:
不同的化学反应,限度不同
相同的化学反应,条件不同时限度也可能 不同
化学反应限度可以通过改变条件而改变。 思考与交流:
阅读教材P52 :提高煤的燃烧效率三、化学反应条件的控制思考与交流:
1:控制化学反应条件的意义?
2:提高煤的燃烧效率可以 采取哪些措施?
二、化学反应条件的控制
1.控制化学反应条件的意义
通过化学反应条件的控制,改变化学反应 和化学反应的 ,促进对人类有利的化学反应,抑制有害的化学反应。
2.“提高煤的燃烧效率”的研究
(1)燃料燃烧的条件
①燃料与 或氧气接触;
②温度达到燃料的 。速率限度空气着火点学以致用(2)提高燃料燃烧效率的措施
①尽可能使燃料 ,提高能量的转化率。 关键是燃料与空气或氧气尽可能_________ ,且空气要 。
②尽可能充分地利用燃料燃烧所释放出的热能,提高 。 充分燃烧充分接触适当过量热能的利用率定义化学反应可逆反应不可逆反应化学平衡状态特征概念建立判断标志你的收获 作业
1.完成学案巩固练习
2.完成对灶具改进的 调查报告特点表示给定条件下的最大限度直观比喻
