人教版高中化学必修二 1.1 元素周期表 课件52张PPT
文档属性
| 名称 | 人教版高中化学必修二 1.1 元素周期表 课件52张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 09:58:41 | ||
图片预览






文档简介
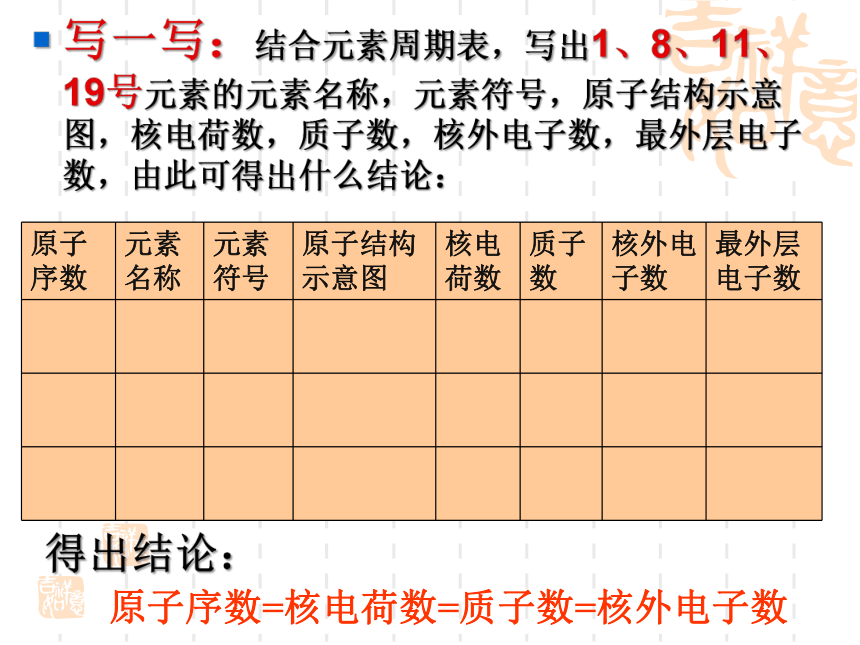
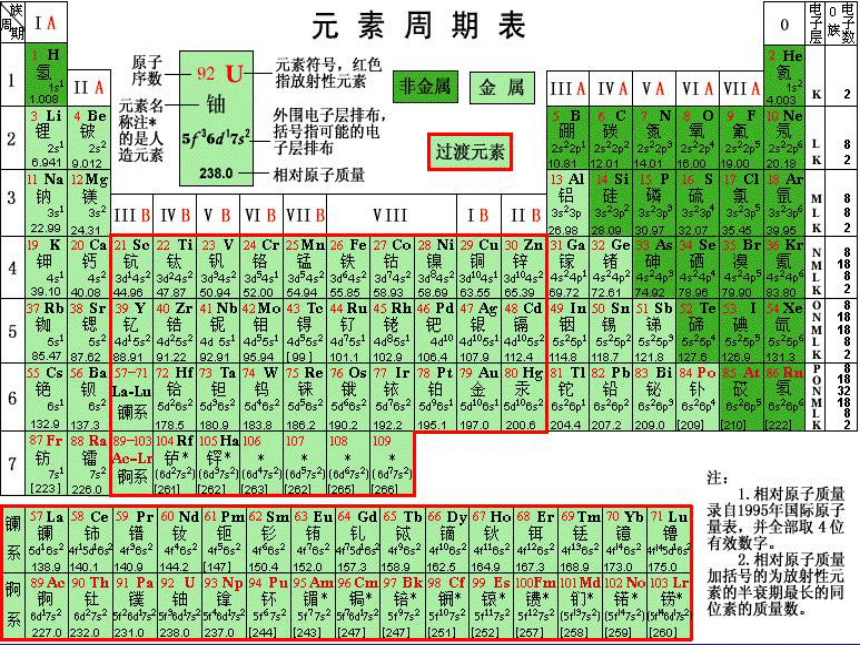
课件52张PPT。元素周期表写一写:结合元素周期表,写出1、8、11、19号元素的元素名称,元素符号,原子结构示意图,核电荷数,质子数,核外电子数,最外层电子数,由此可得出什么结论:得出结论:原子序数=核电荷数=质子数=核外电子数(一)元素周期表的历史1.第一张元素周期表(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
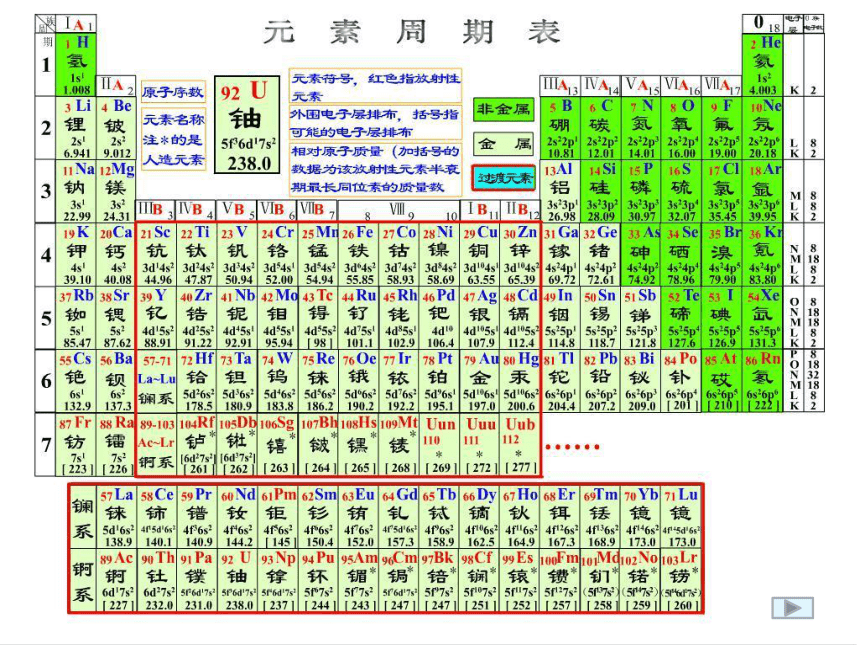
(5)意义:俄国化学家——门捷列夫1869年将元素按照相对原子质量由小到大依次排列揭示了化学元素的内在联系——里程碑2.现行元素周期表(1)排序依据:
(2)原子序数:
(3)结构特点:
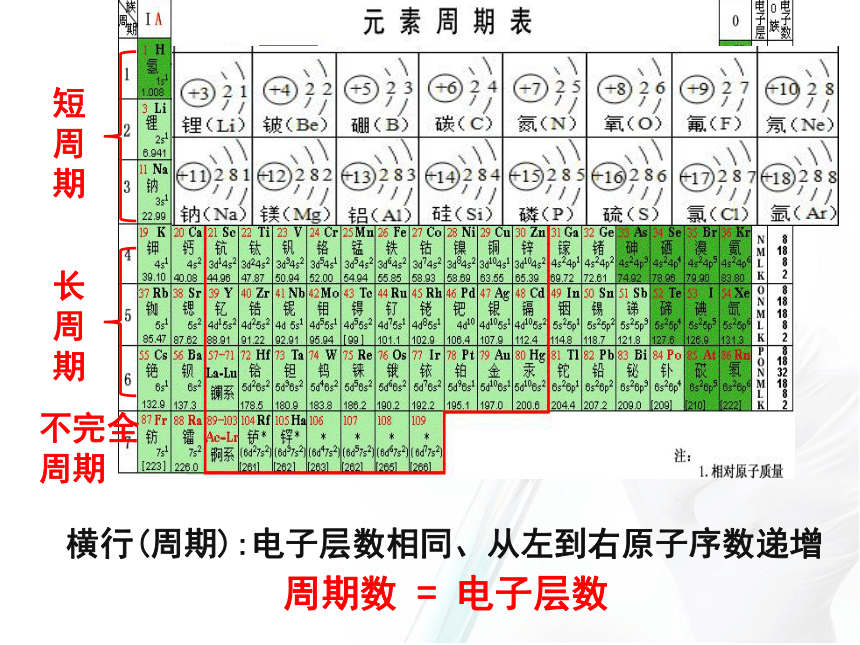
原子的核电荷数按照元素在周期表中的顺序给元素编号将化学性质相似的元素放在一个纵行?3、 元素周期表中有多少横行,多少周期? 多少纵行,多少族?阅读并思考1、元素周期表的编排原则 ?2、 在元素周期表中横行和纵行又称为什么? (二)元素周期表的结构1、横行( 个)—⑴具有相同的电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期。 周期(7个)7元素周期表的编排原则 短
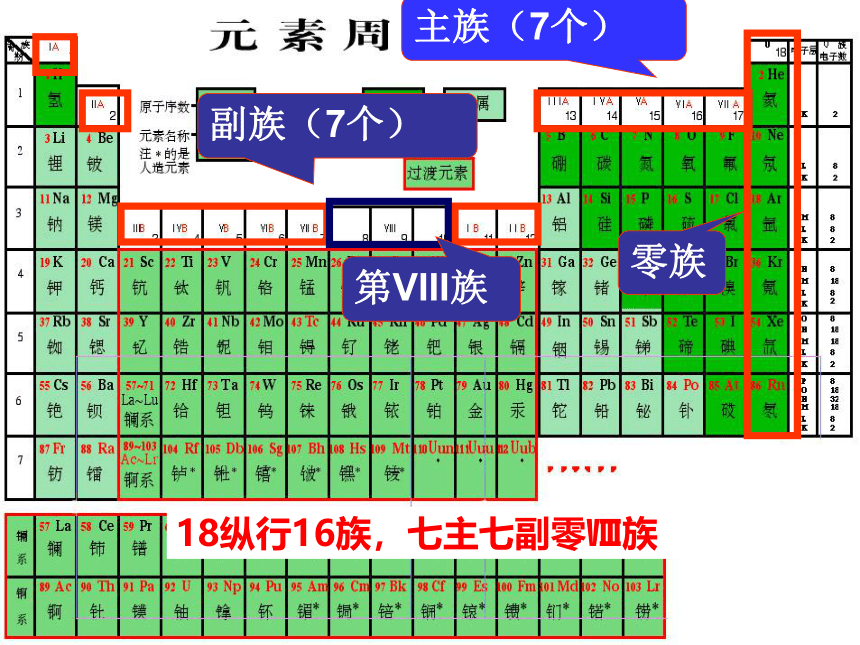
周
期长
周
期不完全
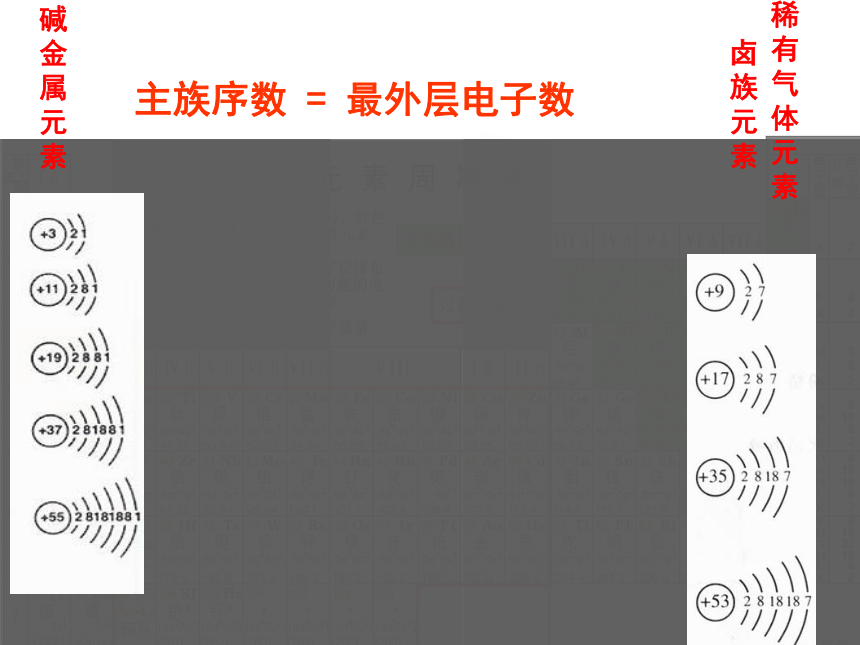
周期横行(周期):电子层数相同、从左到右原子序数递增周期数 = 电子层数2.纵行( 个)—族(16个)18具有相同最外层电子数而又按原子序数递增顺序排列的 一系列元素成为一族。18纵行16族,七主七副零Ⅷ族主族序数 = 最外层电子数 碱
金
属
元
素卤
族
元
素稀
有
气
体
元
素短周期 ( 周期) 长周期 ( 周期)周期( 个) 族( 个) 元素周期表 族 ( 个) 族 ( 个) 族( 个) 个纵行 族 ( 个) 元素三短四长一不全;七主七副零Ⅷ族 个横行 个纵行周期序数=主族序数=元素周期表的结构771618不完全周期 ( 周期 )1、2、34、5、6、77主副VIII零7711IA ~ VIIAIB ~ VIIB8,9,10三稀有气体电子层数最外层电子数课堂小结 已知某主族元素的原子结构示意图如下,
判断其位于第几周期,第几族? 元素在周期表中的位置由其所在周期和族共同决定,而周期由电子层数决定,主族数由最外层电子数决定。 1、陶瓷家族中有“全能冠军”之称的工程陶瓷由氮元
素与X元素组成,其化学式为X3N4。已知X为第三周
期元素且原子最外层有4个电子,则X元素为
A.C B.Al
C.O D.Si课堂练习D AC 2、下列元素中,原子最外层电子数与其电子层数相同
的有
A.H B.Na C.Al D.Si4、某元素的原子结构示意图为,下列关于该原子的
说法正确的是
A.质子数为7
B.最外层电子数为2
C.核外电子数为7
D.核外有3个电子层3、已知某短周期元素原子的第三电子层上排布有5个
电子,则该元素在周期表中位于
A.第二周期ⅣA族 B.第二周期ⅤA族
C.第三周期ⅣA族 D.第三周期ⅤA族课堂练习D D 5、某元素位于第三周期第ⅥA族。下列叙述不正确的是
A.该元素是非金属元素
B.该元素原子的核电荷数为16
C.该元素原子核外有3个电子层
D.该元素原子容易失去最外层电子6、蓝宝石的主要成分为第ⅢA族元素的氧化物,该氧化
物为
A.A12O3 B.CuO
C.Fe2O3 D.MgO课堂练习D A 1、 熟记前20号元素的元素符号,原子序数及在元素周期表中的位置。课外作业 2、 步步高P1-2填写下表:第二课时
元素的性质与
原子结构元素周期表一、碱金属元素锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)放射性元素 3LiNaKRbCs 11 19 37 5511111 2 3 4 5 6通过观察碱金属的原子结构示意图,你能发现碱金属元素的原子结构有什么共同之处呢? 完成P5的表格:一、碱金属元素1、原子结构①相同点:碱金属元素原子结构的 相同, 都为 ,容易失去电子。
最外层电子数1个碱金属元素的化合价都为 。0或+1②递变性:从Li到Cs:核电荷数依次 ;
电子层数逐渐 ;
原子半径逐渐 ;
原子核对最外层电子的吸引能力逐渐 ;
增加增多增大减弱碱金属的主要物理性质2、物理性质①相同点: (3)单质物理性质的异同 熔沸点逐渐降低密度逐渐增大(K特殊) 除铯外均为银白色;
都比较柔软,有延展性;
密度都比较小,熔点也都较低;
导热性和导电性也都很好。2、物理性质②递变性:碱金属 常温 燃烧 Li Li2O Li2O Na Na2O Na2O2 K K2O2 KO2[实验]钾在空气中燃烧现象:钾燃烧更剧烈,火焰紫色 问:与钠与氧气反应对比,有何不同? 3、化学性质(1)与 O2反应——生成氧化物产物碱性:LiOH <NaOH <KOH < RbOH < CsOH2Li + 2H2O = 2LiOH + H2 ↑(较慢)2Na + 2H2O = 2NaOH + H2 ↑(激烈)2K + 2H2O = 2KOH + H2 ↑(很激烈)结论:金属越活泼,与水反应越剧烈,产生的碱碱性越强。(2)与 H2O反应——生成碱和氢气3、化学性质 碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。 结论增加最外层电子增强 元素的金属性逐渐 ,金属单质的还原性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增强剧烈复杂强增大增强 已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C对应元素的金属性强弱如何?金属性 A 〉 B 〉 C课堂练习: 已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?金属性 Na 〉Mg 〉Al课堂练习: 二、卤族元素1、原子结构根据卤素原子结构示意图,归纳其结构特点及性质: 不同点:相同点:最外层7个电子核电荷数递增电子层数递增原子半径依次增大得到电子能力逐渐减弱,单质的氧化性逐渐减弱原子结构化学性质易得一个电子,具有氧化性2、物理性质卤素的物理性质和碱金属元素有相似递变性2、物理性质卤素单质的物理性质递变性 浅 —— 深 小 —— 大 低 —— 高气
气
液
固小结:
随着卤素元素核电荷数的增加,其单质颜色逐渐加深,密度递增,熔沸点递增。F2 冷暗处爆炸 H2+F2===2HF HF很稳定 Cl2 光照或点燃 H2+Cl2===2HCl HCl稳定Br2 高温 H2+Br2=== 2HBr HBr较不稳定I2 高温、持续加热 H2+I2 === 2HI HI很不稳定
缓慢进行 1) 卤素单质与氢气的反应结论: 随着核电荷数的增多,原子半径的增大,
(1)卤素单质与H2化合的难易关系:越来越难
(2)卤素单质与H2反应的剧烈程度:F2 >Cl2> Br2> I2
(3)氢化物的稳定性关系:HF > HCl > HBr > HI 3、化学性质2NaBr + Cl2 = 2NaCl + Br2
(溶液由无色变成橙黄色)
2KI + Cl2 = 2KCl + I2
(溶液由无色变成棕黄色)
2KI + Br2 = 2KBr + I2
(溶液由无色变棕黄色)由上述反应可比较卤素单质____性强弱。氧化氧化性: F2 > Cl2 > Br2 >I2★从F → I ,元素的非金属性逐渐减弱。2)卤素单质间的置换反应 卤族元素周期表从上到下(F、Cl、Br、I),随着核电荷数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,原子得电子能力逐渐 ,元素的非金属性逐渐 ,与氢气越来越 反应,生成氢化物越来越 。增多增大减弱减弱减弱难不稳定【卤族元素的递变规律】结论总结 通过比较碱金属单质与氧气、与水的反应,以及卤素单质与氢气的反应、卤素单质间的置换反应,卤素单质与水的反应,得出结论:元素的性质与( )有密切的关系,主要 ( ),特别与( )有关。 原子结构与原子核外电子的排布最外层电子数 同主族:元素金属性、非金属性的递变Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
IAⅦA金属性增强非金属性减弱原因:同一主族的元素中,各元素的最外层电子数相同,由于从上到下电子层数 增多,原子半径增大,原子核对外层电子的引力减弱,失电子能力逐渐增强,得 电子能力逐渐减弱
课堂练习: 1.氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质的密度依次增大(Br2除外)
B.单质的熔、沸点依次升高
C.Cl2可从KI溶液中置换出I2
D.F2可以从NaCl溶液中置换出Cl2D解析:选D。在NaCl溶液中,F2是与H2O反应而不是与NaCl反应。F2与水反应的化学方程式为:2F2+2H2O===O2+4HF。课堂练习: 2、下列卤族元素由上到下性质递变的叙述,正确是( )
①单质的氧化性增强 ②单质的颜色加深
③气态氢化物的稳定性增强 ④单质的沸点升高
⑤阴离子的还原性增强
A.①②③ B.②③④
C.②④⑤ D.④⑤C3、卤族元素单质及其化合物的性质
(1)按F→I的顺序元素的非金属性逐渐 ( )
(2)氢化物稳定性:( )
(3)氢化物还原性:( )
(4)最高价含氧酸酸性:
( )课堂练习: 减弱HF>HCl>HBr>HIHF<HCl<HBr<HIHClO4>HBrO4>HIO4,F无正价,故无含氧酸课外作业步步高P3-7第三课时
核素元素周期表构成原子的粒子质量特点:原子的质量主要集中在原子核上 质量数——核电荷数——
(质子数)——元素符号(1)定义:忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数,符号A。
质量数(A)=质子数(Z)+中子数(N) 1、质量数(A)101340171835123练一练:质量数、质子数和中子数的换算核素的定义: 具有一定数目的质子和一定数目的中子的一种原子。 氢元素的三种原子1110122、核素3、同位素质子数相同而中子数不同的同一元素的不同原子,互称同位素。 是制造氢弹的材料。H的三种同位素:
练一练A【元素、核素、同位素之间的关系】1.同一种元素,可以有若干种不同的核素;
2.同位素是同一元素的不同核素之间的互称。 同素异形体?1、以下为同位素的是( )
A. D2和H2 B. CO和CO2
C. 金刚石和石墨 D. 和
2、下列叙述正确的是( )
A. 所有元素的原子核均由质子和中子构成
B. 是一种同位素
C. 铀有三种同位素,即有三种铀原子
D. 核素就是元素DC 练一练3、据报道,上海某医院正在研究用放射性的一种
碘 治疗肿瘤。该碘原子的核内中子数与核外
电子数之差是( )A、72 B、19 C、53 D、125B4、在考古中常通过测定14C来鉴定文物年代。下列有关14C的说法正确的是( )
A.质子数为7 B.中子数为8
C.核外电子数为7 D.原子序数为14 练一练B 1、课内作业:步步高P8 活学活用1课外作业 3、 步步高P5-9 2、课本P11
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:俄国化学家——门捷列夫1869年将元素按照相对原子质量由小到大依次排列揭示了化学元素的内在联系——里程碑2.现行元素周期表(1)排序依据:
(2)原子序数:
(3)结构特点:
原子的核电荷数按照元素在周期表中的顺序给元素编号将化学性质相似的元素放在一个纵行?3、 元素周期表中有多少横行,多少周期? 多少纵行,多少族?阅读并思考1、元素周期表的编排原则 ?2、 在元素周期表中横行和纵行又称为什么? (二)元素周期表的结构1、横行( 个)—⑴具有相同的电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期。 周期(7个)7元素周期表的编排原则 短
周
期长
周
期不完全
周期横行(周期):电子层数相同、从左到右原子序数递增周期数 = 电子层数2.纵行( 个)—族(16个)18具有相同最外层电子数而又按原子序数递增顺序排列的 一系列元素成为一族。18纵行16族,七主七副零Ⅷ族主族序数 = 最外层电子数 碱
金
属
元
素卤
族
元
素稀
有
气
体
元
素短周期 ( 周期) 长周期 ( 周期)周期( 个) 族( 个) 元素周期表 族 ( 个) 族 ( 个) 族( 个) 个纵行 族 ( 个) 元素三短四长一不全;七主七副零Ⅷ族 个横行 个纵行周期序数=主族序数=元素周期表的结构771618不完全周期 ( 周期 )1、2、34、5、6、77主副VIII零7711IA ~ VIIAIB ~ VIIB8,9,10三稀有气体电子层数最外层电子数课堂小结 已知某主族元素的原子结构示意图如下,
判断其位于第几周期,第几族? 元素在周期表中的位置由其所在周期和族共同决定,而周期由电子层数决定,主族数由最外层电子数决定。 1、陶瓷家族中有“全能冠军”之称的工程陶瓷由氮元
素与X元素组成,其化学式为X3N4。已知X为第三周
期元素且原子最外层有4个电子,则X元素为
A.C B.Al
C.O D.Si课堂练习D AC 2、下列元素中,原子最外层电子数与其电子层数相同
的有
A.H B.Na C.Al D.Si4、某元素的原子结构示意图为,下列关于该原子的
说法正确的是
A.质子数为7
B.最外层电子数为2
C.核外电子数为7
D.核外有3个电子层3、已知某短周期元素原子的第三电子层上排布有5个
电子,则该元素在周期表中位于
A.第二周期ⅣA族 B.第二周期ⅤA族
C.第三周期ⅣA族 D.第三周期ⅤA族课堂练习D D 5、某元素位于第三周期第ⅥA族。下列叙述不正确的是
A.该元素是非金属元素
B.该元素原子的核电荷数为16
C.该元素原子核外有3个电子层
D.该元素原子容易失去最外层电子6、蓝宝石的主要成分为第ⅢA族元素的氧化物,该氧化
物为
A.A12O3 B.CuO
C.Fe2O3 D.MgO课堂练习D A 1、 熟记前20号元素的元素符号,原子序数及在元素周期表中的位置。课外作业 2、 步步高P1-2填写下表:第二课时
元素的性质与
原子结构元素周期表一、碱金属元素锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)放射性元素 3LiNaKRbCs 11 19 37 5511111 2 3 4 5 6通过观察碱金属的原子结构示意图,你能发现碱金属元素的原子结构有什么共同之处呢? 完成P5的表格:一、碱金属元素1、原子结构①相同点:碱金属元素原子结构的 相同, 都为 ,容易失去电子。
最外层电子数1个碱金属元素的化合价都为 。0或+1②递变性:从Li到Cs:核电荷数依次 ;
电子层数逐渐 ;
原子半径逐渐 ;
原子核对最外层电子的吸引能力逐渐 ;
增加增多增大减弱碱金属的主要物理性质2、物理性质①相同点: (3)单质物理性质的异同 熔沸点逐渐降低密度逐渐增大(K特殊) 除铯外均为银白色;
都比较柔软,有延展性;
密度都比较小,熔点也都较低;
导热性和导电性也都很好。2、物理性质②递变性:碱金属 常温 燃烧 Li Li2O Li2O Na Na2O Na2O2 K K2O2 KO2[实验]钾在空气中燃烧现象:钾燃烧更剧烈,火焰紫色 问:与钠与氧气反应对比,有何不同? 3、化学性质(1)与 O2反应——生成氧化物产物碱性:LiOH <NaOH <KOH < RbOH < CsOH2Li + 2H2O = 2LiOH + H2 ↑(较慢)2Na + 2H2O = 2NaOH + H2 ↑(激烈)2K + 2H2O = 2KOH + H2 ↑(很激烈)结论:金属越活泼,与水反应越剧烈,产生的碱碱性越强。(2)与 H2O反应——生成碱和氢气3、化学性质 碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。 结论增加最外层电子增强 元素的金属性逐渐 ,金属单质的还原性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增强剧烈复杂强增大增强 已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C对应元素的金属性强弱如何?金属性 A 〉 B 〉 C课堂练习: 已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?金属性 Na 〉Mg 〉Al课堂练习: 二、卤族元素1、原子结构根据卤素原子结构示意图,归纳其结构特点及性质: 不同点:相同点:最外层7个电子核电荷数递增电子层数递增原子半径依次增大得到电子能力逐渐减弱,单质的氧化性逐渐减弱原子结构化学性质易得一个电子,具有氧化性2、物理性质卤素的物理性质和碱金属元素有相似递变性2、物理性质卤素单质的物理性质递变性 浅 —— 深 小 —— 大 低 —— 高气
气
液
固小结:
随着卤素元素核电荷数的增加,其单质颜色逐渐加深,密度递增,熔沸点递增。F2 冷暗处爆炸 H2+F2===2HF HF很稳定 Cl2 光照或点燃 H2+Cl2===2HCl HCl稳定Br2 高温 H2+Br2=== 2HBr HBr较不稳定I2 高温、持续加热 H2+I2 === 2HI HI很不稳定
缓慢进行 1) 卤素单质与氢气的反应结论: 随着核电荷数的增多,原子半径的增大,
(1)卤素单质与H2化合的难易关系:越来越难
(2)卤素单质与H2反应的剧烈程度:F2 >Cl2> Br2> I2
(3)氢化物的稳定性关系:HF > HCl > HBr > HI 3、化学性质2NaBr + Cl2 = 2NaCl + Br2
(溶液由无色变成橙黄色)
2KI + Cl2 = 2KCl + I2
(溶液由无色变成棕黄色)
2KI + Br2 = 2KBr + I2
(溶液由无色变棕黄色)由上述反应可比较卤素单质____性强弱。氧化氧化性: F2 > Cl2 > Br2 >I2★从F → I ,元素的非金属性逐渐减弱。2)卤素单质间的置换反应 卤族元素周期表从上到下(F、Cl、Br、I),随着核电荷数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,原子得电子能力逐渐 ,元素的非金属性逐渐 ,与氢气越来越 反应,生成氢化物越来越 。增多增大减弱减弱减弱难不稳定【卤族元素的递变规律】结论总结 通过比较碱金属单质与氧气、与水的反应,以及卤素单质与氢气的反应、卤素单质间的置换反应,卤素单质与水的反应,得出结论:元素的性质与( )有密切的关系,主要 ( ),特别与( )有关。 原子结构与原子核外电子的排布最外层电子数 同主族:元素金属性、非金属性的递变Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
IAⅦA金属性增强非金属性减弱原因:同一主族的元素中,各元素的最外层电子数相同,由于从上到下电子层数 增多,原子半径增大,原子核对外层电子的引力减弱,失电子能力逐渐增强,得 电子能力逐渐减弱
课堂练习: 1.氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质的密度依次增大(Br2除外)
B.单质的熔、沸点依次升高
C.Cl2可从KI溶液中置换出I2
D.F2可以从NaCl溶液中置换出Cl2D解析:选D。在NaCl溶液中,F2是与H2O反应而不是与NaCl反应。F2与水反应的化学方程式为:2F2+2H2O===O2+4HF。课堂练习: 2、下列卤族元素由上到下性质递变的叙述,正确是( )
①单质的氧化性增强 ②单质的颜色加深
③气态氢化物的稳定性增强 ④单质的沸点升高
⑤阴离子的还原性增强
A.①②③ B.②③④
C.②④⑤ D.④⑤C3、卤族元素单质及其化合物的性质
(1)按F→I的顺序元素的非金属性逐渐 ( )
(2)氢化物稳定性:( )
(3)氢化物还原性:( )
(4)最高价含氧酸酸性:
( )课堂练习: 减弱HF>HCl>HBr>HIHF<HCl<HBr<HIHClO4>HBrO4>HIO4,F无正价,故无含氧酸课外作业步步高P3-7第三课时
核素元素周期表构成原子的粒子质量特点:原子的质量主要集中在原子核上 质量数——核电荷数——
(质子数)——元素符号(1)定义:忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数,符号A。
质量数(A)=质子数(Z)+中子数(N) 1、质量数(A)101340171835123练一练:质量数、质子数和中子数的换算核素的定义: 具有一定数目的质子和一定数目的中子的一种原子。 氢元素的三种原子1110122、核素3、同位素质子数相同而中子数不同的同一元素的不同原子,互称同位素。 是制造氢弹的材料。H的三种同位素:
练一练A【元素、核素、同位素之间的关系】1.同一种元素,可以有若干种不同的核素;
2.同位素是同一元素的不同核素之间的互称。 同素异形体?1、以下为同位素的是( )
A. D2和H2 B. CO和CO2
C. 金刚石和石墨 D. 和
2、下列叙述正确的是( )
A. 所有元素的原子核均由质子和中子构成
B. 是一种同位素
C. 铀有三种同位素,即有三种铀原子
D. 核素就是元素DC 练一练3、据报道,上海某医院正在研究用放射性的一种
碘 治疗肿瘤。该碘原子的核内中子数与核外
电子数之差是( )A、72 B、19 C、53 D、125B4、在考古中常通过测定14C来鉴定文物年代。下列有关14C的说法正确的是( )
A.质子数为7 B.中子数为8
C.核外电子数为7 D.原子序数为14 练一练B 1、课内作业:步步高P8 活学活用1课外作业 3、 步步高P5-9 2、课本P11
