人教版高中化学必修二 1.3 化学键60张PPT
文档属性
| 名称 | 人教版高中化学必修二 1.3 化学键60张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 733.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 00:00:00 | ||
图片预览











文档简介
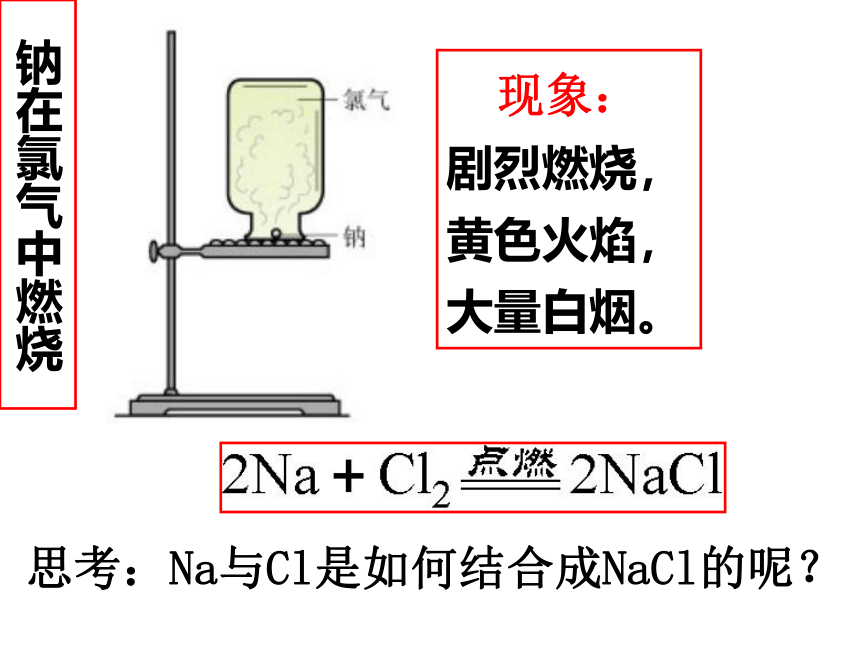
课件60张PPT。 第三节 化学键离 子 键钠在氯气中燃烧现象:
剧烈燃烧,
黄色火焰,
大量白烟。思考:Na与Cl是如何结合成NaCl的呢?Na+Cl-电子转移1氯化钠的形成过程:不稳定较稳定动脑筋想想 在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力? Na+离子和Cl-离子之间的静电吸引。
阴阳离子中的核外电子与电子、原子核与原子核之间的静电排斥。把静电吸引和静电排斥统称为静电作用阴阳离子能无限靠近吗?思考 Na+和Cl-之间的阴阳离子静电相互吸引
阴阳离子间电子与电子(负电)
原子核与原子核间(正电) 相互排斥
不能
当阴阳离子接近到一定距离时,吸引和排斥
作用达到平衡,阴阳离子间形成稳定的化学键。
离 子 键定义: 使阴、阳离子结合成化合物的静
电作用做叫离子键。含有离子键的化合物就是离子化合物。成键粒子:
成键性质:
阴、阳离子静电作用(包括静电引力和斥力)思考 哪些物质能形成离子键?如何判断一个物质是离子化合物? 通常,活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)形成的化合物。
主要有三类:强碱、大多数盐、活泼金属氧化物。 注意:
不是,铵盐中只有非金属元素,但铵
盐是离子化合物。如NH4Cl、NH4NO3等。简单记忆:通常,活泼金属阳离子或者铵根离子和非金属阴离子形成的化合物(盐),是离子化合物。 不是!特殊: AlCl3 、Pb(CH3COO)2中不存在离子键,不是离子化合物。
注意:结 论1、不是所有含有金属元素的化合物都是离子化合物。
2、离子化合物可以不含有金属元素。 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
H ·Na · ·Mg · 1、 原子的电子式: 2、简单 离子的电子式:分为阴阳两种离子H+Na+Mg2+金属阳离子的电子式——离子符号。 非金属阴离子的电子式要标 [ ] 及“ 电荷数 ”。对称美二、用电子式表示离子化合物的形成 写出下列粒子的电子式:
硫原子 溴离子 钾离子 铝离子K+
对称美请画出第三周期元素的电子式!Al3+
写出CaO、MgCl2的电子式。Ca2+CaO:MgCl2:Mg2+物质的电子式氯化钠溴化钙Na+Ca2+离子化合物的电子式:1、AB型
2、A2B型
3、AB2型硫化钾对称美
(少的放中间)2、用电子式表示离子化合物的形成过程例:硫化钾 溴化镁注意:左端是原子的电子式,右端是离子化合物的电子式,中间用“→”连接( → 表形成过程、=表生成过程)。用箭头表示电子的转移。[ 练习]· Mg ·+→Mg2+2Na·+→Na+Na+1.用电子式表示氧化镁、硫化钠、氯化钙的形成 过程 → ·Ca ·++2. 下列各数值表示有关元素的原子序数,能形成AB2
型离子化合物的是( )
A.6与8 B.11与13 C. 11与16 D.12与17DD3.下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
4.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 D放热反应 P22页思考与交流 H2+Cl2=2HCl
分析H和Cl的原子结构,你认为HCl的形成会与NaCl一样吗?非金属元素之间化合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电子的倾向,没有电子的得失,无阴阳离子,所以没有离子键。思考:H2和Cl2如何反应生成HCl?我只有一个电子,太少了我也少一个电子eH 原子Cl 原子二位!我有一个好办法.你们每人各拿出一个电子共用,通过分享而稳定存在.怎么样?调解员愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?证婚人H2+Cl2===2HCl点燃学学氢原子和氯原子,要在这个社会上更好地生存,就要懂得去分享,才能得到更多!共 价 键定义: 原子间通过共用电子对所形成的相互作用叫做共价键。成键微粒:原子注
意相互作用:共用电子对成键元素:同种或不同种非金属元素成键结果:单质或者化合物 非金属元素的原子间可通过共用电子对
的方法使双方最外电子层均达到稳定结构。大家练习一下这些物质电子式的书写
HCl H2S NH3
CCl4 F2 O2 共价化合物的形成过程(或单质)注意事项:①不需用箭头表示电子的偏移;
②共价键可形成单质,也可形成共价化合物;
?箭头左边相同的原子可以合并,而右边的不可以HClH2OF2+→+→ 碘 用电子式表示下列共价分子的形成过程 水 二氧化碳 氨 2 H ·+→ 硫化氢2 H ·+→3 H ·+→+2→成键原子相同,两原子吸引电子对的能力相同,共用电子对不偏移,成键原子不显电性——非极性共价键H﹣H(结构式)H﹣Cl(结构式)成键原子不同,原子对电子对的吸引能力不同,共用电子对偏向氯原子,氯原子带部分负电荷,氢原子带部分正电荷——极性共价键(1)氯气 练习: 1.写出下列物质的电子式和结构式(2)溴化氢 (5)过氧化氢(4)甲烷(3)氮气Cl Cl::::::: …N N ·· … ·· Cl-Cl H-Br N≡N H-C -HHH-- H-O-O-H (单键) (叁键) H Br ﹕﹕ ﹕﹕ H C H H H ﹕ ﹕﹕﹕ H O O H ﹕ ﹕﹕﹕﹕ ﹕ ﹕判断出物质中所含共价键的类型2.二氧化碳的电子式或结构式错误的是( ) O=C=O O-C-OA.B.C.D.A C碳氧双键O C O﹕ ﹕ ﹕ ﹕ ﹕ ﹕ ﹕﹕﹕﹕O C O ﹕ ﹕ ﹕ ﹕3.次氯酸的电子式或结构式错误的是( )A DA.B.C.D. ﹕ ﹕ ﹕﹕H Cl O﹕ ﹕﹕ ﹕ ﹕ ﹕﹕H O Cl﹕ ﹕﹕ H-O-Cl﹕ ﹕H+ [ Cl O ]-﹕﹕ ﹕ ﹕ ﹕(9)用电子式表示共价化合物的形成过程 2. HCl3. H2O1. H25. NH34. CO2注意:不标电荷和中括号 “ [ ] ”结构式共价键的种类只由共价键构成的化合物叫做共价化合物。常见共价化合物包括:
①非金属氢化物(如HCl、H2S、H2O等);
②酸(如H2SO4、HNO3、H3PO4等);
③非金属氧化物(如CO、CO2、SO2等).注意:
含有共价键的(化合物)不一定是共价化合物。
(可以是单质,也可以是离子化合物)
含有离子键的化合物一定是离子化合物一起来画出它们的电子式NaOH
Na2O2
NH4Cl 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-共 价 键离 子 键 成键微粒原 子阴、阳离子微 粒
间的作用成键元素范围成键原因共用电子对阴、阳离子间静电作用同种或不同种的非金属元素活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素微粒由不稳定结构通过得失电子后变成稳定结构。微粒由不稳定结构通过共用电子对相互作用后变成稳定结构。归纳化学键——使离子相结合或原子相结合的作用力,通称为化学键。 一般化学物质主要是由离子键或共价键结合而成。
化学键的形成主要通过原子的价电子间的转移和共用来实现。分类四.化学反应过程中化学键的变化①旧化学键断裂②新化学键生成本质以H2和Cl2反应生成HCl为例注意: 化学键的存在(1)稀有气体单质(单原子分子)中不存在化学键(不是所有物质都存在化学键)
(2)共价化合物分子中只存在共价键,不存在离子键
(3)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl等含有原子团的离子化合物
H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl反应物化学反应本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏。化学反应的过程:分解重新组合旧键断裂新键生成注意:化学反应中反应物的化学键并非全部被破坏如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl只破坏反应物中的离子键,共价键未被破坏原子离子生成物分子间作用力和氢键*1.分子间作用力*(1)定义:分子间作用力 << 化学键,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质
而化学键主要影响物质的化学性质。由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 科学视野把分子聚集在一起的作用力叫做分子间作用力 (也叫范德华力)(2)强弱:(3)存在:(4)影响因素:(5)对熔、沸点的影响:对组成和结构相似的物质,相对分子质量越大,分子间作用力就越大,如 Cl2<Br2 <I2分子间作用力越大,物质熔沸点越高
如 :Cl2<Br2 <I2卤素单质的熔、沸点与相对分子质量的关系结论:组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。 但是部分氢化物的熔沸点的递变却有所不同,为什么HF、H2O和NH3的沸点会反常呢?思考:一些氢化物的沸点2.氢键*(1)概念:分子间作用力 < 氢键 < 化学键弱
氢键是一种较强的分子间作用力N、O、F 的氢化物分子间在NH3、H2O、HF分子间存在着一种比分子间作用力稍强的相互作用——氢键(2)强弱:(3)存在:(4)作用:①分子间氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高。这是因为固体熔化或液体汽化时,必须破坏分子间的氢键,消耗较多能量。②氢键对物质溶解性有影响(氢键的存在会增大溶解度)如:NH3、C2H5OH、CH3COOH 等极易溶于水。如果水分子之间没有氢键存在,地球上将会是什么面貌?无液态水!无江河、湖泊、海洋! 列表比较分子间作用力、化学键、氢键
(主要比较作用的微粒、作用力的大小、影响)(2)错,如 NH4Cl 等铵盐 (1)错,如:NaOH 、H2、Na2SO4 (3)错,如:He、Ne等稀有气体练习1.判断正误:
(1)含有共价键的化合物一定是共价化合物
(2)全部由非金属元素组成的化合物一定是
共价化合物
(3)在气态单质分子里一定有共价键4.下列物质受热熔化时,不需要破坏化学键的是( )
A. 食盐 B. 纯碱
C. 干冰 D. 冰CD注意:离子化合物熔化或者溶于水时,破坏离子键。
共价化合物熔化时,不破坏共价键。
溶于水时,有部分物质的共价键被破坏。2.下列物质中,
(1)含离子键的物质是(??? )
(2)含非极性共价键的物质是(??? )
(3)含极性共价键的物质是( )
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4 H、CCl4
I、 Br2 J、 PH3 A、FB、E、G、H、JC、D、I3.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水D课堂练习( A ) 课后习题
剧烈燃烧,
黄色火焰,
大量白烟。思考:Na与Cl是如何结合成NaCl的呢?Na+Cl-电子转移1氯化钠的形成过程:不稳定较稳定动脑筋想想 在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力? Na+离子和Cl-离子之间的静电吸引。
阴阳离子中的核外电子与电子、原子核与原子核之间的静电排斥。把静电吸引和静电排斥统称为静电作用阴阳离子能无限靠近吗?思考 Na+和Cl-之间的阴阳离子静电相互吸引
阴阳离子间电子与电子(负电)
原子核与原子核间(正电) 相互排斥
不能
当阴阳离子接近到一定距离时,吸引和排斥
作用达到平衡,阴阳离子间形成稳定的化学键。
离 子 键定义: 使阴、阳离子结合成化合物的静
电作用做叫离子键。含有离子键的化合物就是离子化合物。成键粒子:
成键性质:
阴、阳离子静电作用(包括静电引力和斥力)思考 哪些物质能形成离子键?如何判断一个物质是离子化合物? 通常,活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)形成的化合物。
主要有三类:强碱、大多数盐、活泼金属氧化物。 注意:
不是,铵盐中只有非金属元素,但铵
盐是离子化合物。如NH4Cl、NH4NO3等。简单记忆:通常,活泼金属阳离子或者铵根离子和非金属阴离子形成的化合物(盐),是离子化合物。 不是!特殊: AlCl3 、Pb(CH3COO)2中不存在离子键,不是离子化合物。
注意:结 论1、不是所有含有金属元素的化合物都是离子化合物。
2、离子化合物可以不含有金属元素。 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
H ·Na · ·Mg · 1、 原子的电子式: 2、简单 离子的电子式:分为阴阳两种离子H+Na+Mg2+金属阳离子的电子式——离子符号。 非金属阴离子的电子式要标 [ ] 及“ 电荷数 ”。对称美二、用电子式表示离子化合物的形成 写出下列粒子的电子式:
硫原子 溴离子 钾离子 铝离子K+
对称美请画出第三周期元素的电子式!Al3+
写出CaO、MgCl2的电子式。Ca2+CaO:MgCl2:Mg2+物质的电子式氯化钠溴化钙Na+Ca2+离子化合物的电子式:1、AB型
2、A2B型
3、AB2型硫化钾对称美
(少的放中间)2、用电子式表示离子化合物的形成过程例:硫化钾 溴化镁注意:左端是原子的电子式,右端是离子化合物的电子式,中间用“→”连接( → 表形成过程、=表生成过程)。用箭头表示电子的转移。[ 练习]· Mg ·+→Mg2+2Na·+→Na+Na+1.用电子式表示氧化镁、硫化钠、氯化钙的形成 过程 → ·Ca ·++2. 下列各数值表示有关元素的原子序数,能形成AB2
型离子化合物的是( )
A.6与8 B.11与13 C. 11与16 D.12与17DD3.下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
4.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低 D放热反应 P22页思考与交流 H2+Cl2=2HCl
分析H和Cl的原子结构,你认为HCl的形成会与NaCl一样吗?非金属元素之间化合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电子的倾向,没有电子的得失,无阴阳离子,所以没有离子键。思考:H2和Cl2如何反应生成HCl?我只有一个电子,太少了我也少一个电子eH 原子Cl 原子二位!我有一个好办法.你们每人各拿出一个电子共用,通过分享而稳定存在.怎么样?调解员愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?证婚人H2+Cl2===2HCl点燃学学氢原子和氯原子,要在这个社会上更好地生存,就要懂得去分享,才能得到更多!共 价 键定义: 原子间通过共用电子对所形成的相互作用叫做共价键。成键微粒:原子注
意相互作用:共用电子对成键元素:同种或不同种非金属元素成键结果:单质或者化合物 非金属元素的原子间可通过共用电子对
的方法使双方最外电子层均达到稳定结构。大家练习一下这些物质电子式的书写
HCl H2S NH3
CCl4 F2 O2 共价化合物的形成过程(或单质)注意事项:①不需用箭头表示电子的偏移;
②共价键可形成单质,也可形成共价化合物;
?箭头左边相同的原子可以合并,而右边的不可以HClH2OF2+→+→ 碘 用电子式表示下列共价分子的形成过程 水 二氧化碳 氨 2 H ·+→ 硫化氢2 H ·+→3 H ·+→+2→成键原子相同,两原子吸引电子对的能力相同,共用电子对不偏移,成键原子不显电性——非极性共价键H﹣H(结构式)H﹣Cl(结构式)成键原子不同,原子对电子对的吸引能力不同,共用电子对偏向氯原子,氯原子带部分负电荷,氢原子带部分正电荷——极性共价键(1)氯气 练习: 1.写出下列物质的电子式和结构式(2)溴化氢 (5)过氧化氢(4)甲烷(3)氮气Cl Cl::::::: …N N ·· … ·· Cl-Cl H-Br N≡N H-C -HHH-- H-O-O-H (单键) (叁键) H Br ﹕﹕ ﹕﹕ H C H H H ﹕ ﹕﹕﹕ H O O H ﹕ ﹕﹕﹕﹕ ﹕ ﹕判断出物质中所含共价键的类型2.二氧化碳的电子式或结构式错误的是( ) O=C=O O-C-OA.B.C.D.A C碳氧双键O C O﹕ ﹕ ﹕ ﹕ ﹕ ﹕ ﹕﹕﹕﹕O C O ﹕ ﹕ ﹕ ﹕3.次氯酸的电子式或结构式错误的是( )A DA.B.C.D. ﹕ ﹕ ﹕﹕H Cl O﹕ ﹕﹕ ﹕ ﹕ ﹕﹕H O Cl﹕ ﹕﹕ H-O-Cl﹕ ﹕H+ [ Cl O ]-﹕﹕ ﹕ ﹕ ﹕(9)用电子式表示共价化合物的形成过程 2. HCl3. H2O1. H25. NH34. CO2注意:不标电荷和中括号 “ [ ] ”结构式共价键的种类只由共价键构成的化合物叫做共价化合物。常见共价化合物包括:
①非金属氢化物(如HCl、H2S、H2O等);
②酸(如H2SO4、HNO3、H3PO4等);
③非金属氧化物(如CO、CO2、SO2等).注意:
含有共价键的(化合物)不一定是共价化合物。
(可以是单质,也可以是离子化合物)
含有离子键的化合物一定是离子化合物一起来画出它们的电子式NaOH
Na2O2
NH4Cl 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-共 价 键离 子 键 成键微粒原 子阴、阳离子微 粒
间的作用成键元素范围成键原因共用电子对阴、阳离子间静电作用同种或不同种的非金属元素活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素微粒由不稳定结构通过得失电子后变成稳定结构。微粒由不稳定结构通过共用电子对相互作用后变成稳定结构。归纳化学键——使离子相结合或原子相结合的作用力,通称为化学键。 一般化学物质主要是由离子键或共价键结合而成。
化学键的形成主要通过原子的价电子间的转移和共用来实现。分类四.化学反应过程中化学键的变化①旧化学键断裂②新化学键生成本质以H2和Cl2反应生成HCl为例注意: 化学键的存在(1)稀有气体单质(单原子分子)中不存在化学键(不是所有物质都存在化学键)
(2)共价化合物分子中只存在共价键,不存在离子键
(3)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl等含有原子团的离子化合物
H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl H H
Cl Cl反应物化学反应本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏。化学反应的过程:分解重新组合旧键断裂新键生成注意:化学反应中反应物的化学键并非全部被破坏如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl只破坏反应物中的离子键,共价键未被破坏原子离子生成物分子间作用力和氢键*1.分子间作用力*(1)定义:分子间作用力 << 化学键,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质
而化学键主要影响物质的化学性质。由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 科学视野把分子聚集在一起的作用力叫做分子间作用力 (也叫范德华力)(2)强弱:(3)存在:(4)影响因素:(5)对熔、沸点的影响:对组成和结构相似的物质,相对分子质量越大,分子间作用力就越大,如 Cl2<Br2 <I2分子间作用力越大,物质熔沸点越高
如 :Cl2<Br2 <I2卤素单质的熔、沸点与相对分子质量的关系结论:组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。 但是部分氢化物的熔沸点的递变却有所不同,为什么HF、H2O和NH3的沸点会反常呢?思考:一些氢化物的沸点2.氢键*(1)概念:分子间作用力 < 氢键 < 化学键弱
氢键是一种较强的分子间作用力N、O、F 的氢化物分子间在NH3、H2O、HF分子间存在着一种比分子间作用力稍强的相互作用——氢键(2)强弱:(3)存在:(4)作用:①分子间氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高。这是因为固体熔化或液体汽化时,必须破坏分子间的氢键,消耗较多能量。②氢键对物质溶解性有影响(氢键的存在会增大溶解度)如:NH3、C2H5OH、CH3COOH 等极易溶于水。如果水分子之间没有氢键存在,地球上将会是什么面貌?无液态水!无江河、湖泊、海洋! 列表比较分子间作用力、化学键、氢键
(主要比较作用的微粒、作用力的大小、影响)(2)错,如 NH4Cl 等铵盐 (1)错,如:NaOH 、H2、Na2SO4 (3)错,如:He、Ne等稀有气体练习1.判断正误:
(1)含有共价键的化合物一定是共价化合物
(2)全部由非金属元素组成的化合物一定是
共价化合物
(3)在气态单质分子里一定有共价键4.下列物质受热熔化时,不需要破坏化学键的是( )
A. 食盐 B. 纯碱
C. 干冰 D. 冰CD注意:离子化合物熔化或者溶于水时,破坏离子键。
共价化合物熔化时,不破坏共价键。
溶于水时,有部分物质的共价键被破坏。2.下列物质中,
(1)含离子键的物质是(??? )
(2)含非极性共价键的物质是(??? )
(3)含极性共价键的物质是( )
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4 H、CCl4
I、 Br2 J、 PH3 A、FB、E、G、H、JC、D、I3.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水D课堂练习( A ) 课后习题
