人教版高中化学必修二 4.1 开发利用金属矿物和海水资源 课件53张PPT
文档属性
| 名称 | 人教版高中化学必修二 4.1 开发利用金属矿物和海水资源 课件53张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 09:59:49 | ||
图片预览











文档简介
课件53张PPT。第四章 化学与可持续发展第一课时 金属矿物的开发和利用第一节 开发利用金属矿物和海水资源 1.了解金属在自然界中的存在形式。
2.掌握金属的冶炼方法。
3.掌握铝热反应原理及实验步骤。
4.了解金属回收和资源保护的意义。
5.认识和体会化学在自然资源开发和利用中的意义和作用。金矿
Au铂矿
Pt少数不活泼金属以游离态存在(如金和铂)一、金属矿物的开发利用银矿
Ag游离态金属矿1、金属元素的存在: 一、金属矿物的开发利用化合态金属矿辰砂
HgS菱镁矿
MgCO3大多数金属以化合态存在一、金属矿物的开发利用 2、金属冶炼的实质 得电子 (1)、金属冶炼的实质
实质是用还原的方法使金属化合物中的
金属离子得到电子变成金属原子。古代中国劳动人民用木炭炼铁金属活动性顺序K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性逐渐减弱金属离子的得电子能力逐渐增强要根据金属的活动性顺序不同,采取不同的冶炼方法(2)热分解法(适合一些不活泼金属)
(1)物理提取法:
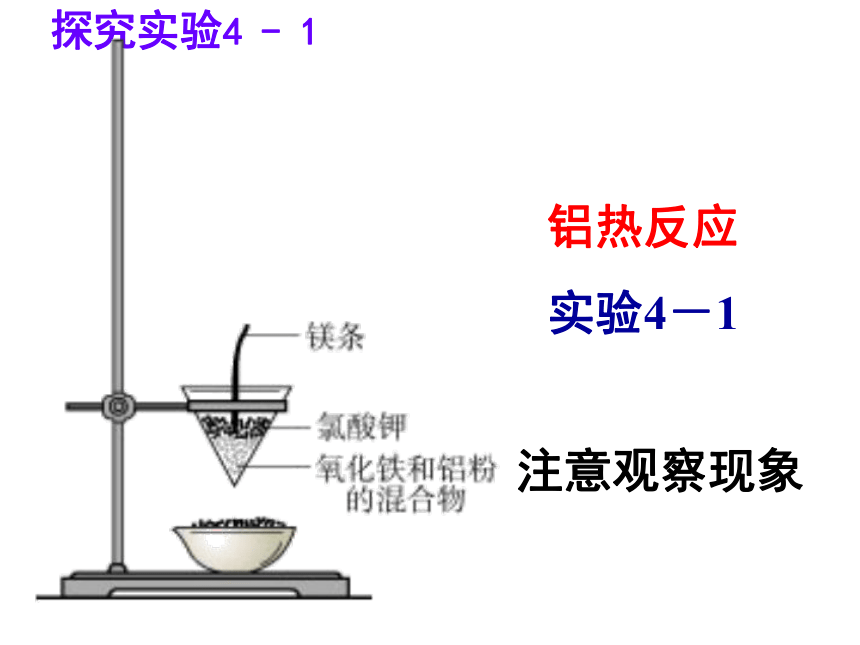
适用于极不活泼的金属——Pt、Au3、金属冶炼的方法一、金属矿物的开发利用(3)热还原法(适用于大部分金属)常见的还原剂;焦碳、一氧化碳、氢气等(4)电解法(适合一些非常活泼金属) 铝热反应
实验4-1 注意观察现象探究实验4 - 1反应现象:镁条剧烈燃烧,放出大量热,发出耀眼白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。铝热剂 铝——还原剂
(活泼金属——可作还原剂)应用:
(1)焊接钢轨,
(2)冶炼金属(3)定向爆破。其它的铝热反应:2Cr + Al2O39Co + 4Al2O3小结:冶金的一般方法:K、Ca、Na、Mg、AlZn、Fe、Sn、Pb(H)、CuHg、Ag强————————————→弱弱————————————→强电解法热还原法热分
解法Pt、 Au物理提取法表4-1 常见金属的冶炼原理金属冶炼原理FeFe2O3+3CO===2Fe+3CO2(高炉炼铁)
Fe2O3+2Al===2Fe+Al2O3(铝热法炼铁)高温高温CuCu2S+O2===2Cu+SO2(火法炼铜)
Fe+CuSO4===FeSO4+Cu(湿法炼铜)高温MgMgO+C===Mg+CO↑
MgCl2(熔融)===Mg+Cl2↑高温Al2Al2O3(熔融)===4Al+3O2↑电解冰晶石Na2NaCl(熔融)===2Na+Cl2↑
电解电解练习1、下列各种冶炼方法中,可以制得
相应金属的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
2、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na ②Zn
③Hg ④Au
C电解法加热还原法加热分解法物理提取法金银人类最早发现和应用的金属分别是:铜铜是人类第一种大量使用的金属,结束了漫长的“石器时代”. 在公元前6000年到7000年左右,人类开始迈进了象征古代文明开端的“铜器时代”。古老的冶炼技术(2)湿法炼铜
Fe+CuSO4===FeSO4+Cu五、铜的冶炼:分析一下早晚应用是什么原因呢?铜 镜汉武帝时铜币先秦刀币现代的冶炼技术最近——生物炼铜原理:优点:(1)成本低;
(2)污染小,反应条件简单;
(3)品质很差的矿石也能被利用。 我国古代炼铁工业长期领先于世界,我们在西汉初时已经懂得用木炭与铁矿石混合高温冶炼生铁,领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。古代中国劳动人民用木炭炼铁 1996年之后,我国再度成为钢铁产量最大的国家。 现代炼铁:铁矿石(化合态)→铁单质(游离态)(3)基本反应原理:(4)设备:铁矿石,焦炭,石灰石,空气(1)原料:高炉 (5)造渣(除脉石):
CaCO3 = CO2+CaO
CaO+SiO2 = CaSiO3(熔剂:石灰石)
(2)产生还原剂: C+O2=CO2
CO2+C=2CO (空气,焦炭)点燃点燃高温高温4、合理开发和利用矿物资源的途径:金属铝的回收与利用合理开发和利用矿物资源,主要途径有:… … … … …二、海水资源的开发和利用钓鱼岛问题与讨论:钓鱼岛,是钓鱼岛列岛的主岛,是中华人民共和国固有领土,面积为约6.344平方公里,四周海域是一片丰饶的渔场,海底还蕴藏着比较丰富的油气田。 问题与讨论 海水中蕴含着丰富的水资源和化学资源,21世纪人类将重点开发海洋资源。含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多。被称为“元素的故乡”。海水中铀多达45亿吨
是已知陆地铀矿储量
的4500倍。氘有50亿
吨足够人类用上千万
年海水中的化学资源海洋中的矿产资源海洋能源的利用具有开发价值的:潮汐发电和波浪发电海水资源其他资源物质海洋资源能量获得海水资源的广泛性:海洋约占地球表面积71%
海洋中的资源 :
动物:(鱼类、海狮、海马、贝类………
植物:(海草、海带…………
矿物:(各种盐、NaCl、MgCl2 ……….
海底金属结核矿、石油
水 : (水资源及各种溶解的盐类
35资料海水资源的广泛性:海水提Mg海水淡化海水提取NaClBr2的提取海水综合利用联合工业体系一例(海水淡化的方法主要有蒸馏法、电渗析法、
离子交换法等。) 海水蒸馏原理示意图(海水水资源的利用)进出原理:
加热到水的沸点,液态水变为水蒸气与海水中的盐分离,水蒸汽冷凝得到淡水。任务1:海水的淡化:太阳能蒸发海水示意图: 任务1:海水的淡化:盐场工人在晒盐1、晒盐法任务二:海水中提取NaCl正极负极阴极
铁棒阳极
石墨2、氯气的工业制法2、氯气的工业制法 人们把以电解食盐水为基础制取氯气、烧碱(NaOH)等产品的工业称为“氯碱工业”。原理:阴极产物阳极产物电解饱和食盐水 科学探究:
如何证明海带中有碘离子?
阅读P91实验4-2 化学方程式:
2KI + H2O2 + H2SO4=== I2+ K2SO4 + 2H2O海带提碘:海带海带灰溶解过滤灼烧残渣含I-的溶液稀H2SO4
H2O2含I2的溶液含I2的有机溶液萃取任务三:知识拓展 从海水中提取Br2坩埚证明海带中含有碘,有以下步骤①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤.(1)合理的步骤是____________(2)证明含碘的步骤是_______, 现象是_____________________, 反应的离子方程式是 __________________________③①④②②滴入淀粉溶液,溶液变蓝 思考与交流:
如何将海水中的溴离子转变成溴单质?1、设计海水提溴的实验流程图;
2、写出相关的化学方程式。浓缩海水Br2HBr溶液Br2任务四:知识应用 海水中提取Br2(阅读教材P91页资料卡片——海水提溴)①2NaBr + Cl2= Br2+2NaCl② 2H2O +Br2+SO2=H2SO4+2HBr③2HBr + Cl2=Br2+2HCl海水提Br2的实验室模拟装置--是空气吹出法 思考:1、用什么方法提取反应③后溶液中的溴单质?实验室提取溴单质所用主要仪器是什么?思考2:萃取Br2、I2常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?碘的有机溶液紫红溴的有机溶液海水镁飞机镁被誉为“国防金属”,60%的镁从海水提取任务五:知识拓展 从海水中提取镁含Mg2+、Br-过滤浓缩结晶脱水固体加热熔融工业从卤水中提取镁的工艺流程图:任务五:知识拓展 从海水中提取Mg思考:上述流程中,各个池子中发生了那些化学反应?写出化学方程式?电解相关反应归纳提升用到了那些分离、提纯的方法那? Cl2谈本节课的收获你的收获提取物质的一般过程和方法未来海洋空间利用
2.掌握金属的冶炼方法。
3.掌握铝热反应原理及实验步骤。
4.了解金属回收和资源保护的意义。
5.认识和体会化学在自然资源开发和利用中的意义和作用。金矿
Au铂矿
Pt少数不活泼金属以游离态存在(如金和铂)一、金属矿物的开发利用银矿
Ag游离态金属矿1、金属元素的存在: 一、金属矿物的开发利用化合态金属矿辰砂
HgS菱镁矿
MgCO3大多数金属以化合态存在一、金属矿物的开发利用 2、金属冶炼的实质 得电子 (1)、金属冶炼的实质
实质是用还原的方法使金属化合物中的
金属离子得到电子变成金属原子。古代中国劳动人民用木炭炼铁金属活动性顺序K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性逐渐减弱金属离子的得电子能力逐渐增强要根据金属的活动性顺序不同,采取不同的冶炼方法(2)热分解法(适合一些不活泼金属)
(1)物理提取法:
适用于极不活泼的金属——Pt、Au3、金属冶炼的方法一、金属矿物的开发利用(3)热还原法(适用于大部分金属)常见的还原剂;焦碳、一氧化碳、氢气等(4)电解法(适合一些非常活泼金属) 铝热反应
实验4-1 注意观察现象探究实验4 - 1反应现象:镁条剧烈燃烧,放出大量热,发出耀眼白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。铝热剂 铝——还原剂
(活泼金属——可作还原剂)应用:
(1)焊接钢轨,
(2)冶炼金属(3)定向爆破。其它的铝热反应:2Cr + Al2O39Co + 4Al2O3小结:冶金的一般方法:K、Ca、Na、Mg、AlZn、Fe、Sn、Pb(H)、CuHg、Ag强————————————→弱弱————————————→强电解法热还原法热分
解法Pt、 Au物理提取法表4-1 常见金属的冶炼原理金属冶炼原理FeFe2O3+3CO===2Fe+3CO2(高炉炼铁)
Fe2O3+2Al===2Fe+Al2O3(铝热法炼铁)高温高温CuCu2S+O2===2Cu+SO2(火法炼铜)
Fe+CuSO4===FeSO4+Cu(湿法炼铜)高温MgMgO+C===Mg+CO↑
MgCl2(熔融)===Mg+Cl2↑高温Al2Al2O3(熔融)===4Al+3O2↑电解冰晶石Na2NaCl(熔融)===2Na+Cl2↑
电解电解练习1、下列各种冶炼方法中,可以制得
相应金属的是( )
A、加热氧化铝 B、加热碳酸钙
C、电解熔融氯化钠
D、氯化钠与铝粉高温共热
2、根据金属在金属活动顺序表中的位置
及性质,推测制取下列金属最适宜的方法:
①Na ②Zn
③Hg ④Au
C电解法加热还原法加热分解法物理提取法金银人类最早发现和应用的金属分别是:铜铜是人类第一种大量使用的金属,结束了漫长的“石器时代”. 在公元前6000年到7000年左右,人类开始迈进了象征古代文明开端的“铜器时代”。古老的冶炼技术(2)湿法炼铜
Fe+CuSO4===FeSO4+Cu五、铜的冶炼:分析一下早晚应用是什么原因呢?铜 镜汉武帝时铜币先秦刀币现代的冶炼技术最近——生物炼铜原理:优点:(1)成本低;
(2)污染小,反应条件简单;
(3)品质很差的矿石也能被利用。 我国古代炼铁工业长期领先于世界,我们在西汉初时已经懂得用木炭与铁矿石混合高温冶炼生铁,领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。古代中国劳动人民用木炭炼铁 1996年之后,我国再度成为钢铁产量最大的国家。 现代炼铁:铁矿石(化合态)→铁单质(游离态)(3)基本反应原理:(4)设备:铁矿石,焦炭,石灰石,空气(1)原料:高炉 (5)造渣(除脉石):
CaCO3 = CO2+CaO
CaO+SiO2 = CaSiO3(熔剂:石灰石)
(2)产生还原剂: C+O2=CO2
CO2+C=2CO (空气,焦炭)点燃点燃高温高温4、合理开发和利用矿物资源的途径:金属铝的回收与利用合理开发和利用矿物资源,主要途径有:… … … … …二、海水资源的开发和利用钓鱼岛问题与讨论:钓鱼岛,是钓鱼岛列岛的主岛,是中华人民共和国固有领土,面积为约6.344平方公里,四周海域是一片丰饶的渔场,海底还蕴藏着比较丰富的油气田。 问题与讨论 海水中蕴含着丰富的水资源和化学资源,21世纪人类将重点开发海洋资源。含80多种元素,以氢、氧、
氯、钠、镁、硫、钙、钾等
较多。被称为“元素的故乡”。海水中铀多达45亿吨
是已知陆地铀矿储量
的4500倍。氘有50亿
吨足够人类用上千万
年海水中的化学资源海洋中的矿产资源海洋能源的利用具有开发价值的:潮汐发电和波浪发电海水资源其他资源物质海洋资源能量获得海水资源的广泛性:海洋约占地球表面积71%
海洋中的资源 :
动物:(鱼类、海狮、海马、贝类………
植物:(海草、海带…………
矿物:(各种盐、NaCl、MgCl2 ……….
海底金属结核矿、石油
水 : (水资源及各种溶解的盐类
35资料海水资源的广泛性:海水提Mg海水淡化海水提取NaClBr2的提取海水综合利用联合工业体系一例(海水淡化的方法主要有蒸馏法、电渗析法、
离子交换法等。) 海水蒸馏原理示意图(海水水资源的利用)进出原理:
加热到水的沸点,液态水变为水蒸气与海水中的盐分离,水蒸汽冷凝得到淡水。任务1:海水的淡化:太阳能蒸发海水示意图: 任务1:海水的淡化:盐场工人在晒盐1、晒盐法任务二:海水中提取NaCl正极负极阴极
铁棒阳极
石墨2、氯气的工业制法2、氯气的工业制法 人们把以电解食盐水为基础制取氯气、烧碱(NaOH)等产品的工业称为“氯碱工业”。原理:阴极产物阳极产物电解饱和食盐水 科学探究:
如何证明海带中有碘离子?
阅读P91实验4-2 化学方程式:
2KI + H2O2 + H2SO4=== I2+ K2SO4 + 2H2O海带提碘:海带海带灰溶解过滤灼烧残渣含I-的溶液稀H2SO4
H2O2含I2的溶液含I2的有机溶液萃取任务三:知识拓展 从海水中提取Br2坩埚证明海带中含有碘,有以下步骤①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及H2O2,然后加入几滴淀粉溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤.(1)合理的步骤是____________(2)证明含碘的步骤是_______, 现象是_____________________, 反应的离子方程式是 __________________________③①④②②滴入淀粉溶液,溶液变蓝 思考与交流:
如何将海水中的溴离子转变成溴单质?1、设计海水提溴的实验流程图;
2、写出相关的化学方程式。浓缩海水Br2HBr溶液Br2任务四:知识应用 海水中提取Br2(阅读教材P91页资料卡片——海水提溴)①2NaBr + Cl2= Br2+2NaCl② 2H2O +Br2+SO2=H2SO4+2HBr③2HBr + Cl2=Br2+2HCl海水提Br2的实验室模拟装置--是空气吹出法 思考:1、用什么方法提取反应③后溶液中的溴单质?实验室提取溴单质所用主要仪器是什么?思考2:萃取Br2、I2常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?碘的有机溶液紫红溴的有机溶液海水镁飞机镁被誉为“国防金属”,60%的镁从海水提取任务五:知识拓展 从海水中提取镁含Mg2+、Br-过滤浓缩结晶脱水固体加热熔融工业从卤水中提取镁的工艺流程图:任务五:知识拓展 从海水中提取Mg思考:上述流程中,各个池子中发生了那些化学反应?写出化学方程式?电解相关反应归纳提升用到了那些分离、提纯的方法那? Cl2谈本节课的收获你的收获提取物质的一般过程和方法未来海洋空间利用
