人教版高中化学必修二 1.1.2 核素 课件:19张PPT
文档属性
| 名称 | 人教版高中化学必修二 1.1.2 核素 课件:19张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 771.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 09:57:50 | ||
图片预览






文档简介
课件19张PPT。1.1.2《同位素与核素》第一节《元素周期表》
第3课时教学目标
知识与能力
1、知道核素、同位素的涵义,了解放射性元素、放射性同位素在能源、农业、医疗、考古等方面的应用。
2、了解质量数和原子符号(AX)的涵义
3、了解核素的相对原子质量和元素的相对原子质量。
教学重点:
核素、同位素的涵义。
教学难点:
核素和元素的相对原子质量。Z我们不防来看一看:
我们前辈是如何来认识原子的 1、公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
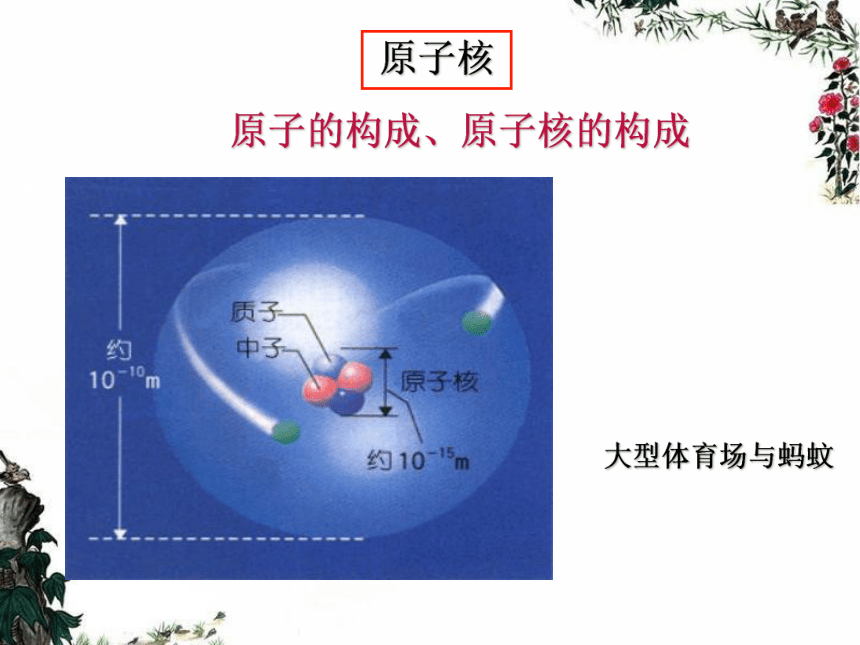
2、 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。历史回顾3、1897年,英国科学家汤姆生发现了电子。 原子的构成、原子核的构成 大型体育场与蚂蚊原子核原子的组成原子原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)=核外电子数
原子不显电性核外电子质量用相对质量来表示相对质量 1/1836相对质量 1.007相对质量 1.008Z个N个原子质量数A数值上Z+N=A取整数相加原子序数等于[归纳与整理] 2、质量数与质子数和中子数间的关系。
质量数:原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值。
质量数(A)= 质子数(Z)+中子数(N)
核电荷数=核内质子数=原子核外电子数
——元素符号质量数 —— 核电荷数 ——
(核内质子数)a——代表质量数;
b——代表核电荷数;
c——代表离子的电荷数;
d——代表化合价a b c d各代表什么请看下列表示 Z 决定元素种类原子组成的表示方法1. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?( 11, 11 )2. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( 33 )解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外
电子数是16,则16+17=33。课堂练习课堂练习3、X元素原子的质量数为m,核内中子数为n,则WgX+含有电子的物质的量(mol)是
(提示:元素的相对原子质量近似等于质量数)
A. (m-n)×W/m
B. (m-n-1)×W/m
C. (m+n)×W/m
D. (m-n+1)×W/mB氢元素的三种原子 氕 氘 氚
H D T
重氢 超重氢这三种微粒是同一种原子吗?是同一种元素吗?可见它们是氢元素的三种不同原子,把这三种原子叫核素.把这三种原子互称为同位素.2、核素:具有一定数目的质子和一定数目中子的一种原子 1、元素: 具有相同核电荷数(质子数)的同一类原子。同种元素:原子的原子核中质子数______。
同种元素:原子的原子核中中子数可以 _____。
同种元素:可以有 ______ 种不同原子。相同不相同[归纳与整理](二)元素、核素、同位素:几再如:3、同位素
把原子里具有相同质子数和不同中子数的原子互称为同位素。
即:两同(同质子数、同一元素)
两不同(中子数不同、原子不同)
其特点为:
⑴同位素在周期表里占据同一位置。
⑵同位素的化学性质几乎完全相同,物理性质略有差异
⑶在天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子个数百分比(丰度)一般为定值。 ⑷ 同种元素的不同的同位素原子也可 组成不同的单质或化合物的分子。
如: 氢: 氕、 氘、 氚
氢 重氢 超重氢
元素符号: H H H
原子符号: 11H 12H 13H
H D T
单质:
与氧化合成水: 这些水分子的最大式量_____,
最小式量_____,共有___种式量。22518H2、 D2 、 T2、H-D、H-T、D-TH2O、D2O、T2O、HDO、DTO、HTO课堂练习4、在(1)Li、(2) N、(3) Na、 (4) Mg、(5) Li、(6) C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。(1)(5)(2)(6)(3)(4)思考:下列符号代表几种元素?
几种原子?
4018Ar 4019K 4220Ca
4119K 4020Ca 4019K+ 三五Cl元素相对原子质量=M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453 例:Cl元素相对原子质量的计算
知识与能力
1、知道核素、同位素的涵义,了解放射性元素、放射性同位素在能源、农业、医疗、考古等方面的应用。
2、了解质量数和原子符号(AX)的涵义
3、了解核素的相对原子质量和元素的相对原子质量。
教学重点:
核素、同位素的涵义。
教学难点:
核素和元素的相对原子质量。Z我们不防来看一看:
我们前辈是如何来认识原子的 1、公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
2、 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。历史回顾3、1897年,英国科学家汤姆生发现了电子。 原子的构成、原子核的构成 大型体育场与蚂蚊原子核原子的组成原子原子核质子中子带负电荷带正电荷不带电荷1.6748×10-27千克 1.6726×10-27千克 9.1176×10-31千克 质子数(核电荷数)=核外电子数
原子不显电性核外电子质量用相对质量来表示相对质量 1/1836相对质量 1.007相对质量 1.008Z个N个原子质量数A数值上Z+N=A取整数相加原子序数等于[归纳与整理] 2、质量数与质子数和中子数间的关系。
质量数:原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值。
质量数(A)= 质子数(Z)+中子数(N)
核电荷数=核内质子数=原子核外电子数
——元素符号质量数 —— 核电荷数 ——
(核内质子数)a——代表质量数;
b——代表核电荷数;
c——代表离子的电荷数;
d——代表化合价a b c d各代表什么请看下列表示 Z 决定元素种类原子组成的表示方法1. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?( 11, 11 )2. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( 33 )解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外
电子数是16,则16+17=33。课堂练习课堂练习3、X元素原子的质量数为m,核内中子数为n,则WgX+含有电子的物质的量(mol)是
(提示:元素的相对原子质量近似等于质量数)
A. (m-n)×W/m
B. (m-n-1)×W/m
C. (m+n)×W/m
D. (m-n+1)×W/mB氢元素的三种原子 氕 氘 氚
H D T
重氢 超重氢这三种微粒是同一种原子吗?是同一种元素吗?可见它们是氢元素的三种不同原子,把这三种原子叫核素.把这三种原子互称为同位素.2、核素:具有一定数目的质子和一定数目中子的一种原子 1、元素: 具有相同核电荷数(质子数)的同一类原子。同种元素:原子的原子核中质子数______。
同种元素:原子的原子核中中子数可以 _____。
同种元素:可以有 ______ 种不同原子。相同不相同[归纳与整理](二)元素、核素、同位素:几再如:3、同位素
把原子里具有相同质子数和不同中子数的原子互称为同位素。
即:两同(同质子数、同一元素)
两不同(中子数不同、原子不同)
其特点为:
⑴同位素在周期表里占据同一位置。
⑵同位素的化学性质几乎完全相同,物理性质略有差异
⑶在天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子个数百分比(丰度)一般为定值。 ⑷ 同种元素的不同的同位素原子也可 组成不同的单质或化合物的分子。
如: 氢: 氕、 氘、 氚
氢 重氢 超重氢
元素符号: H H H
原子符号: 11H 12H 13H
H D T
单质:
与氧化合成水: 这些水分子的最大式量_____,
最小式量_____,共有___种式量。22518H2、 D2 、 T2、H-D、H-T、D-TH2O、D2O、T2O、HDO、DTO、HTO课堂练习4、在(1)Li、(2) N、(3) Na、 (4) Mg、(5) Li、(6) C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。(1)(5)(2)(6)(3)(4)思考:下列符号代表几种元素?
几种原子?
4018Ar 4019K 4220Ca
4119K 4020Ca 4019K+ 三五Cl元素相对原子质量=M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453 例:Cl元素相对原子质量的计算
