人教版高中化学选修四1.1 化学反应与能量变化
文档属性
| 名称 | 人教版高中化学选修四1.1 化学反应与能量变化 |

|
|
| 格式 | zip | ||
| 文件大小 | 929.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-02 00:00:00 | ||
图片预览






文档简介
课件24张PPT。第一章 化学反应与能量 §1.1 焓变 反应热
热化学方程式
反应中的能量变化白磷的燃烧氨的燃烧化学反应伴随着能量的放出,如转化为热能、电能、光能等等1.镁与盐酸反应的化学方程式: ?????????????????????。
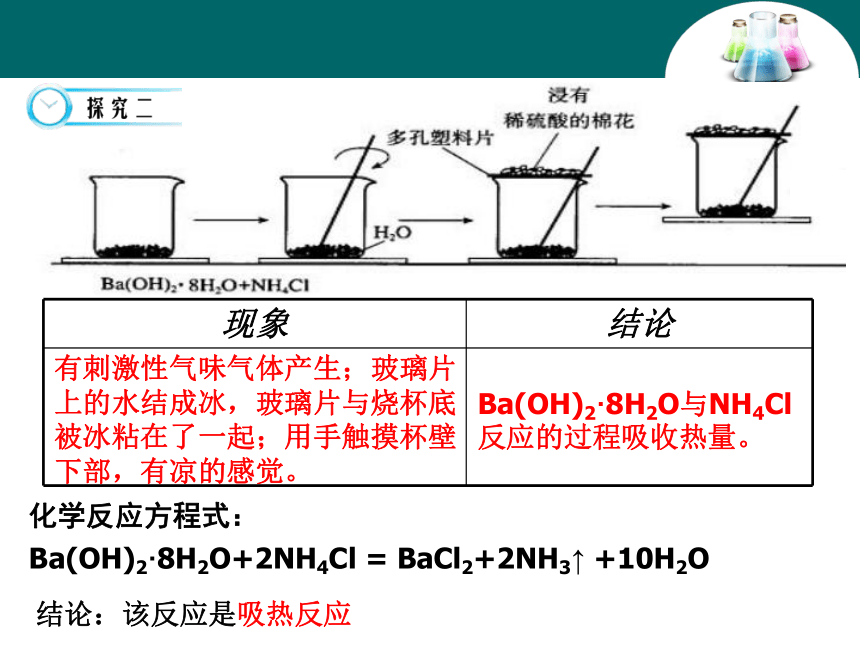
2.在反应过程中你将能看到什么现象?思考与讨论:实验记录:有气泡冒出,溶液的温度明显升高。镁与盐酸反应的过程放出热量。有刺激性气味气体产生;玻璃片上的水结成冰,玻璃片与烧杯底被冰粘在了一起;用手触摸杯壁下部,有凉的感觉。Ba(OH)2·8H2O与NH4Cl反应的过程吸收热量。化学反应方程式:
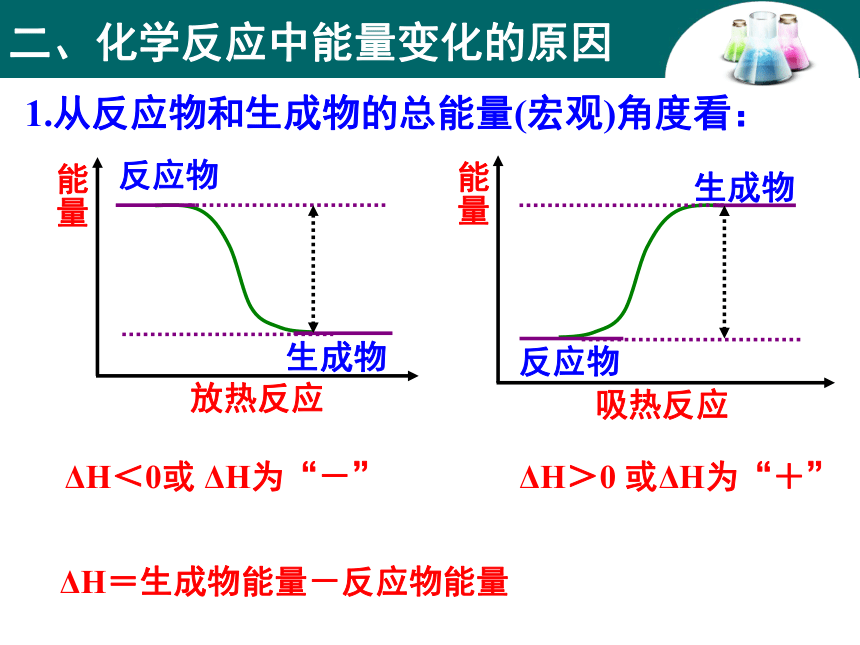
Ba(OH)2·8H2O+2NH4Cl = BaCl2+2NH3↑ +10H2O结论:该反应是吸热反应一、焓变 反应热 1、定义:化学反应过程中所放出或吸收的热量,叫做反应热。若反应是在恒压条件下进行,可称为“焓变”。符号: ΔH ,单位:kJ/mol 或 kJ?mol-1吸热反应:吸收热量的化学反应ΔH<0或 ΔH为“-”ΔH>0或 ΔH为“+”放热反应:放出热量的化学反应常见的放热反应和吸热反应放热反应燃料的燃烧(与O2的反应)吸热反应C+CO2(高温)铝热反应物质的缓慢氧化大部分化合反应(生石灰和水)活泼金属与水或酸的反应中和反应多数铵盐溶于水大部分分解反应CaCO3高温分解Ba(OH)2·8H2O+NH4ClH2+CuO(高温)C+H2O(高温)5.有下列反应:
①氧化钙与水反应 ②碳酸氢钠受热分解
③硫酸与氢氧化钠溶液混合 ④燃烧煤炭取暖 ⑤钠与水反应 ⑥胆矾受热失去结晶水,
其中为吸热反应的是 ,
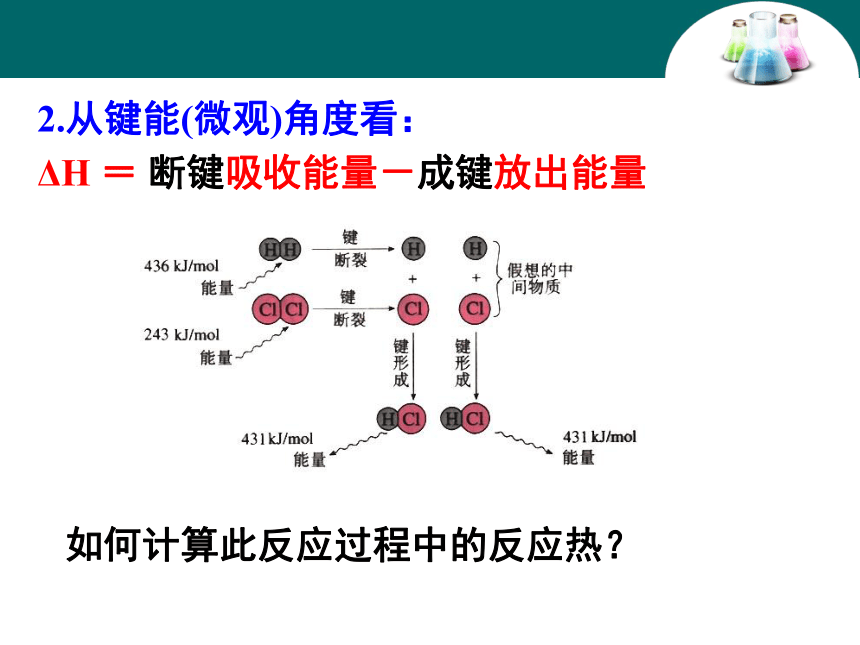
放热反应的是 。①③④⑤②⑥1.从反应物和生成物的总能量(宏观)角度看:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”ΔH=生成物能量-反应物能量二、化学反应中能量变化的原因2.从键能(微观)角度看:ΔH = 断键吸收能量-成键放出能量如何计算此反应过程中的反应热?知识回顾:化学反应的本质是什么?旧化学键的破坏和新化学键的形成。吸收能量释放能量H2 + Cl2 = 2HClH-HCl-Cl436KJ/mol吸收243KJ/mol吸收键断裂H
HCl
Cl+
+键形成H-ClH-Cl431KJ/mol431KJ/mol释放= 反应物总键能-生成物总键能ΔH = 吸收能量 - 放出能量H2(g)+Cl2(g) = 2HCl(g)反应的能量变化如图所示:由图可知,1 mol H2分子中的化学键断裂吸收的能量是 ,1 mol Cl2分子中的化学键断裂吸收的能量是 ,2 mol HCl分子中的化学键形成释放的能量是 ,则H2(g)+Cl2(g)===2HCl(g)的反应放出的热量为 。436 kJ243 kJ862 kJ183 kJ?H = E1 - E2?H=E(生成物的总能量)- E(反应物的总能量)ΔH=旧键吸收能量-成键放出能量旧化学键断裂吸收的能量E1表示:E2表示:新化学键形成放出的能量1.已知反应:2H2(g)+O2(g)===2H2O (l)ΔH<0,该反应属于________(填“吸热”或“放热”)反应,据此完成下列各题:
(1)ΔH 的单位是___________________,且在______条件下等于反应热。
(2)该反应中,H2 和 O2______化学键________的能量小于
H2O________化学键________的能量。
放热kJ/mol(或kJ·mol-1)恒压断裂吸收 形成 释放 练习练习:哪些图是放热反应,哪些是吸热反应?图 1图 2图 3图 4ΔH = E(生成物的总能量)- E(反应物的总能量)
= E(反应物的总键能)- E(生成物的总键能)结论:
ΔH决定于反应物的总能量与生成物的总能量的相对大小,
ΔH决定于反应物的总键能与生成物的总键能的相对大小。物质的稳定性:键能大稳定和能量低稳定2、观察与分析△H= + 44 kJ/mol二.热化学方程式表明反应所吸收或放出热量的化学方程式1、定义:1.热化学方程式中计量数的化学含义?
2.化学计量数与反应热数值的关系?
3.为什么要标明反应物、生成物状态? 1.化学计量数表示反应物消耗或生成物生成的物质的量,可以整数或小数。思考:3.物质状态变化同时也有能量变化2.反应热数值和计量数对应比例。⑴ 一般应注明反应的温度、压强;因为△H 与实验的条件、物质的状态有关!(250C ,101kPa时不注明)⑵ 一定标明各物质的状态(s、l、g、aq) ⑶ ΔH 只放右边,以空格与标有物质状态的化学方程式隔开(数值及单位) 放热:ΔH < 0 ,吸热:ΔH > 0; ⑷ 系数仅仅表示物质的量,不表示分子或原子个数;
故系数可以是整数、分数、小数; ⑸ΔH 的值与系数相匹配。系数加倍,ΔH 值也加倍。正逆反应的ΔH 绝对值相等,符号相反。例1:当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6kJ的热量,请写出该反应的热化学方程式。H2(g) + Cl2(g) = 2HCl(g) ?H =-184.6 kJ/mol2H2(g) + 2Cl2(g) = 4HCl(g) ?H =-369.2 kJ/mol例2:1mol N2(g) 与适量O2(g) 反应生成NO2 (g),
需吸收68kJ的热量;写出热化学方程式。N2(g) + 2O2(g) = 2NO2 (g) ?H = + 68 kJ/mol例3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧
生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol C状态ΔH = – 445 kJ/molΔH>0 ΔH<0 聚集状态(S-固、l-液、g-气) 整数 分数 ΔH 相等 相反 1、在反应H2 + Cl2=2HCl中,已知H-H
键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反( )
A. 吸热反应
B. 放热反应
C. 吸收179kJ热量
D.放出179kJ热量B D2、1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。3、拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。 +131.5-92KJ/mol-30.7KJ/molA4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( ) H2O(g)=H2(g)+1/2O2(g);
ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(l);
ΔH=-484kJ·mol-1
H2(g)+1/2O2(g)=H2O(g);
ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(g);
ΔH=+484kJ·mol-1
热化学方程式
反应中的能量变化白磷的燃烧氨的燃烧化学反应伴随着能量的放出,如转化为热能、电能、光能等等1.镁与盐酸反应的化学方程式: ?????????????????????。
2.在反应过程中你将能看到什么现象?思考与讨论:实验记录:有气泡冒出,溶液的温度明显升高。镁与盐酸反应的过程放出热量。有刺激性气味气体产生;玻璃片上的水结成冰,玻璃片与烧杯底被冰粘在了一起;用手触摸杯壁下部,有凉的感觉。Ba(OH)2·8H2O与NH4Cl反应的过程吸收热量。化学反应方程式:
Ba(OH)2·8H2O+2NH4Cl = BaCl2+2NH3↑ +10H2O结论:该反应是吸热反应一、焓变 反应热 1、定义:化学反应过程中所放出或吸收的热量,叫做反应热。若反应是在恒压条件下进行,可称为“焓变”。符号: ΔH ,单位:kJ/mol 或 kJ?mol-1吸热反应:吸收热量的化学反应ΔH<0或 ΔH为“-”ΔH>0或 ΔH为“+”放热反应:放出热量的化学反应常见的放热反应和吸热反应放热反应燃料的燃烧(与O2的反应)吸热反应C+CO2(高温)铝热反应物质的缓慢氧化大部分化合反应(生石灰和水)活泼金属与水或酸的反应中和反应多数铵盐溶于水大部分分解反应CaCO3高温分解Ba(OH)2·8H2O+NH4ClH2+CuO(高温)C+H2O(高温)5.有下列反应:
①氧化钙与水反应 ②碳酸氢钠受热分解
③硫酸与氢氧化钠溶液混合 ④燃烧煤炭取暖 ⑤钠与水反应 ⑥胆矾受热失去结晶水,
其中为吸热反应的是 ,
放热反应的是 。①③④⑤②⑥1.从反应物和生成物的总能量(宏观)角度看:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”ΔH=生成物能量-反应物能量二、化学反应中能量变化的原因2.从键能(微观)角度看:ΔH = 断键吸收能量-成键放出能量如何计算此反应过程中的反应热?知识回顾:化学反应的本质是什么?旧化学键的破坏和新化学键的形成。吸收能量释放能量H2 + Cl2 = 2HClH-HCl-Cl436KJ/mol吸收243KJ/mol吸收键断裂H
HCl
Cl+
+键形成H-ClH-Cl431KJ/mol431KJ/mol释放= 反应物总键能-生成物总键能ΔH = 吸收能量 - 放出能量H2(g)+Cl2(g) = 2HCl(g)反应的能量变化如图所示:由图可知,1 mol H2分子中的化学键断裂吸收的能量是 ,1 mol Cl2分子中的化学键断裂吸收的能量是 ,2 mol HCl分子中的化学键形成释放的能量是 ,则H2(g)+Cl2(g)===2HCl(g)的反应放出的热量为 。436 kJ243 kJ862 kJ183 kJ?H = E1 - E2?H=E(生成物的总能量)- E(反应物的总能量)ΔH=旧键吸收能量-成键放出能量旧化学键断裂吸收的能量E1表示:E2表示:新化学键形成放出的能量1.已知反应:2H2(g)+O2(g)===2H2O (l)ΔH<0,该反应属于________(填“吸热”或“放热”)反应,据此完成下列各题:
(1)ΔH 的单位是___________________,且在______条件下等于反应热。
(2)该反应中,H2 和 O2______化学键________的能量小于
H2O________化学键________的能量。
放热kJ/mol(或kJ·mol-1)恒压断裂吸收 形成 释放 练习练习:哪些图是放热反应,哪些是吸热反应?图 1图 2图 3图 4ΔH = E(生成物的总能量)- E(反应物的总能量)
= E(反应物的总键能)- E(生成物的总键能)结论:
ΔH决定于反应物的总能量与生成物的总能量的相对大小,
ΔH决定于反应物的总键能与生成物的总键能的相对大小。物质的稳定性:键能大稳定和能量低稳定2、观察与分析△H= + 44 kJ/mol二.热化学方程式表明反应所吸收或放出热量的化学方程式1、定义:1.热化学方程式中计量数的化学含义?
2.化学计量数与反应热数值的关系?
3.为什么要标明反应物、生成物状态? 1.化学计量数表示反应物消耗或生成物生成的物质的量,可以整数或小数。思考:3.物质状态变化同时也有能量变化2.反应热数值和计量数对应比例。⑴ 一般应注明反应的温度、压强;因为△H 与实验的条件、物质的状态有关!(250C ,101kPa时不注明)⑵ 一定标明各物质的状态(s、l、g、aq) ⑶ ΔH 只放右边,以空格与标有物质状态的化学方程式隔开(数值及单位) 放热:ΔH < 0 ,吸热:ΔH > 0; ⑷ 系数仅仅表示物质的量,不表示分子或原子个数;
故系数可以是整数、分数、小数; ⑸ΔH 的值与系数相匹配。系数加倍,ΔH 值也加倍。正逆反应的ΔH 绝对值相等,符号相反。例1:当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6kJ的热量,请写出该反应的热化学方程式。H2(g) + Cl2(g) = 2HCl(g) ?H =-184.6 kJ/mol2H2(g) + 2Cl2(g) = 4HCl(g) ?H =-369.2 kJ/mol例2:1mol N2(g) 与适量O2(g) 反应生成NO2 (g),
需吸收68kJ的热量;写出热化学方程式。N2(g) + 2O2(g) = 2NO2 (g) ?H = + 68 kJ/mol例3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧
生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol C状态ΔH = – 445 kJ/molΔH>0 ΔH<0 聚集状态(S-固、l-液、g-气) 整数 分数 ΔH 相等 相反 1、在反应H2 + Cl2=2HCl中,已知H-H
键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反( )
A. 吸热反应
B. 放热反应
C. 吸收179kJ热量
D.放出179kJ热量B D2、1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。3、拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。 +131.5-92KJ/mol-30.7KJ/molA4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( ) H2O(g)=H2(g)+1/2O2(g);
ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(l);
ΔH=-484kJ·mol-1
H2(g)+1/2O2(g)=H2O(g);
ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(g);
ΔH=+484kJ·mol-1
