人教版高中化学选修五 3.3 羧酸 酯 课件42张PPT
文档属性
| 名称 | 人教版高中化学选修五 3.3 羧酸 酯 课件42张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 10:54:57 | ||
图片预览






文档简介
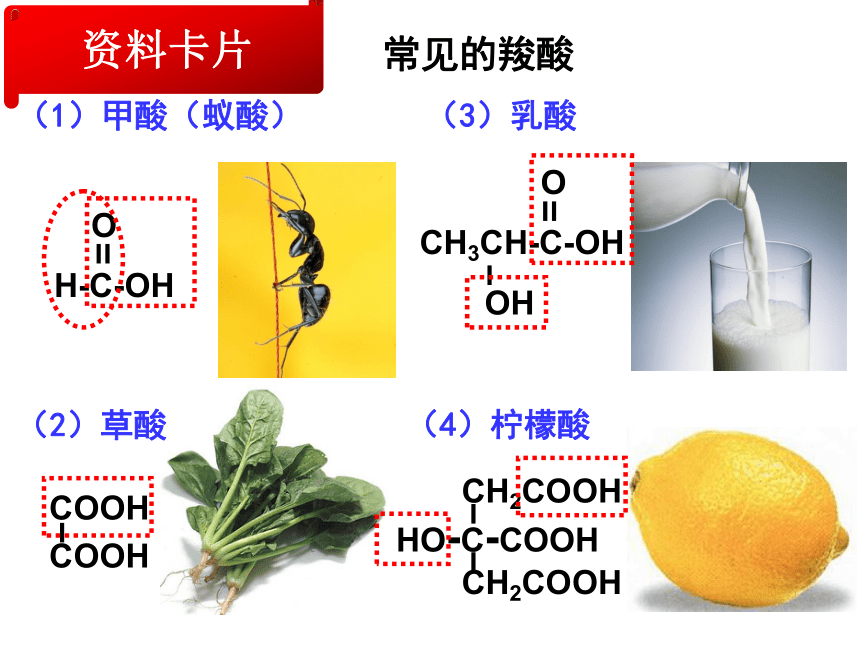
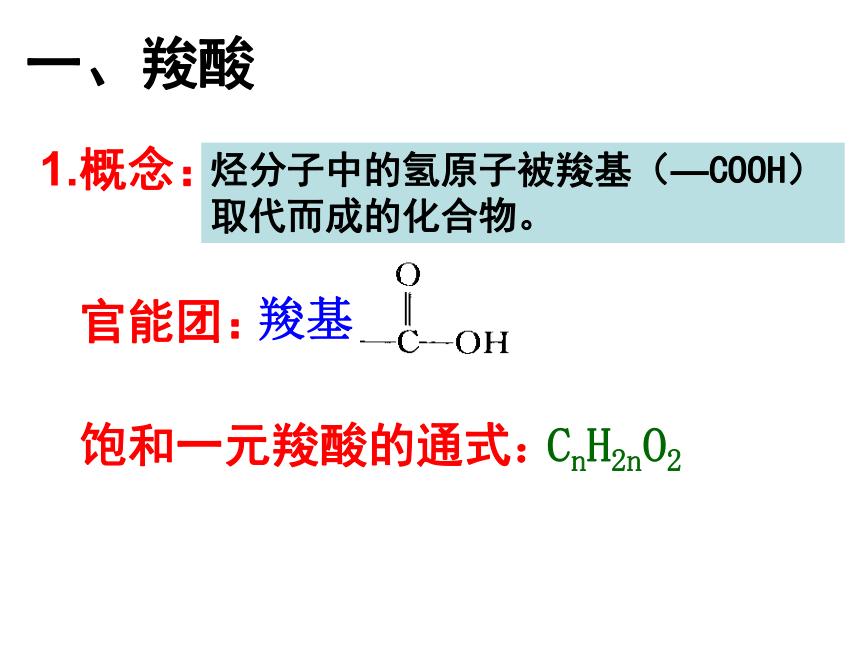
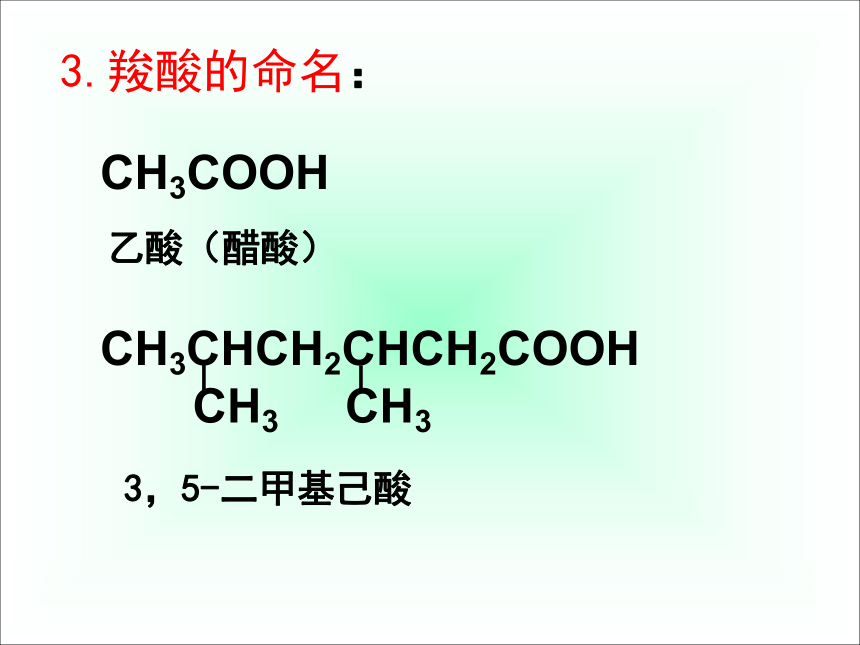
课件42张PPT。第三节 羧酸 酯第三章 烃的含氧衍生物常见的羧酸(1)甲酸(蚁酸)资料卡片(4)柠檬酸(3)乳酸(2)草酸烃分子中的氢原子被羧基(—COOH)取代而成的化合物。官能团:一、羧酸1.概念:羧基饱和一元羧酸的通式:CnH2nO22.羧酸的分类:按烃基的种类按羧基的数目按碳原子的数目脂肪酸芳香酸一元羧酸二元羧酸多元羧酸低级脂肪酸高级脂肪酸CH3CH2COOH(丙酸)C6H5-COOH(苯甲酸)CH2=CH-COOH(丙烯酸)HOOC-COOH(乙二酸)硬脂酸C17H35COOH软脂酸C15H31COOH油酸C17H33COOHCH3CH2COOH(丙酸)(丙三酸)3.羧酸的命名:CH3COOH乙酸(醋酸)3,5-二甲基己酸二、乙酸的物理性质颜 色:
气 味:
状 态:
密 度:
溶解性:
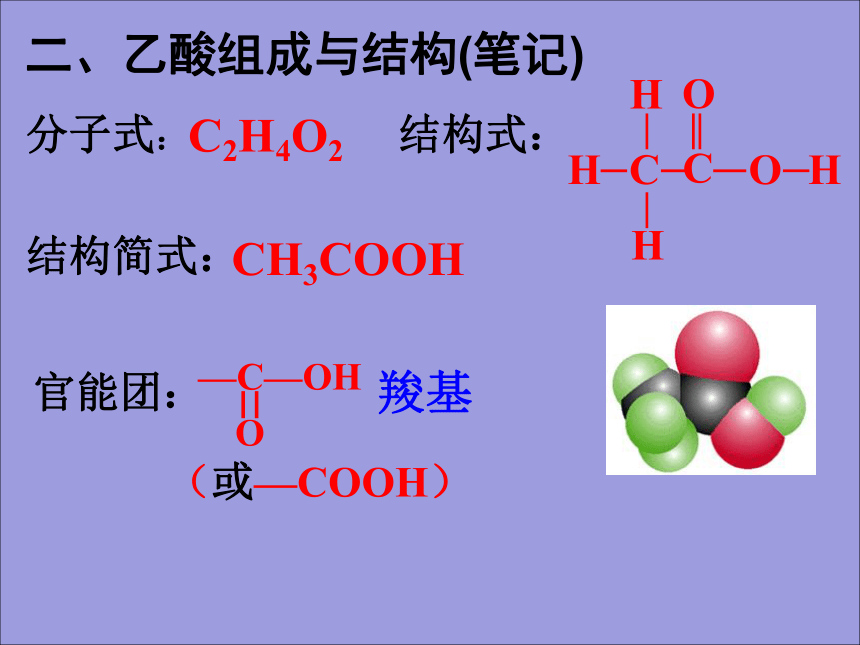
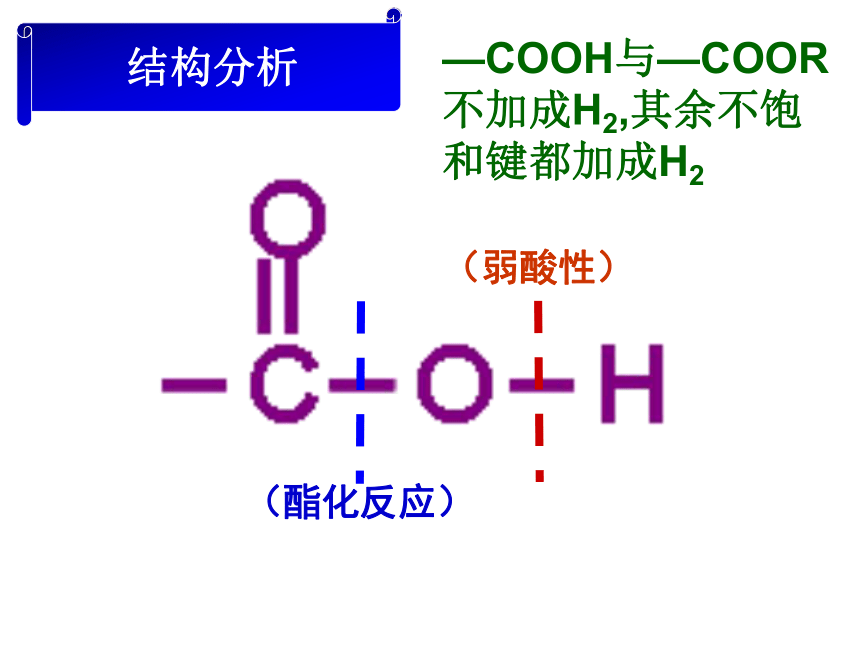
挥发性:无色透明强烈刺激性气味液体比水小易溶于水和乙醇易挥发,16.6℃以下易凝结成冰一样的晶体(冰醋酸)—COOH亲水基团二、乙酸组成与结构(笔记)
C2H4O2CH3COOH羧基(或—COOH)结构分析(弱酸性) (酯化反应) —COOH与—COOR不加成H2,其余不饱和键都加成H2三、乙酸的化学性质1、弱酸性a、酸
碱
指
示
剂b、与
碱
c、与
碱性氧化物
e、与某些盐(弱酸根)
(CO32-.HCO3-)d、氢前金属
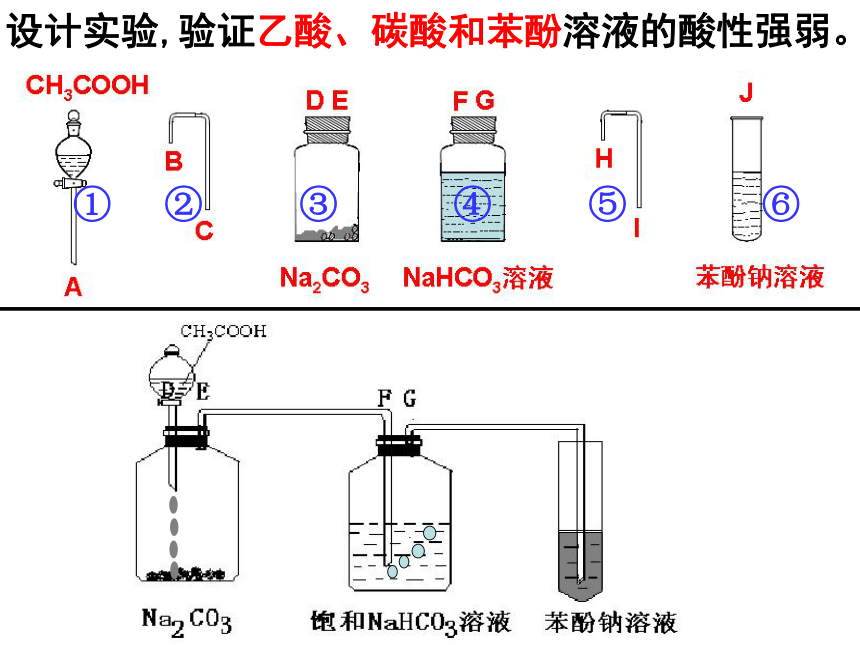
为什么水垢能用乙酸洗涤呢?设计实验,验证乙酸、碳酸和苯酚溶液的酸性强弱。① ② ③ ④ ⑤ ⑥课堂 思考:
可以用几种方法证明乙酸是弱酸?证明乙酸是弱酸的方法:
1.配制0.1mol/L乙酸测定PH值。
2.在相同条件下与同浓度盐酸比较导电性。
3.在相同条件下与同浓度的盐酸比较与金属反应的速率。
4.测定乙酸钠溶液的pH值。“酒是陈的香”可逆反应反应实质:酸脱-OH醇脱-H2、酯化反应:酸+醇→酯+水(取代反应)【补充】酯化反应是酸和醇均具有的性质。不仅有机酸和醇可以发生酯化反应,无机含氧酸也可以和醇酯化。
例:碎瓷片防暴沸导管在饱和Na2CO3液面上:防止倒吸长导管冷凝作用先小火
后大火加物顺序:乙醇→浓硫酸→乙酸①溶解乙醇;②中和乙酸;③降低乙酸乙酯的溶解度,利于酯的析出浓硫酸:催化剂、吸水剂(脱水)沸点:
乙酸乙酯(77.1)
乙醇(78.3 ℃ )
乙酸(118℃)酯化反应注意事项(乙酸乙酯的沸点为77℃)思考与交流 乙酸与乙醇的酯化反应是可逆的,在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请说明理由。(1)从反应物中不断蒸出乙酸乙酯(2)使用过量的乙醇(3)使用浓H2SO4作吸水剂几种可防倒吸的装置:CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能,产生CO2醇、酚、羧酸中羟基的比较温故知新√√√×√√××与金属钠反应:O—H:醇、酚、羧酸
与NaOH反应:酸性:酚、羧酸
与Na2CO3:酚(NaHCO3)、羧酸(CO2和水)
与NaHCO3:羧酸
H2:大多数不饱和键
Br2:1mol双键加成1molH2
1mol三键加成2molH2加成:1molC=C加成1molBr2
取代:一个H取代用去1molBr2戊
酸
戊
酯自然界中的有机酯丁
酸
乙
酯乙酸异戊酯1.酯的定义:简写为R-COOR′2.饱和一元羧酸和饱和一元醇反应生成的酯的通式为:CnH2nO2与饱和一元羧酸互为同分异构体。酯 类酯的命名酸的名称醇的名称某酸某酯乙二酸二乙酯
乙二酸乙二酯酸+ 醇 酯 + 水1、请说出下列酯的名称:HCOOCH3甲酸甲酯CH3COOCH3CH3CH2COOC2H5丙酸乙酯乙酸甲酯乙二酸二乙酯二乙酸乙二酯练习:与金属钠反应:O—H:醇、酚、羧酸
与NaOH反应:酸性:酚、羧酸
与Na2CO3:酚(NaHCO3)、羧酸(CO2和水)
与NaHCO3:羧酸
H2:大多数不饱和键
Br2:1mol双键加成1molH2
1mol三键加成2molH2加成:1molC=C加成1molBr2
取代:一个H取代用去1molBr2拓展:饱和一元羧酸与酯同分异构体书写羧酸与酯a、羧酸:取代法或插入法b、酯:分配法或插入法1、写出C4H8O2属于羧酸和酯的同分异构体(1)、羧酸①.取代法:以羧基(—COOH)作为取代基(2)、酯①.分配法:注意羧酸和醇的同分异构体注意C—H、C—C键的等效性酯的物理性质:一般密度比水小,难溶于水,易溶于乙醇、乙醚等有机溶剂,低级酯是具有芳香气味的液体。乙酸乙酯结构简式:CH3COOCH2CH3 官能团:酯基,-COOR化学性质——水解反应+H—OH 酯的水解是酯化的逆反应,正反应在哪里成键,逆反应就在那里断键。科学探究请设计对比实验探究:
乙酸乙酯在中性、酸性、碱性并加热的条件下的水解速率。对比实验1 mL乙酸乙酯
+3 mL蒸馏水1 mL乙酸乙酯
+3mL稀硫酸1试管70~80℃
水浴加热现 象无明显
变化1 mL乙酸乙酯
+3mLNaOH2试管3试管乙酸乙酯的气味变淡乙酸乙酯的气味消失结论:酯在碱性条件下水解程度最大,水解几乎趋于完全。酯在酸性条件下水解程度较小,水解具有可逆性。乙酸乙酯在酸性、碱性条件下的水解方程式:口诀:酸加-OH(或-ONa),醇加H
注
意
※ 稀硫酸只起催化作用。※ 碱既有催化作用,还能中和生成的酸,使水解程度增大,若碱过量则水解进行完全。1、甲酸、甲酸甲酯还有醛基的性质。
2、乙酸苯酯的碱性水解(笔记)
生成物得到几个酸性物质,就消耗几个NaOH。小 结酯的水解规律:1、酯的水解和酸与醇的酯化反应是可逆的。2、在有碱存在时, 酯的水解不可逆,趋近于完全。 (用化学平衡知识解释)2、根据球棍模型写出结构简式,并命名。CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能,产生CO2醇、酚、羧酸中羟基的比较温故知新√√√×√√××酯化反应与酯水解反应的比较NaOH中和酯水解生成的CH3COOH,提高酯的水解率浓 硫 酸稀H2SO4或NaOH吸水,提高CH3COOH与C2H5OH的转化率酒精灯火焰加热水浴加热酯化反应
取代反应水解反应
取代反应B3.拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如下图:
下列对该化合物叙述正确的是 ( )
A 属于芳香烃
B 属于卤代烃
C 在酸性条件下不水解
D 在一定条件下可以发生加成反应D 请写出以水、空气、乙烯为原料制取乙酸乙酯的相关化学方程式:练一练3.现有分子式为C3H6O2的四种有机物A、B、C、D,且分子内均含有甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:则A、B、C、D的结构简式分别为:
A: B:
C: D: CH3CH2COOHHCOOCH2CH3CH3COOCH3CH3CH(OH)CHO
气 味:
状 态:
密 度:
溶解性:
挥发性:无色透明强烈刺激性气味液体比水小易溶于水和乙醇易挥发,16.6℃以下易凝结成冰一样的晶体(冰醋酸)—COOH亲水基团二、乙酸组成与结构(笔记)
C2H4O2CH3COOH羧基(或—COOH)结构分析(弱酸性) (酯化反应) —COOH与—COOR不加成H2,其余不饱和键都加成H2三、乙酸的化学性质1、弱酸性a、酸
碱
指
示
剂b、与
碱
c、与
碱性氧化物
e、与某些盐(弱酸根)
(CO32-.HCO3-)d、氢前金属
为什么水垢能用乙酸洗涤呢?设计实验,验证乙酸、碳酸和苯酚溶液的酸性强弱。① ② ③ ④ ⑤ ⑥课堂 思考:
可以用几种方法证明乙酸是弱酸?证明乙酸是弱酸的方法:
1.配制0.1mol/L乙酸测定PH值。
2.在相同条件下与同浓度盐酸比较导电性。
3.在相同条件下与同浓度的盐酸比较与金属反应的速率。
4.测定乙酸钠溶液的pH值。“酒是陈的香”可逆反应反应实质:酸脱-OH醇脱-H2、酯化反应:酸+醇→酯+水(取代反应)【补充】酯化反应是酸和醇均具有的性质。不仅有机酸和醇可以发生酯化反应,无机含氧酸也可以和醇酯化。
例:碎瓷片防暴沸导管在饱和Na2CO3液面上:防止倒吸长导管冷凝作用先小火
后大火加物顺序:乙醇→浓硫酸→乙酸①溶解乙醇;②中和乙酸;③降低乙酸乙酯的溶解度,利于酯的析出浓硫酸:催化剂、吸水剂(脱水)沸点:
乙酸乙酯(77.1)
乙醇(78.3 ℃ )
乙酸(118℃)酯化反应注意事项(乙酸乙酯的沸点为77℃)思考与交流 乙酸与乙醇的酯化反应是可逆的,在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请说明理由。(1)从反应物中不断蒸出乙酸乙酯(2)使用过量的乙醇(3)使用浓H2SO4作吸水剂几种可防倒吸的装置:CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能,产生CO2醇、酚、羧酸中羟基的比较温故知新√√√×√√××与金属钠反应:O—H:醇、酚、羧酸
与NaOH反应:酸性:酚、羧酸
与Na2CO3:酚(NaHCO3)、羧酸(CO2和水)
与NaHCO3:羧酸
H2:大多数不饱和键
Br2:1mol双键加成1molH2
1mol三键加成2molH2加成:1molC=C加成1molBr2
取代:一个H取代用去1molBr2戊
酸
戊
酯自然界中的有机酯丁
酸
乙
酯乙酸异戊酯1.酯的定义:简写为R-COOR′2.饱和一元羧酸和饱和一元醇反应生成的酯的通式为:CnH2nO2与饱和一元羧酸互为同分异构体。酯 类酯的命名酸的名称醇的名称某酸某酯乙二酸二乙酯
乙二酸乙二酯酸+ 醇 酯 + 水1、请说出下列酯的名称:HCOOCH3甲酸甲酯CH3COOCH3CH3CH2COOC2H5丙酸乙酯乙酸甲酯乙二酸二乙酯二乙酸乙二酯练习:与金属钠反应:O—H:醇、酚、羧酸
与NaOH反应:酸性:酚、羧酸
与Na2CO3:酚(NaHCO3)、羧酸(CO2和水)
与NaHCO3:羧酸
H2:大多数不饱和键
Br2:1mol双键加成1molH2
1mol三键加成2molH2加成:1molC=C加成1molBr2
取代:一个H取代用去1molBr2拓展:饱和一元羧酸与酯同分异构体书写羧酸与酯a、羧酸:取代法或插入法b、酯:分配法或插入法1、写出C4H8O2属于羧酸和酯的同分异构体(1)、羧酸①.取代法:以羧基(—COOH)作为取代基(2)、酯①.分配法:注意羧酸和醇的同分异构体注意C—H、C—C键的等效性酯的物理性质:一般密度比水小,难溶于水,易溶于乙醇、乙醚等有机溶剂,低级酯是具有芳香气味的液体。乙酸乙酯结构简式:CH3COOCH2CH3 官能团:酯基,-COOR化学性质——水解反应+H—OH 酯的水解是酯化的逆反应,正反应在哪里成键,逆反应就在那里断键。科学探究请设计对比实验探究:
乙酸乙酯在中性、酸性、碱性并加热的条件下的水解速率。对比实验1 mL乙酸乙酯
+3 mL蒸馏水1 mL乙酸乙酯
+3mL稀硫酸1试管70~80℃
水浴加热现 象无明显
变化1 mL乙酸乙酯
+3mLNaOH2试管3试管乙酸乙酯的气味变淡乙酸乙酯的气味消失结论:酯在碱性条件下水解程度最大,水解几乎趋于完全。酯在酸性条件下水解程度较小,水解具有可逆性。乙酸乙酯在酸性、碱性条件下的水解方程式:口诀:酸加-OH(或-ONa),醇加H
注
意
※ 稀硫酸只起催化作用。※ 碱既有催化作用,还能中和生成的酸,使水解程度增大,若碱过量则水解进行完全。1、甲酸、甲酸甲酯还有醛基的性质。
2、乙酸苯酯的碱性水解(笔记)
生成物得到几个酸性物质,就消耗几个NaOH。小 结酯的水解规律:1、酯的水解和酸与醇的酯化反应是可逆的。2、在有碱存在时, 酯的水解不可逆,趋近于完全。 (用化学平衡知识解释)2、根据球棍模型写出结构简式,并命名。CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能,产生CO2醇、酚、羧酸中羟基的比较温故知新√√√×√√××酯化反应与酯水解反应的比较NaOH中和酯水解生成的CH3COOH,提高酯的水解率浓 硫 酸稀H2SO4或NaOH吸水,提高CH3COOH与C2H5OH的转化率酒精灯火焰加热水浴加热酯化反应
取代反应水解反应
取代反应B3.拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如下图:
下列对该化合物叙述正确的是 ( )
A 属于芳香烃
B 属于卤代烃
C 在酸性条件下不水解
D 在一定条件下可以发生加成反应D 请写出以水、空气、乙烯为原料制取乙酸乙酯的相关化学方程式:练一练3.现有分子式为C3H6O2的四种有机物A、B、C、D,且分子内均含有甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:则A、B、C、D的结构简式分别为:
A: B:
C: D: CH3CH2COOHHCOOCH2CH3CH3COOCH3CH3CH(OH)CHO
