人教版高中化学选修五1.4 研究有机化合物的一般步骤和方法
文档属性
| 名称 | 人教版高中化学选修五1.4 研究有机化合物的一般步骤和方法 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 00:00:00 | ||
图片预览










文档简介
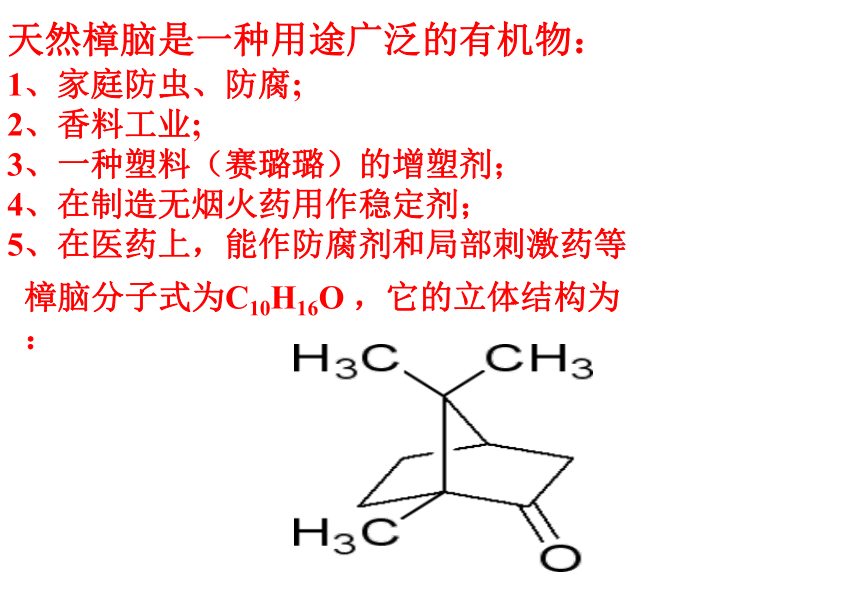
课件45张PPT。 第四节 研究有机化合物的一般步骤和方法天然樟脑是一种用途广泛的有机物:
1、家庭防虫、防腐;
2、香料工业;
3、一种塑料(赛璐璐)的增塑剂;
4、在制造无烟火药用作稳定剂;
5、在医药上,能作防腐剂和局部刺激药等 樟脑分子式为C10H16O ,它的立体结构为:有机物
(不纯)有机物(纯净)Ⅰ分离 提纯研究有机化合物的一般步骤确定实验式Ⅱ元素定性Ⅲ定量分析确定分子式Ⅳ测定相对
分子质量确定结构式Ⅴ化学性质波谱分析定性:燃烧产物确定元素种类定量:一定量的有机物燃烧所有产物的质量n(c):n(H):n(o)分离、提纯须知:2、物理方法:利用有机物与杂质物理性质的差异而将它们分开有机物分离的常用物理方法蒸馏
重结晶
萃取
分液1、化学方法:一般是加入或通过某种试剂进行化学反应以除去杂质。一、有机物的分离、提纯思考:怎样操作才能将工业酒精(含水)变成无水酒精?1、蒸馏蒸馏除掉酒精中的水变成无水乙醇,通常先加生石灰(CaO)蒸馏烧瓶冷凝管温度计尾接管冷水热水使用前要检查装置的气密性!1、蒸馏:用于分离、提纯互溶液态混合物的方法(2)蒸馏提纯的条件 杂质含量少;有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)(1)蒸馏的原理利用混合物中各成分沸点不同,除去难挥发或不挥发的杂质(3)蒸馏的注意事项:a、仪器组装的顺序:“先下后上,由左至右”;拆卸则相反; b、使用前须检查装置的气密性
c、温度计水银球的部位(与蒸馏烧瓶支管口齐平)
d、烧瓶中放少量沸石或素烧瓷片(防止暴沸)
e、进出水方向(下进上出——逆流换热)
f、烧瓶中所盛放液体体积不能超过烧瓶容积的2/3,不能将全部溶液蒸干资料:无水酒精的制取普通酒精含乙醇95.57%(质量)和水4.43%,这是恒沸点混合物,它的沸点是78.15℃,比纯乙醇的沸点(78.5℃)低。把这种混合物蒸馏时,气相和液相的组成是相同的,即乙醇和水始终以这个混合比率蒸出,不能用蒸馏法制得无水酒精。
实验室制备无水酒精时,在95.57%酒精中加入生石灰(CaO)加热回流,使酒精中的水跟氧化钙反应,生成不挥发的氢氧化钙来除去水分,然后再蒸馏,这样可得99.5%的无水酒精。如果还要去掉这残留的少量的水,可以加入金属镁来处理,可得100%乙醇,叫做绝对酒精。【思考与交流】
1、怎样操作才能达到目标?
提纯KNO3、NaCl混合物中的KNO3
提纯NaCl 、KNO3 混合物中的NaCl蒸发结晶冷却结晶冷却结晶主要对于混合溶液含有两种以上溶质,且有一种随温度的变化溶解度变化较大,提纯他就用冷却结晶从氯化钠与硝酸钾混合溶液中提纯硝酸钾(氯化钠少量)蒸发结晶适用于一切固体溶质从他们的溶液中分离,或从含两种以上溶质的混合溶液中提纯随温度的变化溶解度变化不大的物质如:从氯化钠与硝酸钾混合溶液中提纯氯化钠(硝酸钾少量),此处不蒸干。 2、进行上述实验时,用到的仪器有哪些?要注意哪些问题?2、重结晶原理:利用固体混合物中目标组分在某种溶剂中的溶解度随温度变化有明显差异,将有机物溶解在热的溶剂中制成饱和溶液,冷却后,由于溶解度减小,溶质又重新成晶体析出。由于产品与杂质在溶剂中的溶解度不同,可以通过过滤将杂质除去,从而达到分离提纯的目的。选择溶剂的要求:
杂质在溶剂中溶解度很大或很小(前一种情况杂质将留在母液中不析出,后一种情况是使杂质在热过滤时被除去)
目标组分在此溶剂中的溶解度,受温度的影响较大
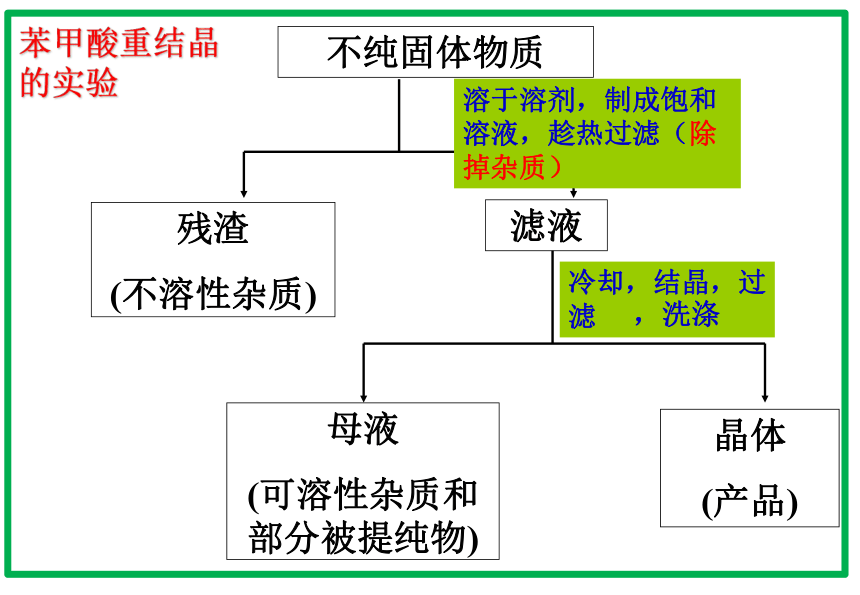
(该有机物在热溶液中的溶解度较大,在冷溶液中溶解度较小,冷却后易于形成晶体。)重结晶操作中的使用的仪器:烧杯、玻璃棒、石棉网、酒精灯、铁架台(或三脚架)、漏斗 在苯甲酸重结晶的实验中,滤液放置冷却可以结晶出纯净的苯甲酸晶体。请你思考并与同学交流:温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?(教材)不纯固体物质残渣
(不溶性杂质)滤液母液
(可溶性杂质和部分被提纯物)晶体
(产品)溶于溶剂,制成饱和溶液,趁热过滤(除掉杂质)苯甲酸重结晶的实验【思考与交流】
(1)如何提取溴水中的溴?
(2)实验原理是什么?
(3)用到的实验仪器(玻璃仪器)有哪些?
(4)如何选取萃取剂?
(5)这样得到的溴纯净吗?如果不纯,如何处理?
(6)实验过程要注意哪些问题?3、萃取3、萃取萃取固—液萃取液—液萃取萃取:用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法萃取的原理:利用混合物中一种溶质在不同溶剂里的溶解度的不同萃取的条件:(1)萃取剂和原溶剂互不相溶(2)溶质在萃取剂中的溶解度大于在原溶剂中的溶解度(3)不发生化学反应操作过程:振荡静置分液【思考与交流】
1、下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1) NaCl(泥沙)(2)NaCl(I2)(3)KNO3(NaCl) (4)NaCl(H2O)(5)甲烷(乙烯) (6)酒精(水)
(7)溴水(水) (8)CO2(HCl)(9)汽油(水)
2、分离、提纯物质的总的原则是什么?过滤升华结晶蒸发洗气蒸馏萃取、分液、蒸馏洗气分液不增、不减、易分离、易复原不增加新杂质;不减少被提纯物质;
若引人新的杂质则必须易于与被提纯物分离;
若被提纯物转化为其它物质则必须易于复原练习1: 可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水D练习2:某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质确定通过下列步骤回收乙醇和乙酸。互不相溶的液体
①向废液中加入烧碱溶液,调整溶液的pH=12
②混和液放入蒸馏器中缓缓加热③收集温度在70~85℃时馏出物
④排出蒸馏器中的残液。冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器进行蒸馏,回收馏出物
请回答下列问题:
(1)加入烧碱使溶液的pH=12的目的除了使乙酸乙酯水解成乙醇和乙酸钠外,还有是 ;
(2)在70~85℃时的馏出物的主要成份是 ;
(3)在步骤④中,加入过量浓硫酸的目的是(用化学方程式表示)
(4)当最后蒸馏的温度控制在85~125℃一段时间后,残留液中溶质的主要成份是 。使乙酸乙酯、乙酸和与碱反应生成难挥发的乙酸盐乙醇2CH3COONa+H2SO4=Na2SO4+2CH3COOH硫酸钠 和 H2SO4练习2:某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质确定通过下列步骤回收乙醇和乙酸。 第二课时有机物
(不纯)有机物(纯净)分离 提纯研究有机化合物的一般步骤确定实验式元素定性定量分析确定分子式测定相对
分子质量确定结构式化学性质波谱分析有机物
(不纯)有机物(纯净)Ⅰ分离 提纯研究有机化合物的一般步骤确定实验式Ⅱ元素定性Ⅲ定量分析确定分子式Ⅳ测定相对
分子质量确定结构式Ⅴ化学性质波谱分析定性:燃烧产物确定元素种类定量:一定量的有机物燃烧所有产物的质量n(c):n(H):n(o)有机物(纯净)确定 分子式?首先要确定有机物中含有哪些元素其次要确定有机物中各元素的质量分数,从而确定实验式(最简式)最后要测定有机物的相对分子质量二、元素分析与相对分子质量的测定实验式和分子式的区别实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。例题:实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。答案:实验式是CH3,分子式是C2H62018/12/3“李比希元素分析法”的原理:用无水
CaCl2吸收用KOH浓
溶液吸收得前后质量差得前后质量差计算C、H含量计算O含量得出实验式质量守恒2018/12/3或燃烧元素分析方法:李比希法→现代元素分 析法元素分析仪2018/12/3有机物分子式的确定1、有机物组成元素及实验式的确定5.8g某有机物完全燃烧,生成CO2 13.2g , H2O 5.4g (无其它产物):
该有机物一定含有哪些元素?含碳3.6g(0.3mol)含氢0.6g(0.6mol)含氧1.6g(0.1mol)能否确定是否含有氧?如何确定?能否确定该有机物的实验式?C3H6O能否据此确定该有机物的分子式?否2018/12/3 将一定量的有机物燃烧,分解为简单的无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量,然后计算出该有机物分子所含元素原子最简单的整数比,即确定其实验式(又称为最简式)[练习3]某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%。(P20)
(1)试求该未知物A的实验式(分子中各原子的最简单的整数比)。
(2)能否确定它的分子式?C2H6O能!分子式为C2H6O注意:A
部分有机物的实验式中H已达饱和,则该有机物的实验式就是分子式。(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得归纳:确定有机物分子式的方法[方法一]有机物的分子式 ← 有机物的实验式和相对分子质量[方法二]由相对分子质量和各元素的质量分数直接求算[练习4]某同学为测定维生素C(可能含C、H或C、H、O)中碳、氢的质量分数,取维生素C样品研碎,称取该样品0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收。试回答以下问题:
(1)维生素C中碳的质量分数是 ,氢的质量分数是 。
(2)维生素C中是否含有氧元素?为什么?
(3)试求维生素C的实验式:
(4)若维生素C的相对分子质量为176,请写出它的分子式C3H4O3 41%4.55%肯定含有氧C6H8O6 [练习5]吗啡和海洛因都是严格查禁的毒品。吗啡分子含C 71.58%、H 6.67%、N 4.91%、其余为O。已知其分子量不超过300。试求:⑴吗啡的分子量;⑵吗啡的分子式。
16.84%285C17H19NO31、计算:
(1)M = m/n
(2)M1 = DM2
(3)M = 22.4L/mol ?ρg/L确定相对分子质量的方法2018/12/3测定相对分子质量的方法很多, 质谱法是最精确、最快捷的方法。2、相对分子质量的确定——质谱法 它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。相对分子质量的测定:质谱法(MS)质谱仪相对丰度(RA)——以图中最强的离子峰(基峰)高为100%,其它峰的峰高则用相对于基峰的百分数表示。
1、质荷比是什么?
2、如何确定有机物的相对分子质量?(分子离子的质荷比越大,达到检测器需要的时间最长,
因此谱图中的质荷比最大的就是未知物的相对分子质量)思考乙醇的质谱图 质荷比最大的数据表示未知物A的相对分子质量。相对分子质量与所带电荷之比[练习6].2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。设H+的质荷比为β,某有机物样品的质荷比如右图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷
C 丙烷 D 乙烯
B三、分子结构的鉴定 有机物的性质结构式
(确定有机物的官能团)分子式计算不饱和度推测可能的官能团
写出可能的同分异构体1、红外光谱
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生震动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,我们就可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
三、分子结构的鉴定 红外光谱仪红外光谱(IR)[练习7]下图是一种分子式为C3H6O2的有机物的红外光谱谱图,则该有机物的结构简式为:CH3COOCH32018/12/3[练习8]某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%, 则其实验式是( )。
②确定分子式:下图是该有机物的质谱图,则其相对分子质量为( ),分子式为( )。结构简式 为( )C4H10O74C4H10OCH3CH2OCH2CH32018/12/32、核磁共振氢谱 : 氢原子核具有磁性,如用电磁波照射氢原子核,它能通过共振吸收电磁波能量,发生跃迁。用核磁共振仪可以记录到有关信号,
处在不同环境中的氢原子因产生共振时吸收电磁波的频率不同,在图谱上出现的位置也不同,各类氢原子的这种差异被称作化学位移;而且吸收峰的面积与氢原子数成正比. 从核磁共振氢谱图上推知氢原子的类型及数目。
①几个峰就有几种氢
②吸收峰的面积之比等于这几种氢原子数之比核磁共振氢谱(HNMR)核磁共振仪[练习9]一个有机物的分子量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱列如下图:②写出该有机物的可能的结构简式:①写出该有机物的分子式:C4H6OCH3CH=CHCHO四种氢,且比值为 1: 1:1:3[练习10]2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在核磁共振氢谱中只给出一种信号的是
A HCHO B CH3OH
C HCOOH D CH3COOCH3?[练习11] 分子式为C3H6O2的二元混合物,分离后,在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断混合物的组成可能是(写结构简式) 。CH3COOCH3
1、家庭防虫、防腐;
2、香料工业;
3、一种塑料(赛璐璐)的增塑剂;
4、在制造无烟火药用作稳定剂;
5、在医药上,能作防腐剂和局部刺激药等 樟脑分子式为C10H16O ,它的立体结构为:有机物
(不纯)有机物(纯净)Ⅰ分离 提纯研究有机化合物的一般步骤确定实验式Ⅱ元素定性Ⅲ定量分析确定分子式Ⅳ测定相对
分子质量确定结构式Ⅴ化学性质波谱分析定性:燃烧产物确定元素种类定量:一定量的有机物燃烧所有产物的质量n(c):n(H):n(o)分离、提纯须知:2、物理方法:利用有机物与杂质物理性质的差异而将它们分开有机物分离的常用物理方法蒸馏
重结晶
萃取
分液1、化学方法:一般是加入或通过某种试剂进行化学反应以除去杂质。一、有机物的分离、提纯思考:怎样操作才能将工业酒精(含水)变成无水酒精?1、蒸馏蒸馏除掉酒精中的水变成无水乙醇,通常先加生石灰(CaO)蒸馏烧瓶冷凝管温度计尾接管冷水热水使用前要检查装置的气密性!1、蒸馏:用于分离、提纯互溶液态混合物的方法(2)蒸馏提纯的条件 杂质含量少;有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)(1)蒸馏的原理利用混合物中各成分沸点不同,除去难挥发或不挥发的杂质(3)蒸馏的注意事项:a、仪器组装的顺序:“先下后上,由左至右”;拆卸则相反; b、使用前须检查装置的气密性
c、温度计水银球的部位(与蒸馏烧瓶支管口齐平)
d、烧瓶中放少量沸石或素烧瓷片(防止暴沸)
e、进出水方向(下进上出——逆流换热)
f、烧瓶中所盛放液体体积不能超过烧瓶容积的2/3,不能将全部溶液蒸干资料:无水酒精的制取普通酒精含乙醇95.57%(质量)和水4.43%,这是恒沸点混合物,它的沸点是78.15℃,比纯乙醇的沸点(78.5℃)低。把这种混合物蒸馏时,气相和液相的组成是相同的,即乙醇和水始终以这个混合比率蒸出,不能用蒸馏法制得无水酒精。
实验室制备无水酒精时,在95.57%酒精中加入生石灰(CaO)加热回流,使酒精中的水跟氧化钙反应,生成不挥发的氢氧化钙来除去水分,然后再蒸馏,这样可得99.5%的无水酒精。如果还要去掉这残留的少量的水,可以加入金属镁来处理,可得100%乙醇,叫做绝对酒精。【思考与交流】
1、怎样操作才能达到目标?
提纯KNO3、NaCl混合物中的KNO3
提纯NaCl 、KNO3 混合物中的NaCl蒸发结晶冷却结晶冷却结晶主要对于混合溶液含有两种以上溶质,且有一种随温度的变化溶解度变化较大,提纯他就用冷却结晶从氯化钠与硝酸钾混合溶液中提纯硝酸钾(氯化钠少量)蒸发结晶适用于一切固体溶质从他们的溶液中分离,或从含两种以上溶质的混合溶液中提纯随温度的变化溶解度变化不大的物质如:从氯化钠与硝酸钾混合溶液中提纯氯化钠(硝酸钾少量),此处不蒸干。 2、进行上述实验时,用到的仪器有哪些?要注意哪些问题?2、重结晶原理:利用固体混合物中目标组分在某种溶剂中的溶解度随温度变化有明显差异,将有机物溶解在热的溶剂中制成饱和溶液,冷却后,由于溶解度减小,溶质又重新成晶体析出。由于产品与杂质在溶剂中的溶解度不同,可以通过过滤将杂质除去,从而达到分离提纯的目的。选择溶剂的要求:
杂质在溶剂中溶解度很大或很小(前一种情况杂质将留在母液中不析出,后一种情况是使杂质在热过滤时被除去)
目标组分在此溶剂中的溶解度,受温度的影响较大
(该有机物在热溶液中的溶解度较大,在冷溶液中溶解度较小,冷却后易于形成晶体。)重结晶操作中的使用的仪器:烧杯、玻璃棒、石棉网、酒精灯、铁架台(或三脚架)、漏斗 在苯甲酸重结晶的实验中,滤液放置冷却可以结晶出纯净的苯甲酸晶体。请你思考并与同学交流:温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?(教材)不纯固体物质残渣
(不溶性杂质)滤液母液
(可溶性杂质和部分被提纯物)晶体
(产品)溶于溶剂,制成饱和溶液,趁热过滤(除掉杂质)苯甲酸重结晶的实验【思考与交流】
(1)如何提取溴水中的溴?
(2)实验原理是什么?
(3)用到的实验仪器(玻璃仪器)有哪些?
(4)如何选取萃取剂?
(5)这样得到的溴纯净吗?如果不纯,如何处理?
(6)实验过程要注意哪些问题?3、萃取3、萃取萃取固—液萃取液—液萃取萃取:用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法萃取的原理:利用混合物中一种溶质在不同溶剂里的溶解度的不同萃取的条件:(1)萃取剂和原溶剂互不相溶(2)溶质在萃取剂中的溶解度大于在原溶剂中的溶解度(3)不发生化学反应操作过程:振荡静置分液【思考与交流】
1、下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1) NaCl(泥沙)(2)NaCl(I2)(3)KNO3(NaCl) (4)NaCl(H2O)(5)甲烷(乙烯) (6)酒精(水)
(7)溴水(水) (8)CO2(HCl)(9)汽油(水)
2、分离、提纯物质的总的原则是什么?过滤升华结晶蒸发洗气蒸馏萃取、分液、蒸馏洗气分液不增、不减、易分离、易复原不增加新杂质;不减少被提纯物质;
若引人新的杂质则必须易于与被提纯物分离;
若被提纯物转化为其它物质则必须易于复原练习1: 可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水D练习2:某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质确定通过下列步骤回收乙醇和乙酸。互不相溶的液体
①向废液中加入烧碱溶液,调整溶液的pH=12
②混和液放入蒸馏器中缓缓加热③收集温度在70~85℃时馏出物
④排出蒸馏器中的残液。冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器进行蒸馏,回收馏出物
请回答下列问题:
(1)加入烧碱使溶液的pH=12的目的除了使乙酸乙酯水解成乙醇和乙酸钠外,还有是 ;
(2)在70~85℃时的馏出物的主要成份是 ;
(3)在步骤④中,加入过量浓硫酸的目的是(用化学方程式表示)
(4)当最后蒸馏的温度控制在85~125℃一段时间后,残留液中溶质的主要成份是 。使乙酸乙酯、乙酸和与碱反应生成难挥发的乙酸盐乙醇2CH3COONa+H2SO4=Na2SO4+2CH3COOH硫酸钠 和 H2SO4练习2:某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质确定通过下列步骤回收乙醇和乙酸。 第二课时有机物
(不纯)有机物(纯净)分离 提纯研究有机化合物的一般步骤确定实验式元素定性定量分析确定分子式测定相对
分子质量确定结构式化学性质波谱分析有机物
(不纯)有机物(纯净)Ⅰ分离 提纯研究有机化合物的一般步骤确定实验式Ⅱ元素定性Ⅲ定量分析确定分子式Ⅳ测定相对
分子质量确定结构式Ⅴ化学性质波谱分析定性:燃烧产物确定元素种类定量:一定量的有机物燃烧所有产物的质量n(c):n(H):n(o)有机物(纯净)确定 分子式?首先要确定有机物中含有哪些元素其次要确定有机物中各元素的质量分数,从而确定实验式(最简式)最后要测定有机物的相对分子质量二、元素分析与相对分子质量的测定实验式和分子式的区别实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。例题:实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。答案:实验式是CH3,分子式是C2H62018/12/3“李比希元素分析法”的原理:用无水
CaCl2吸收用KOH浓
溶液吸收得前后质量差得前后质量差计算C、H含量计算O含量得出实验式质量守恒2018/12/3或燃烧元素分析方法:李比希法→现代元素分 析法元素分析仪2018/12/3有机物分子式的确定1、有机物组成元素及实验式的确定5.8g某有机物完全燃烧,生成CO2 13.2g , H2O 5.4g (无其它产物):
该有机物一定含有哪些元素?含碳3.6g(0.3mol)含氢0.6g(0.6mol)含氧1.6g(0.1mol)能否确定是否含有氧?如何确定?能否确定该有机物的实验式?C3H6O能否据此确定该有机物的分子式?否2018/12/3 将一定量的有机物燃烧,分解为简单的无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量,然后计算出该有机物分子所含元素原子最简单的整数比,即确定其实验式(又称为最简式)[练习3]某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%。(P20)
(1)试求该未知物A的实验式(分子中各原子的最简单的整数比)。
(2)能否确定它的分子式?C2H6O能!分子式为C2H6O注意:A
部分有机物的实验式中H已达饱和,则该有机物的实验式就是分子式。(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得归纳:确定有机物分子式的方法[方法一]有机物的分子式 ← 有机物的实验式和相对分子质量[方法二]由相对分子质量和各元素的质量分数直接求算[练习4]某同学为测定维生素C(可能含C、H或C、H、O)中碳、氢的质量分数,取维生素C样品研碎,称取该样品0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收。试回答以下问题:
(1)维生素C中碳的质量分数是 ,氢的质量分数是 。
(2)维生素C中是否含有氧元素?为什么?
(3)试求维生素C的实验式:
(4)若维生素C的相对分子质量为176,请写出它的分子式C3H4O3 41%4.55%肯定含有氧C6H8O6 [练习5]吗啡和海洛因都是严格查禁的毒品。吗啡分子含C 71.58%、H 6.67%、N 4.91%、其余为O。已知其分子量不超过300。试求:⑴吗啡的分子量;⑵吗啡的分子式。
16.84%285C17H19NO31、计算:
(1)M = m/n
(2)M1 = DM2
(3)M = 22.4L/mol ?ρg/L确定相对分子质量的方法2018/12/3测定相对分子质量的方法很多, 质谱法是最精确、最快捷的方法。2、相对分子质量的确定——质谱法 它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。相对分子质量的测定:质谱法(MS)质谱仪相对丰度(RA)——以图中最强的离子峰(基峰)高为100%,其它峰的峰高则用相对于基峰的百分数表示。
1、质荷比是什么?
2、如何确定有机物的相对分子质量?(分子离子的质荷比越大,达到检测器需要的时间最长,
因此谱图中的质荷比最大的就是未知物的相对分子质量)思考乙醇的质谱图 质荷比最大的数据表示未知物A的相对分子质量。相对分子质量与所带电荷之比[练习6].2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。设H+的质荷比为β,某有机物样品的质荷比如右图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
A 甲醇 B 甲烷
C 丙烷 D 乙烯
B三、分子结构的鉴定 有机物的性质结构式
(确定有机物的官能团)分子式计算不饱和度推测可能的官能团
写出可能的同分异构体1、红外光谱
由于有机物中组成化学键、官能团的原子处于不断振动状态,且振动频率与红外光的振动频谱相当。所以,当用红外线照射有机物分子时,分子中的化学键、官能团可发生震动吸收,不同的化学键、官能团吸收频率不同,在红外光谱图中将处于不同位置。因此,我们就可以根据红外光谱图,推知有机物含有哪些化学键、官能团,以确定有机物的结构。
三、分子结构的鉴定 红外光谱仪红外光谱(IR)[练习7]下图是一种分子式为C3H6O2的有机物的红外光谱谱图,则该有机物的结构简式为:CH3COOCH32018/12/3[练习8]某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%, 则其实验式是( )。
②确定分子式:下图是该有机物的质谱图,则其相对分子质量为( ),分子式为( )。结构简式 为( )C4H10O74C4H10OCH3CH2OCH2CH32018/12/32、核磁共振氢谱 : 氢原子核具有磁性,如用电磁波照射氢原子核,它能通过共振吸收电磁波能量,发生跃迁。用核磁共振仪可以记录到有关信号,
处在不同环境中的氢原子因产生共振时吸收电磁波的频率不同,在图谱上出现的位置也不同,各类氢原子的这种差异被称作化学位移;而且吸收峰的面积与氢原子数成正比. 从核磁共振氢谱图上推知氢原子的类型及数目。
①几个峰就有几种氢
②吸收峰的面积之比等于这几种氢原子数之比核磁共振氢谱(HNMR)核磁共振仪[练习9]一个有机物的分子量为70,红外光谱表征到碳碳双键和C=O的存在,核磁共振氢谱列如下图:②写出该有机物的可能的结构简式:①写出该有机物的分子式:C4H6OCH3CH=CHCHO四种氢,且比值为 1: 1:1:3[练习10]2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物分子在核磁共振氢谱中只给出一种信号的是
A HCHO B CH3OH
C HCOOH D CH3COOCH3?[练习11] 分子式为C3H6O2的二元混合物,分离后,在核磁共振氢谱上观察到氢原子给出的峰有两种情况。第一种情况峰给出的强度为1︰1;第二种情况峰给出的强度为3︰2︰1。由此推断混合物的组成可能是(写结构简式) 。CH3COOCH3
