人教版高中化学选修五4.3 蛋白质和核酸 课件(32张)
文档属性
| 名称 | 人教版高中化学选修五4.3 蛋白质和核酸 课件(32张) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 12:56:21 | ||
图片预览









文档简介
课件32张PPT。蛋白质的结构与性质 一切重要的生命现象和生理机能都与蛋白质密切相关,不同结构的蛋白质其生理功能也不相同,没有蛋白质就没有生命。学习重点:1、理解蛋白质的组成;
2、复习氨基酸的结构和性质
3、动手做实物模型,通过模型理解内容,应 用模型释现象
4、掌握蛋白质的性质
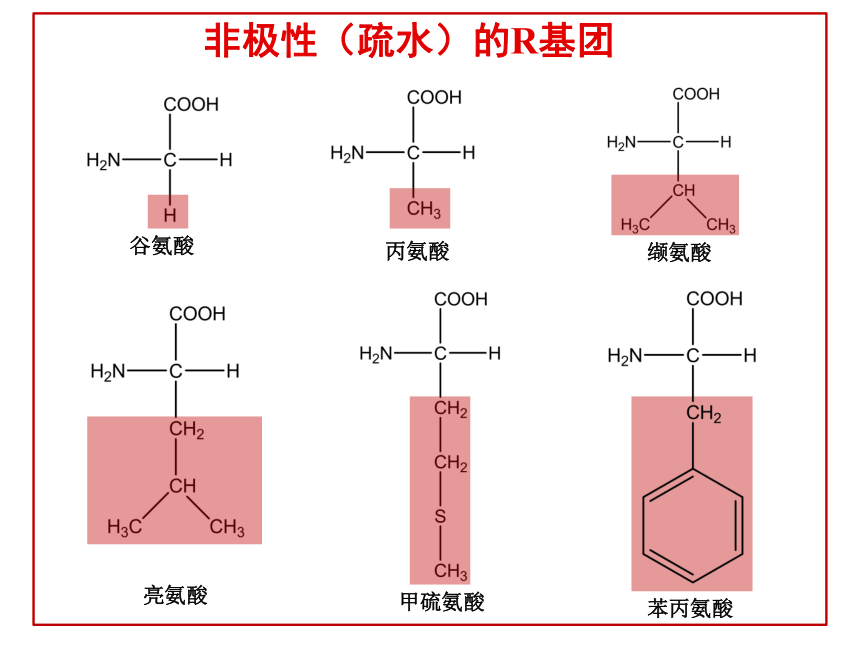
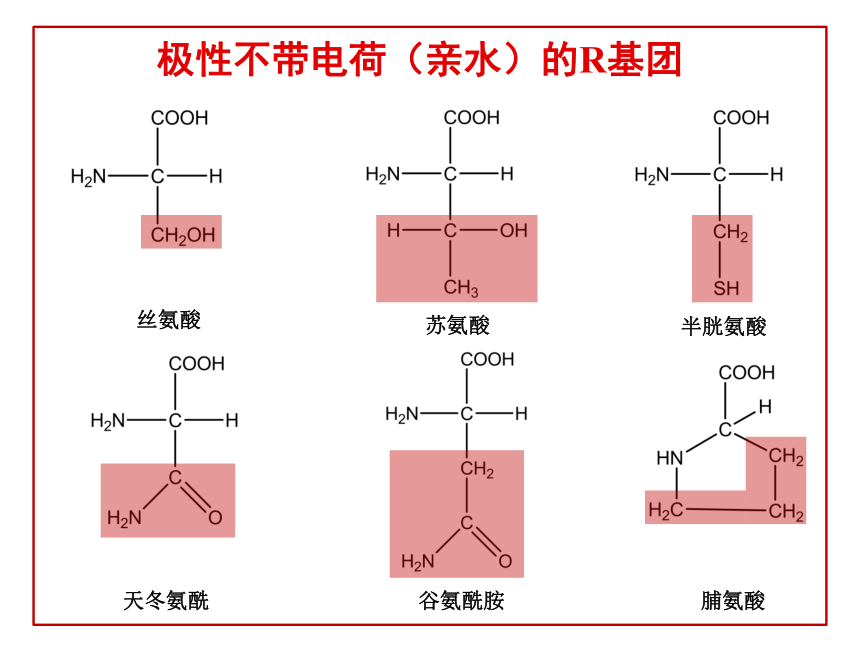
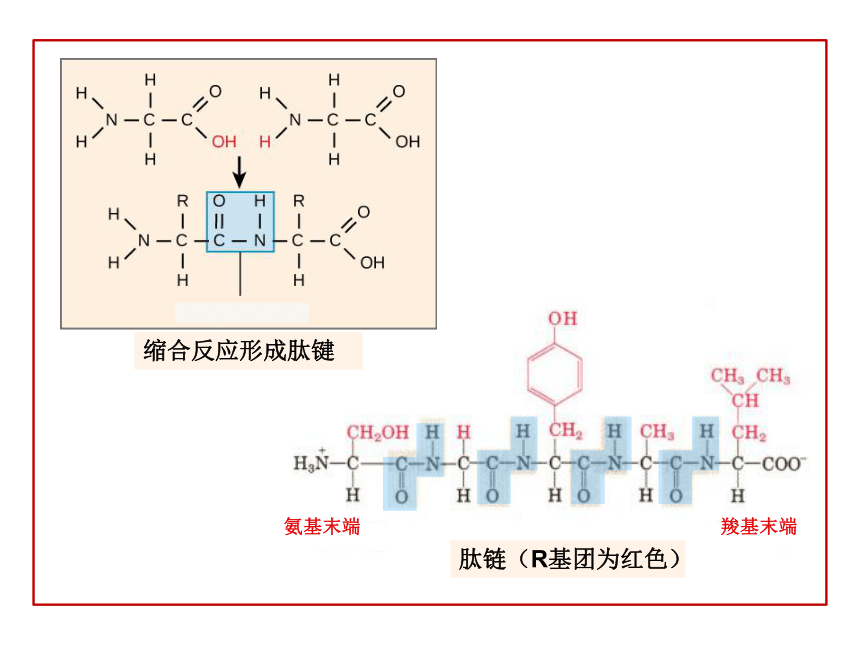
5、 通过本节课强化学生对蛋白质结构的理解,领会“结构决定性质”,改变课前对蛋白质的结构方面的一些错误理解。 氨基酸的结构复习谷氨酸丙氨酸缬氨酸亮氨酸甲硫氨酸苯丙氨酸非极性(疏水)的R基团丝氨酸苏氨酸半胱氨酸天冬氨酰谷氨酰胺脯氨酸极性不带电荷(亲水)的R基团赖氨酸精氨酸天冬氨酸谷氨酸带正电荷的R基团带负电荷的R基团缩合反应形成肽键肽链(R基团为红色)氨基末端羧基末端(一)蛋白质的概念 蛋白质是由氨基酸通过肽键等相互连接而形成的一类具有特定结构和一定生物学功能的生物大分子。(二)蛋白质的存在主要的存在于生物体内,肌肉,发,皮肤,角蹄,酶,激素,抗体,病毒;在植物中也很丰富,比如大豆,花生,谷物。
是生命的基础,没有蛋白质就没有生命。(三)蛋白质的结构
探究活动活动目地:
动手做蛋白质结构实物模型,通过模型理解内容,应用模型解释现象
要求:
学生以小组为单位,每小组同学团结协作,利用2跟不同颜色的铝线,做出蛋白质的一级、二级、三级结构,并展示。
一级结构:蛋白质中氨基酸的排列顺序和连接方式,它限定了蛋白质的多肽链的盘旋、折叠及其功能(一级结构决定着二、三、四级结构)。牛胰岛素是一种蛋白质(上图),是由两条肽链(A、B链)组成的。肽链间通过Cys(半胱氨酸)形成的二硫键联结起来,A链中的二硫键对A链盘旋和折叠成特定的结构起着重要的作用。A链B链二级结构:氨基酸之间的氢键形成了蛋白质的两种结构—α螺旋和β折叠,α螺旋是血红蛋白的基本结构元素,但很多其它的蛋白质都有β折叠。氢键可使螺旋结构稳定。α螺旋β折叠折叠片层氢键α螺旋:一条多肽中的肽键与其相邻肽键通过氢键形成的刚性螺旋结构 β折叠:一条多肽的自身折叠,平行片段的邻近肽键之间通过氢键而形成的结构。三级结构:蛋白质分子在二级结构基础上进一步盘曲折叠形成的三维结构。在由多个多肽组成的蛋白质分子中,每一个多肽链可称为亚基(也有一条多肽形成的蛋白质)。蛋白质的三级结构由不同的化学相互作用决定,它们包括:离子键、二硫键(共价键)、氢键、疏水作用。多肽的骨架离子键疏水作用二硫键氢键氨基酸β折叠α螺旋折叠片层α螺旋一级结构包括以肽键连接的氨基酸顺序和任何的二硫键多肽链可以卷曲形成二级结构单元螺旋和折叠是三级结构的一部分具有三级结构的多肽又是组成多亚基蛋白质的四级结构的结构单元。总结血红素(三)蛋白质的结构思考:为什么蛋白质数目众多,结构复杂?
蛋白质可能包含一条或多条肽链,不同肽链中所包含的氨基酸数量以及它们的排列方式各不相同,多肽链本身以及多肽链之间还存在空间结构问题。
各种蛋白质的特殊功能和活性主要取决于什么?
取决于组成多肽链的氨基酸种类、数目及排列顺序和其特定的空间结构。即蛋白质的结构。
(四)蛋白质的性质结构决定性质(一级结构的不同,镰刀型贫血)自由流动正常的血红细胞阻碍流动镰刀型血红细胞血管血管细胞截面图细胞截面图正常的
血红蛋白不正常的血红蛋白,导致血红细胞的镰刀形状…-苏氨酸脯氨酸…-苏氨酸脯氨酸赖氨酸-…赖氨酸-…谷氨酸缬氨酸正常的 血红细胞镰刀型
血红细胞氨基酸的替换一级结构
的改变下列物质中既能与盐酸反应,又能与NaOH溶液反应的是①NaHSO3 ; ②(NH4)2CO3 ; ③Al(OH)3 ;
④NH4Cl;⑤H2N-CH2-COOH ; ⑥CH3-COOH
A.①②③ B.①②④⑤ C.⑤⑥ D.①②③⑤●【小结】既能与酸反应又能与碱反应的物质(1)多元弱酸的酸式盐; (2)弱酸的铵盐;
(3)具两性的物质; (4)氨基酸和蛋白质;D性质1:具有两性水解原理:注意:不同的蛋白质水解最终生成各种氨基酸,
但只有天然蛋白质水解均生成α-氨基酸(结构中含有肽键)性质2:能够水解哪一级结构发生改变?在适宜条件下完全水解得到4种产物,它们的结构简式为 ,
。2、已知有机化合物:●实验:1、蛋白质溶液中加浓的无机盐溶液〔如Na2SO4、(NH4)2SO4等〕,可使蛋白质的溶解度减小, 使蛋白质转变为沉淀而从溶液中析出----盐析。2、盐析是一个可逆的过程,故不影响蛋白质的性质●应用:利用多次盐析的方法分离、提纯蛋白质。性质3:盐析什么样的盐?这是为什么?●实验:鸡蛋白溶液加 热蛋白质凝结加水不再溶解性质4:变性 在热、强酸、强碱、重金属盐、甲醛、酒精、苯酚溶液、紫外线等作用下,蛋白质失去原有的可溶性而凝结,同时丧失了生理活性。这种过程是不可逆的。●实验:●应用:用于部分鉴别蛋白质的存在性质5: 颜色反应思考与交流:通过同学们的观察,蛋白质所发生的以上几个反应与蛋白质的结构有什么关系?结合自己的模型解释。蛋白质变性:蛋白质在某些物理和化学因素作用下其特定的空间构象被改变(对化学键或非化学键相互作用的破坏而引起二、三、四级结构的变化,一级结构不变),从而导致其理化性质的改变和生物活性的丧失。蛋白质变性是不可逆变化。 ●用于区别合成纤维与蛋白质(如真丝、蚕丝、纯毛、毛线等)●归纳:检验蛋白质的方法
(1)燃烧;(2)颜色反应。 ●鉴别织物成分是蚕丝还是“人造丝”,在如下各方法中正确的是( )
①滴加浓HNO3, ②滴加浓硫酸, ③滴加酒精, ④灼烧
A.①③ B.② ④ C. ①④ D. ③④ C蛋白质研究的最新的趋势: 蛋白质测序、基因工程(一级结构 )
蛋白质数据库(四级结构)
研究对人类生活有什么益处:
食品、医药、疾病研究HIV,癌症等
2、复习氨基酸的结构和性质
3、动手做实物模型,通过模型理解内容,应 用模型释现象
4、掌握蛋白质的性质
5、 通过本节课强化学生对蛋白质结构的理解,领会“结构决定性质”,改变课前对蛋白质的结构方面的一些错误理解。 氨基酸的结构复习谷氨酸丙氨酸缬氨酸亮氨酸甲硫氨酸苯丙氨酸非极性(疏水)的R基团丝氨酸苏氨酸半胱氨酸天冬氨酰谷氨酰胺脯氨酸极性不带电荷(亲水)的R基团赖氨酸精氨酸天冬氨酸谷氨酸带正电荷的R基团带负电荷的R基团缩合反应形成肽键肽链(R基团为红色)氨基末端羧基末端(一)蛋白质的概念 蛋白质是由氨基酸通过肽键等相互连接而形成的一类具有特定结构和一定生物学功能的生物大分子。(二)蛋白质的存在主要的存在于生物体内,肌肉,发,皮肤,角蹄,酶,激素,抗体,病毒;在植物中也很丰富,比如大豆,花生,谷物。
是生命的基础,没有蛋白质就没有生命。(三)蛋白质的结构
探究活动活动目地:
动手做蛋白质结构实物模型,通过模型理解内容,应用模型解释现象
要求:
学生以小组为单位,每小组同学团结协作,利用2跟不同颜色的铝线,做出蛋白质的一级、二级、三级结构,并展示。
一级结构:蛋白质中氨基酸的排列顺序和连接方式,它限定了蛋白质的多肽链的盘旋、折叠及其功能(一级结构决定着二、三、四级结构)。牛胰岛素是一种蛋白质(上图),是由两条肽链(A、B链)组成的。肽链间通过Cys(半胱氨酸)形成的二硫键联结起来,A链中的二硫键对A链盘旋和折叠成特定的结构起着重要的作用。A链B链二级结构:氨基酸之间的氢键形成了蛋白质的两种结构—α螺旋和β折叠,α螺旋是血红蛋白的基本结构元素,但很多其它的蛋白质都有β折叠。氢键可使螺旋结构稳定。α螺旋β折叠折叠片层氢键α螺旋:一条多肽中的肽键与其相邻肽键通过氢键形成的刚性螺旋结构 β折叠:一条多肽的自身折叠,平行片段的邻近肽键之间通过氢键而形成的结构。三级结构:蛋白质分子在二级结构基础上进一步盘曲折叠形成的三维结构。在由多个多肽组成的蛋白质分子中,每一个多肽链可称为亚基(也有一条多肽形成的蛋白质)。蛋白质的三级结构由不同的化学相互作用决定,它们包括:离子键、二硫键(共价键)、氢键、疏水作用。多肽的骨架离子键疏水作用二硫键氢键氨基酸β折叠α螺旋折叠片层α螺旋一级结构包括以肽键连接的氨基酸顺序和任何的二硫键多肽链可以卷曲形成二级结构单元螺旋和折叠是三级结构的一部分具有三级结构的多肽又是组成多亚基蛋白质的四级结构的结构单元。总结血红素(三)蛋白质的结构思考:为什么蛋白质数目众多,结构复杂?
蛋白质可能包含一条或多条肽链,不同肽链中所包含的氨基酸数量以及它们的排列方式各不相同,多肽链本身以及多肽链之间还存在空间结构问题。
各种蛋白质的特殊功能和活性主要取决于什么?
取决于组成多肽链的氨基酸种类、数目及排列顺序和其特定的空间结构。即蛋白质的结构。
(四)蛋白质的性质结构决定性质(一级结构的不同,镰刀型贫血)自由流动正常的血红细胞阻碍流动镰刀型血红细胞血管血管细胞截面图细胞截面图正常的
血红蛋白不正常的血红蛋白,导致血红细胞的镰刀形状…-苏氨酸脯氨酸…-苏氨酸脯氨酸赖氨酸-…赖氨酸-…谷氨酸缬氨酸正常的 血红细胞镰刀型
血红细胞氨基酸的替换一级结构
的改变下列物质中既能与盐酸反应,又能与NaOH溶液反应的是①NaHSO3 ; ②(NH4)2CO3 ; ③Al(OH)3 ;
④NH4Cl;⑤H2N-CH2-COOH ; ⑥CH3-COOH
A.①②③ B.①②④⑤ C.⑤⑥ D.①②③⑤●【小结】既能与酸反应又能与碱反应的物质(1)多元弱酸的酸式盐; (2)弱酸的铵盐;
(3)具两性的物质; (4)氨基酸和蛋白质;D性质1:具有两性水解原理:注意:不同的蛋白质水解最终生成各种氨基酸,
但只有天然蛋白质水解均生成α-氨基酸(结构中含有肽键)性质2:能够水解哪一级结构发生改变?在适宜条件下完全水解得到4种产物,它们的结构简式为 ,
。2、已知有机化合物:●实验:1、蛋白质溶液中加浓的无机盐溶液〔如Na2SO4、(NH4)2SO4等〕,可使蛋白质的溶解度减小, 使蛋白质转变为沉淀而从溶液中析出----盐析。2、盐析是一个可逆的过程,故不影响蛋白质的性质●应用:利用多次盐析的方法分离、提纯蛋白质。性质3:盐析什么样的盐?这是为什么?●实验:鸡蛋白溶液加 热蛋白质凝结加水不再溶解性质4:变性 在热、强酸、强碱、重金属盐、甲醛、酒精、苯酚溶液、紫外线等作用下,蛋白质失去原有的可溶性而凝结,同时丧失了生理活性。这种过程是不可逆的。●实验:●应用:用于部分鉴别蛋白质的存在性质5: 颜色反应思考与交流:通过同学们的观察,蛋白质所发生的以上几个反应与蛋白质的结构有什么关系?结合自己的模型解释。蛋白质变性:蛋白质在某些物理和化学因素作用下其特定的空间构象被改变(对化学键或非化学键相互作用的破坏而引起二、三、四级结构的变化,一级结构不变),从而导致其理化性质的改变和生物活性的丧失。蛋白质变性是不可逆变化。 ●用于区别合成纤维与蛋白质(如真丝、蚕丝、纯毛、毛线等)●归纳:检验蛋白质的方法
(1)燃烧;(2)颜色反应。 ●鉴别织物成分是蚕丝还是“人造丝”,在如下各方法中正确的是( )
①滴加浓HNO3, ②滴加浓硫酸, ③滴加酒精, ④灼烧
A.①③ B.② ④ C. ①④ D. ③④ C蛋白质研究的最新的趋势: 蛋白质测序、基因工程(一级结构 )
蛋白质数据库(四级结构)
研究对人类生活有什么益处:
食品、医药、疾病研究HIV,癌症等
