人教版高中化学必修二 1.3.3 分子间作用力
文档属性
| 名称 | 人教版高中化学必修二 1.3.3 分子间作用力 |  | |
| 格式 | zip | ||
| 文件大小 | 174.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-03 10:30:33 | ||
图片预览



文档简介
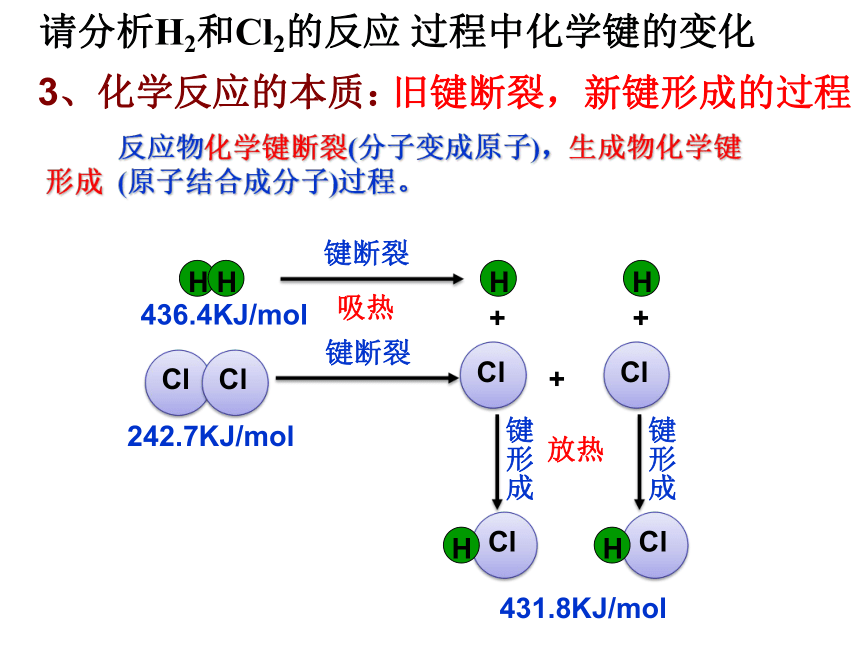
课件11张PPT。离子键共价键2.分类1、定义相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。三、化学键 阴阳离子静电作用同种元素不同种元素 注意:1.稀有气体不含有化学键。
2.既含有离子键又含有共价键的物质存在于含有原子团的物质。
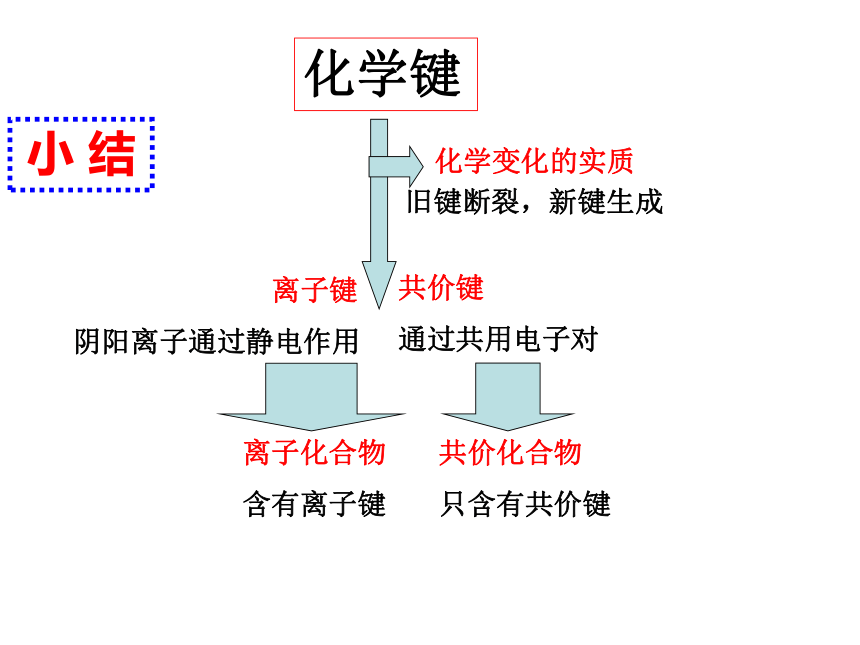
3、化学反应的本质:旧键断裂,新键形成的过程436.4KJ/mol242.7KJ/mol431.8KJ/mol吸热放热请分析H2和Cl2的反应 过程中化学键的变化 反应物化学键断裂(分子变成原子),生成物化学键形成 (原子结合成分子)过程。小 结化学键 离子键
阴阳离子通过静电作用共价键
通过共用电子对化学变化的实质旧键断裂,新键生成共价化合物
只含有共价键离子化合物
含有离子键问题??分子间是否存在相互作用呢?
物质为什么会有三态变化?
不同物质为什么熔、沸点不同?存在不同温度下分子具有不同能量相互作用的大小不同四、分子间作用力和氢键1、分子间作用力 (范德华力) (1)定义: 把分子聚集在一起的作用力。 (2)分子间作用力比化学键弱得多,是一种微弱的相互作用。它主要影响物质的熔沸点、挥发性等物理性质,而化学键主要影响物质的化学性质。 (3)分子间作用力主要存在于分子间,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 (4)对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:又如气态氢化物:但是: 为什么HF、H2O和NH3的沸点会反常呢?讨论:2、氢键 (1)定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。(2)氢键不属于化学键,属于分子间作用力的范畴
(3)存在于HF、H2O、NH3等分子间作用力大小:化学键>氢键>分子间作用力(4)影响:1.使HF、H2O、NH3的熔沸点大大升高
2.冰的密度比水的小
3.NH3极易溶于水【练习】从元素种类角度判断,下列物质:
(1)属于离子化合物有________;共价化合物有_________
(2)在对应的横线上填上该物质所含键型(共价键要指明极性还是非极性键)
①He __________ ②H2 __________
③CaO__________ ④CO2 _________
⑤CaF2 __________ ⑥MgS __________
⑦AlCl3 __________ ⑧Na2SO4 __________
⑨HNO3 _________ ⑩Mg(OH)2 __________
?NH4NO3 _______ ?H2O2 __________
?Na2O2 _________不含化学键非极性共价键离子键极性共价键离子键离子键极性共价键极性共价键离子键、极性共价键离子键、极性共价键离子键、极性共价键非极性共价键、极性共价键离子键、非极性共价键3.5.6.8.10.11.134.7.9.12
2.既含有离子键又含有共价键的物质存在于含有原子团的物质。
3、化学反应的本质:旧键断裂,新键形成的过程436.4KJ/mol242.7KJ/mol431.8KJ/mol吸热放热请分析H2和Cl2的反应 过程中化学键的变化 反应物化学键断裂(分子变成原子),生成物化学键形成 (原子结合成分子)过程。小 结化学键 离子键
阴阳离子通过静电作用共价键
通过共用电子对化学变化的实质旧键断裂,新键生成共价化合物
只含有共价键离子化合物
含有离子键问题??分子间是否存在相互作用呢?
物质为什么会有三态变化?
不同物质为什么熔、沸点不同?存在不同温度下分子具有不同能量相互作用的大小不同四、分子间作用力和氢键1、分子间作用力 (范德华力) (1)定义: 把分子聚集在一起的作用力。 (2)分子间作用力比化学键弱得多,是一种微弱的相互作用。它主要影响物质的熔沸点、挥发性等物理性质,而化学键主要影响物质的化学性质。 (3)分子间作用力主要存在于分子间,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 (4)对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:又如气态氢化物:但是: 为什么HF、H2O和NH3的沸点会反常呢?讨论:2、氢键 (1)定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。(2)氢键不属于化学键,属于分子间作用力的范畴
(3)存在于HF、H2O、NH3等分子间作用力大小:化学键>氢键>分子间作用力(4)影响:1.使HF、H2O、NH3的熔沸点大大升高
2.冰的密度比水的小
3.NH3极易溶于水【练习】从元素种类角度判断,下列物质:
(1)属于离子化合物有________;共价化合物有_________
(2)在对应的横线上填上该物质所含键型(共价键要指明极性还是非极性键)
①He __________ ②H2 __________
③CaO__________ ④CO2 _________
⑤CaF2 __________ ⑥MgS __________
⑦AlCl3 __________ ⑧Na2SO4 __________
⑨HNO3 _________ ⑩Mg(OH)2 __________
?NH4NO3 _______ ?H2O2 __________
?Na2O2 _________不含化学键非极性共价键离子键极性共价键离子键离子键极性共价键极性共价键离子键、极性共价键离子键、极性共价键离子键、极性共价键非极性共价键、极性共价键离子键、非极性共价键3.5.6.8.10.11.134.7.9.12
