课题3溶液的浓度第1课时教学课件(30张PPT)
文档属性
| 名称 | 课题3溶液的浓度第1课时教学课件(30张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-02 21:50:38 | ||
图片预览









文档简介
课件30张PPT。人教版九年级化学下册课题3 溶液的浓度
第1课时本节导读一、创设情景 明确目标 药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。一、创设情景 明确目标你观察到了什么?
看到这些,你想到了什么?二、自主学习 指向目标自读课本P42-P44,
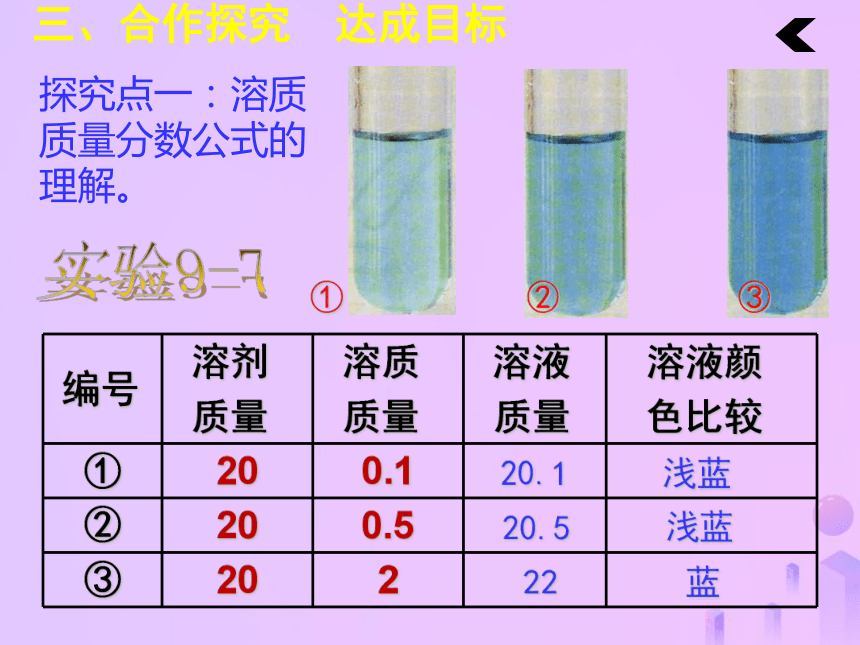
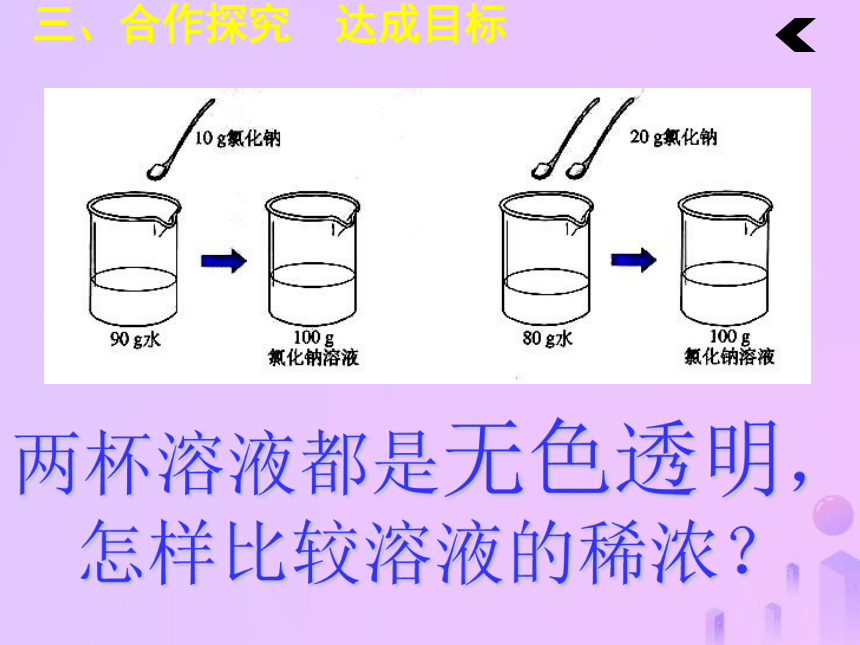
完成学生用书当堂作业部分。三、合作探究 达成目标探究点一:溶质质量分数公式的理解。20.120.522浅蓝浅蓝蓝三、合作探究 达成目标两杯溶液都是无色透明,
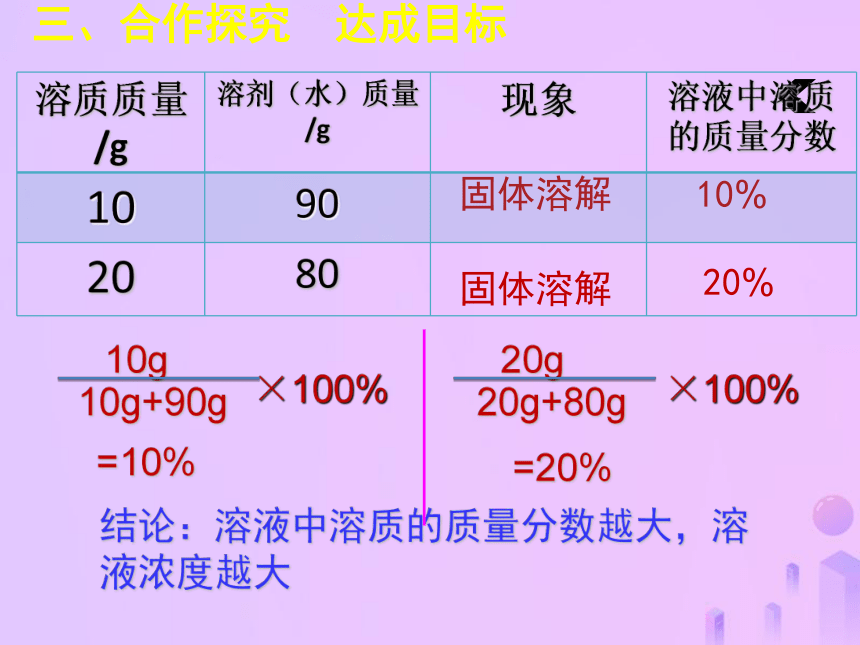
怎样比较溶液的稀浓?三、合作探究 达成目标溶质的质量分数1、概念:溶质质量与溶液质量之比。三、合作探究 达成目标结论:溶液中溶质的质量分数越大,溶液浓度越大固体溶解固体溶解10%
20%三、合作探究 达成目标[讨论]某氯化钠溶液中溶质的质量分数为10%,其含义是什么?表示100份质量的氯化钠溶液中含有10份质量的氯化钠,90份质量的水。溶质质量:溶剂质量=1:9三、合作探究 达成目标注意:
①溶质的质量:形成溶液的那部分溶质,无溶入溶液的不计。
②溶液的质量 = 溶质的质量 + 溶剂的质量。
(必须分清溶质、溶剂与溶液)。
③计算时上下质量单位要统一。
④不要忘记X100%,最后得到百分数。
⑤物质的质量分数要在不超过其最大溶解量的范围时才有意义。三、合作探究 达成目标生理盐水浓度是0.9%,每99.1克水和0.9克氯化钠溶解混合而成。 0.9%表示的意义是什么?
医用酒精浓度是75% ,每3体积的酒精和1体积的蒸馏水混合配制而成的的酒精溶液, 75%表示的意义是什么?【教师点拨】
溶液颜色由浅到深,浓度由小到大。颜色越深,浓度越大。但是溶液的浓与稀只能粗略地表明一定量的溶液里所含溶质的多少,但在实际应用中,常常要准确知道一定量溶液里含有溶质的质量。这就需要用到溶液的质量分数。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标三、合作探究 达成目标探究点二:溶液的稀释。?100% 溶液质量 = 溶质质量 + 溶剂质量[题型一] :有关溶质、溶剂和溶液之间的换算 溶质质量分数计算溶质质量溶液质量溶质质量分数=计算的依据 :三、合作探究 达成目标【例题1】在农业生产中,常需要用质量分数为16%的氯
化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各是多少?【解】答: 配制150kg质量分数为16%的氯化钠溶液
需24 kg氯化钠和126 kg水。三、合作探究 达成目标练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 %解:20g X10%加水:20g +2g=9.1%加盐:20g X10%+2g20g +2g=18.2%三、合作探究 达成目标 饱和溶液的溶质质量分数= 溶解度100g+溶解度溶质的质量分数36% 是指:
溶质T0C时溶解度36g是指:溶质质量分数与溶解度的比较在一定温度下的饱和溶液是最浓的溶液。100g溶液中含有36g溶质。在T0C 时,100g水最多溶解该溶质36g。三、合作探究 达成目标[题型二]:饱和溶液中溶质的质量分数计算 计算的依据 :饱和溶液的溶质质量分数= 溶解度100g+溶解度三、合作探究 达成目标 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:20℃时食盐饱和溶液的溶质质量分数为26.5%
三、合作探究 达成目标练习1:100C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g三、合作探究 达成目标? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量三、合作探究 达成目标例题3:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%X = 答:需要水的质量195g需要水的质量= 245 g– 50g = 195g三、合作探究 达成目标2.有40g溶质质量分数为5%的氯化钠溶液,若将其溶质的质量分数增大到10%,可以采取的方法是?解:方法一 增加溶质设应加入氯化钠固体的质量为x40gX5%+x=(40g+x)X10%)方法二 蒸发水分设应蒸发掉水的质量为y40gX5%=(40g—y)X10%解得 y=20g答:加入2.22g氯化钠,或蒸发掉20g水。解得 X=2.22g三、合作探究 达成目标【教师点拨】
溶液在稀释前后的质量相等,这是列等式进行计算的依据。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标【典例精讲】某工厂化验室配制5000g 20%的盐酸,需38%的盐酸(密度为1.19 g?cm-3)多少毫升?
思路点拨:
1.该题是有关溶液稀释问题。与例题2相比较,不同点是例题中已知数据都指质量,而此题需要根据体积先求出质量。
2.溶质的质量分数是质量比不能用体积直接带入公式计算。
答案:
解:设需38%的盐酸体积为x。
5000 g×20%=1.19 g?cm-3×x×38%,
x≈2211 mL。
答:需38%的盐酸221l mL。
归纳:溶质在稀释前后的质量相等,这是列等式进行计算的依据。四、总结梳理 内化目标一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.定义式:溶质的质量分数=×100%
二、溶液中溶质质量分数的计算
1.已知溶质和溶剂的质量,求溶质的质量分数。
2.已知溶液质量和溶质的质量分数,求溶质和溶剂的质量。
溶质质量=溶液质量×溶质的质量分数
溶液质量=溶质质量+溶剂质量。
3.溶液稀释和配制问题的计算
关键:稀释前溶质的质量=稀释后溶质的质量
涉及到体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分数
【易错易混提示】
1.没有溶解的溶质,不能算做溶液的质量。
2.溶液在稀释时,前后的质量可以进行加减,但体积不能进行加减。五、达标检测 反思目标1: 20g食盐溶液中含有 2g食盐,求:该溶液的溶质质量分数。
2: 40g 2%的食盐溶液中含有多少g食盐和水?
3: 20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数
4: 20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
5:20℃时,NaCl的溶解度是36克。现有50克水,加入20克NaCl,求:所得溶液的溶质质量分数。26.5% 答:含食盐0.8克,含水39.2克。答案:10%答案:18.2%答案;10 %。The end,thank you!谢谢大家
第1课时本节导读一、创设情景 明确目标 药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。一、创设情景 明确目标你观察到了什么?
看到这些,你想到了什么?二、自主学习 指向目标自读课本P42-P44,
完成学生用书当堂作业部分。三、合作探究 达成目标探究点一:溶质质量分数公式的理解。20.120.522浅蓝浅蓝蓝三、合作探究 达成目标两杯溶液都是无色透明,
怎样比较溶液的稀浓?三、合作探究 达成目标溶质的质量分数1、概念:溶质质量与溶液质量之比。三、合作探究 达成目标结论:溶液中溶质的质量分数越大,溶液浓度越大固体溶解固体溶解10%
20%三、合作探究 达成目标[讨论]某氯化钠溶液中溶质的质量分数为10%,其含义是什么?表示100份质量的氯化钠溶液中含有10份质量的氯化钠,90份质量的水。溶质质量:溶剂质量=1:9三、合作探究 达成目标注意:
①溶质的质量:形成溶液的那部分溶质,无溶入溶液的不计。
②溶液的质量 = 溶质的质量 + 溶剂的质量。
(必须分清溶质、溶剂与溶液)。
③计算时上下质量单位要统一。
④不要忘记X100%,最后得到百分数。
⑤物质的质量分数要在不超过其最大溶解量的范围时才有意义。三、合作探究 达成目标生理盐水浓度是0.9%,每99.1克水和0.9克氯化钠溶解混合而成。 0.9%表示的意义是什么?
医用酒精浓度是75% ,每3体积的酒精和1体积的蒸馏水混合配制而成的的酒精溶液, 75%表示的意义是什么?【教师点拨】
溶液颜色由浅到深,浓度由小到大。颜色越深,浓度越大。但是溶液的浓与稀只能粗略地表明一定量的溶液里所含溶质的多少,但在实际应用中,常常要准确知道一定量溶液里含有溶质的质量。这就需要用到溶液的质量分数。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标三、合作探究 达成目标探究点二:溶液的稀释。?100% 溶液质量 = 溶质质量 + 溶剂质量[题型一] :有关溶质、溶剂和溶液之间的换算 溶质质量分数计算溶质质量溶液质量溶质质量分数=计算的依据 :三、合作探究 达成目标【例题1】在农业生产中,常需要用质量分数为16%的氯
化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各是多少?【解】答: 配制150kg质量分数为16%的氯化钠溶液
需24 kg氯化钠和126 kg水。三、合作探究 达成目标练习1、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。练习2、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 %解:20g X10%加水:20g +2g=9.1%加盐:20g X10%+2g20g +2g=18.2%三、合作探究 达成目标 饱和溶液的溶质质量分数= 溶解度100g+溶解度溶质的质量分数36% 是指:
溶质T0C时溶解度36g是指:溶质质量分数与溶解度的比较在一定温度下的饱和溶液是最浓的溶液。100g溶液中含有36g溶质。在T0C 时,100g水最多溶解该溶质36g。三、合作探究 达成目标[题型二]:饱和溶液中溶质的质量分数计算 计算的依据 :饱和溶液的溶质质量分数= 溶解度100g+溶解度三、合作探究 达成目标 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:20℃时食盐饱和溶液的溶质质量分数为26.5%
三、合作探究 达成目标练习1:100C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g三、合作探究 达成目标? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量三、合作探究 达成目标例题3:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%X = 答:需要水的质量195g需要水的质量= 245 g– 50g = 195g三、合作探究 达成目标2.有40g溶质质量分数为5%的氯化钠溶液,若将其溶质的质量分数增大到10%,可以采取的方法是?解:方法一 增加溶质设应加入氯化钠固体的质量为x40gX5%+x=(40g+x)X10%)方法二 蒸发水分设应蒸发掉水的质量为y40gX5%=(40g—y)X10%解得 y=20g答:加入2.22g氯化钠,或蒸发掉20g水。解得 X=2.22g三、合作探究 达成目标【教师点拨】
溶液在稀释前后的质量相等,这是列等式进行计算的依据。
三、合作探究 达成目标【一试身手】
请同学们完成学生用书当堂作业部分。三、合作探究 达成目标【典例精讲】某工厂化验室配制5000g 20%的盐酸,需38%的盐酸(密度为1.19 g?cm-3)多少毫升?
思路点拨:
1.该题是有关溶液稀释问题。与例题2相比较,不同点是例题中已知数据都指质量,而此题需要根据体积先求出质量。
2.溶质的质量分数是质量比不能用体积直接带入公式计算。
答案:
解:设需38%的盐酸体积为x。
5000 g×20%=1.19 g?cm-3×x×38%,
x≈2211 mL。
答:需38%的盐酸221l mL。
归纳:溶质在稀释前后的质量相等,这是列等式进行计算的依据。四、总结梳理 内化目标一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.定义式:溶质的质量分数=×100%
二、溶液中溶质质量分数的计算
1.已知溶质和溶剂的质量,求溶质的质量分数。
2.已知溶液质量和溶质的质量分数,求溶质和溶剂的质量。
溶质质量=溶液质量×溶质的质量分数
溶液质量=溶质质量+溶剂质量。
3.溶液稀释和配制问题的计算
关键:稀释前溶质的质量=稀释后溶质的质量
涉及到体积时:
溶质质量=溶液体积×溶液密度×溶质的质量分数
【易错易混提示】
1.没有溶解的溶质,不能算做溶液的质量。
2.溶液在稀释时,前后的质量可以进行加减,但体积不能进行加减。五、达标检测 反思目标1: 20g食盐溶液中含有 2g食盐,求:该溶液的溶质质量分数。
2: 40g 2%的食盐溶液中含有多少g食盐和水?
3: 20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数
4: 20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
5:20℃时,NaCl的溶解度是36克。现有50克水,加入20克NaCl,求:所得溶液的溶质质量分数。26.5% 答:含食盐0.8克,含水39.2克。答案:10%答案:18.2%答案;10 %。The end,thank you!谢谢大家
同课章节目录
