2005-2006学年度《物质结构与性质》模块(理科)期末试卷及答案[上学期]
文档属性
| 名称 | 2005-2006学年度《物质结构与性质》模块(理科)期末试卷及答案[上学期] |  | |
| 格式 | zip | ||
| 文件大小 | 28.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-28 16:20:00 | ||
图片预览

文档简介
2005-006学年度上学期末考试高二化学(理科)试题
(物质结构与性质)
(广东惠州大亚湾澳头中学聂思良,邮编:516081,E-mail:nsllns5566525@ )
相对原子质量:H 1 C 12 O 16 S 32 Fe 56
一、选择题(共15小题,每小题2分,共30分,每小题只有一个选项符合题意)
.在多电子原子中,具有下列各组量子数的电子中能量最高的是
A.3、2、+1、+ B.2、1、+1、+
C.3、1、0、+ D.3、1、-1、+
.范德华力为a KJ·mol-1,化学键为b KJ·mol-1,氢键为c KJ·mol-1,则a、b、c的大小关系是
A.a>b>c B.b>a>c C.c>b>a D.b>c>a
.下列分子中,具有极性键的非极性分子的组是
A.H2、NH3、H2S B.CS2、BF3、CO2
C.CH3CI、CH2CI2、CH4 D.SO2、NO2、C2H2
.下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.SO2气体溶于水
.根据下表所列键能数据,下列分子中最不稳定的分子是
化学键 H-H H-CI H-Br CI-CI Br-Br
键能( KJ·mol-1) 436 431 299 247 193
A.HCI B.HBr C.H2 D.Br2
.金属具有延展性的原因是
A.金属原子半径都较大,价电子较小
B.金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用
C.金属中大量自由电子受外力作用时,运动速度加快
D.自由电子受外力作用时能迅速传递能量
.下列事实中能证明氯化氢是共价化合物的是
A.液态氯化氢不导电 B.氯化氢极易溶于水
C.氯化氢不易分解 D.氯化氢溶液可以电离
.下列表达式错误的是
A.甲烷的电子式:
B.氮原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子:12 6C
.第3周期元素形成的单质中,属于原子晶体的是
A.金刚砂 B.金刚石
C.单晶硅 D.二氧化碳
.下列性质中,可以证明某化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态下能导电
.只需克服范德华力就能气化的是
A.液态二氧化硫 B.液态氨 C.液态氟化氢 D.水
.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解 B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
.假设原子晶体SiO2中Si原子被铝原子取代,不足的价数由钾原子补充。当有25%的硅原子被铝原子取代时,可形成正长石。则正长石的化学组成为
A.KAISiO4 B.KAISi2O6 C.KAISi2O8 D.KAISi3O8
.在下列的电子结构中,第一电离能最小的原子可能是
A.ns2np3 B.ns2np5 C.ns1 D.ns2np6
.当下列物质以晶体形式存在时,其所属晶体类型和所含化学键类型分别相同的是
A.氯化钠、氯化氢 B.二氧化碳、二氧化硅
C.四氯化碳、四氯化硅 D.单质铁、单质碘
二、选择题(共5小题,每小题3分,共15分,每小题有1个或2个选项符合题意)
.氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子( ) 内的羟基与醛基之间即存在氢键(分子内氢键),
对羟基苯甲醛分子( HO CHO )之间存在氢键(分子间氢键)。则两者的熔
点、沸点的相对大小关系是
A.前者>后者 B.前者<后者 C.前者=后者 D.无法估计
.下列指定微粒数目之比不是1:1的是
A.Na2O2晶体中的阴离子和阳离子
B.NaHCO3晶体中的钠离子和碳酸氢根离子
C.24 12Mg2+ 离子中的质子数和中子数 D.氯化钠溶液中的钠离子和氯离子
.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了它存在的证据。若该氧分子具有空间对称结构,你认为该氧分子是
A.氧元素的一种同位素 B.臭氧的同素异形体
C.一种新的氧化物 D.可能是极性键构成的极性分子
.已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列C3N4晶体的说法中正确的是
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短
C.C3N4晶体中,C、N原子个数比为3:4
D.C3N4晶体中微粒间通过离子键结合
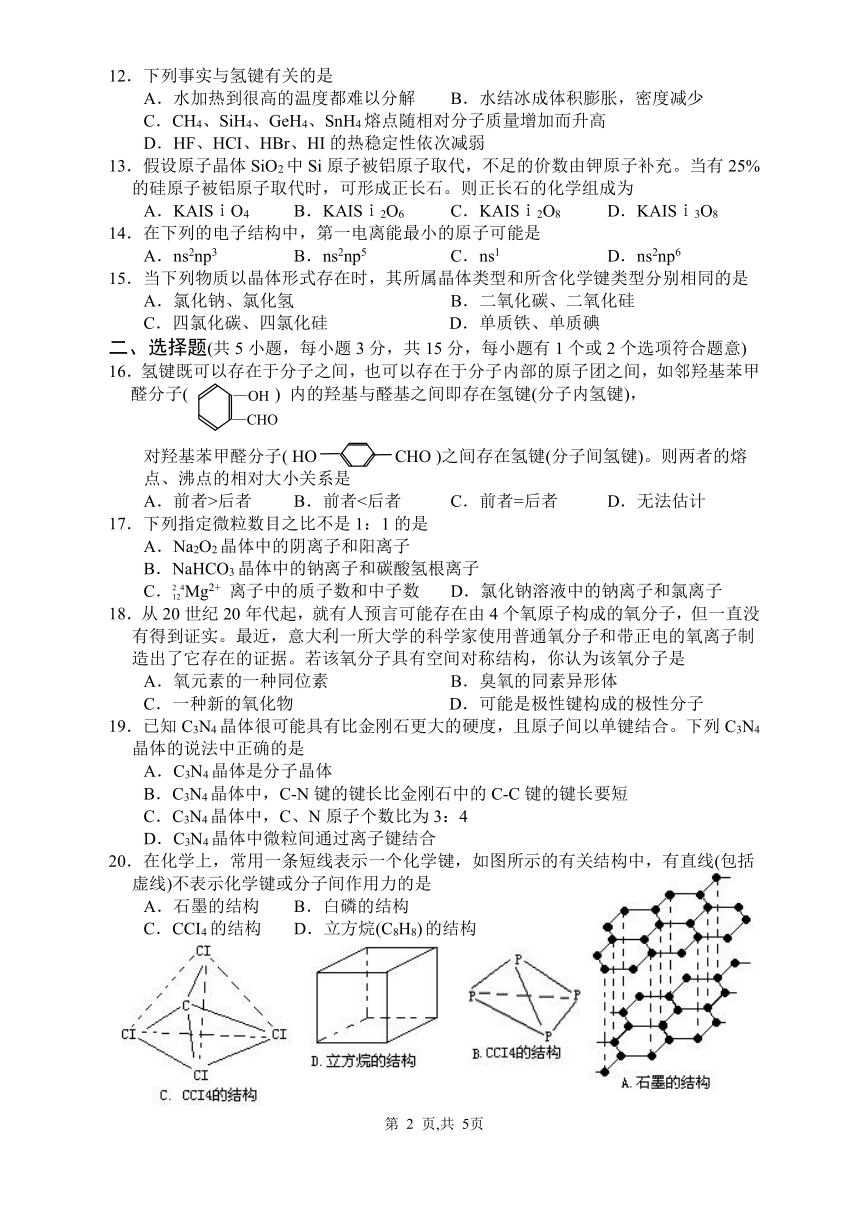
.在化学上,常用一条短线表示一个化学键,如图所示的有关结构中,有直线(包括虚线)不表示化学键或分子间作用力的是
A.石墨的结构 B.白磷的结构
C.CCI4的结构 D.立方烷(C8H8) 的结构
一、二选择题答案:(满分45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
答案
三、填空题(共3小题,共17分)
.(6分)在下列物质中:NaCI、NaOH、Na2O2、H2O2、(NH4)2S、CCI4、C2H2、SiC.
晶体硅、金刚石。
①其中只含有离子键的离子晶体是 ;
②其中既有离子键,又有极性键和配位键的离子晶体是 ;
③其中既有离子键,又有非极性键的是 ;
④其中含有非极性键的非极性分子的是 ;
⑤其中非极性键的极性分子的是 ;
⑥其中含有极性键的的原子晶体是 ;
.(7分)下图是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
⑴下列 (填写编号)组元素的单质可能都是电的良导体。(2分)
①a、c、h ②b、g、k ③c、h、l ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:A.原子核对核外电子的吸引力;B.形成稳定结构的倾向。
下图是一些气态原子失去核外不同电子所需的能量(KJ·mol-1)
锂 X Y
失去第一个电子 519 502 580
失去第二个电子 7296 4570 1820
失去第三个电子 11799 6920 2750
失去第四个电子 9550 11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量远远大于失去第一个电子所需要的能量 。
②表中X可能为以上13种元素中的 (填写字母),它与j元素形成的化合物的化学式为 。
③Y是周期表中 族元素。
④以上13种元素中 (填写字母)元素原子失去核外第一个电子需要的能量最多。
.(4分)氰(CN)2为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素的相似。
(1)写出氰与苛性钠溶液反应的化学方程式:
(2)已知氰分子键角之间夹角为180°并有对称性,(CN)2的结构式为 ,
(CN)2分子为 (填“极性”或“非极性”)分子。
(3)CN-中电子数为 。
四、计算题(18分)
.在互相平行的石墨晶格面上,原子排列成正六边形栅格,即“蜂窝结构”,如图所示。相邻两平面间的距离d为3.35×10-8 cm,石墨的密度为2.270g·cm-3。由于层与层之间可滑动,相邻平面间抽象出一个正六棱柱。求 正六边形面积
=6×a2×Sin60°
→ a
①一个该正六棱柱实际占有的碳原子数是多少?
②同一平面上原子间距离a为多少?
2005-2006学年度上学期末考试高二化学(理科)试题参考答案
(物质结构与性质)
一、二选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
答案 A D B D D B A C C D A B D C C B A B BC A
三、填空题
21.(6分)
①NaCI ②(NH4)2S ③Na2O2 ④C2H2 ⑤H2O2 ⑥SiC
22.(7分)
⑴ ①④ (2分)
⑵ ① Li原子失去1个电子后形成稳定结构,再失去1个电子很困难。
② a ,Na2O或Na2O2
③ ⅢA
④ m
23.(4分)
⑴ (CN)2+2NaOH=NaCN+NaCNO+H2O
⑵ N C C N , 非极性。
⑶ 14
四、计算题(18分)
解:① 一个正六棱柱实际占有的碳原子数是:(个) (6分)
② (8分)
(12分)
g·cm-3 (16分)
a≈1.42×10-8 cm ( 17分)
答:(略) (18分)
—OH
—CHO
PAGE
第 4 页,共 5页
(物质结构与性质)
(广东惠州大亚湾澳头中学聂思良,邮编:516081,E-mail:nsllns5566525@ )
相对原子质量:H 1 C 12 O 16 S 32 Fe 56
一、选择题(共15小题,每小题2分,共30分,每小题只有一个选项符合题意)
.在多电子原子中,具有下列各组量子数的电子中能量最高的是
A.3、2、+1、+ B.2、1、+1、+
C.3、1、0、+ D.3、1、-1、+
.范德华力为a KJ·mol-1,化学键为b KJ·mol-1,氢键为c KJ·mol-1,则a、b、c的大小关系是
A.a>b>c B.b>a>c C.c>b>a D.b>c>a
.下列分子中,具有极性键的非极性分子的组是
A.H2、NH3、H2S B.CS2、BF3、CO2
C.CH3CI、CH2CI2、CH4 D.SO2、NO2、C2H2
.下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.SO2气体溶于水
.根据下表所列键能数据,下列分子中最不稳定的分子是
化学键 H-H H-CI H-Br CI-CI Br-Br
键能( KJ·mol-1) 436 431 299 247 193
A.HCI B.HBr C.H2 D.Br2
.金属具有延展性的原因是
A.金属原子半径都较大,价电子较小
B.金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用
C.金属中大量自由电子受外力作用时,运动速度加快
D.自由电子受外力作用时能迅速传递能量
.下列事实中能证明氯化氢是共价化合物的是
A.液态氯化氢不导电 B.氯化氢极易溶于水
C.氯化氢不易分解 D.氯化氢溶液可以电离
.下列表达式错误的是
A.甲烷的电子式:
B.氮原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子:12 6C
.第3周期元素形成的单质中,属于原子晶体的是
A.金刚砂 B.金刚石
C.单晶硅 D.二氧化碳
.下列性质中,可以证明某化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态下能导电
.只需克服范德华力就能气化的是
A.液态二氧化硫 B.液态氨 C.液态氟化氢 D.水
.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解 B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
.假设原子晶体SiO2中Si原子被铝原子取代,不足的价数由钾原子补充。当有25%的硅原子被铝原子取代时,可形成正长石。则正长石的化学组成为
A.KAISiO4 B.KAISi2O6 C.KAISi2O8 D.KAISi3O8
.在下列的电子结构中,第一电离能最小的原子可能是
A.ns2np3 B.ns2np5 C.ns1 D.ns2np6
.当下列物质以晶体形式存在时,其所属晶体类型和所含化学键类型分别相同的是
A.氯化钠、氯化氢 B.二氧化碳、二氧化硅
C.四氯化碳、四氯化硅 D.单质铁、单质碘
二、选择题(共5小题,每小题3分,共15分,每小题有1个或2个选项符合题意)
.氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子( ) 内的羟基与醛基之间即存在氢键(分子内氢键),
对羟基苯甲醛分子( HO CHO )之间存在氢键(分子间氢键)。则两者的熔
点、沸点的相对大小关系是
A.前者>后者 B.前者<后者 C.前者=后者 D.无法估计
.下列指定微粒数目之比不是1:1的是
A.Na2O2晶体中的阴离子和阳离子
B.NaHCO3晶体中的钠离子和碳酸氢根离子
C.24 12Mg2+ 离子中的质子数和中子数 D.氯化钠溶液中的钠离子和氯离子
.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了它存在的证据。若该氧分子具有空间对称结构,你认为该氧分子是
A.氧元素的一种同位素 B.臭氧的同素异形体
C.一种新的氧化物 D.可能是极性键构成的极性分子
.已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列C3N4晶体的说法中正确的是
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短
C.C3N4晶体中,C、N原子个数比为3:4
D.C3N4晶体中微粒间通过离子键结合
.在化学上,常用一条短线表示一个化学键,如图所示的有关结构中,有直线(包括虚线)不表示化学键或分子间作用力的是
A.石墨的结构 B.白磷的结构
C.CCI4的结构 D.立方烷(C8H8) 的结构
一、二选择题答案:(满分45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
答案
三、填空题(共3小题,共17分)
.(6分)在下列物质中:NaCI、NaOH、Na2O2、H2O2、(NH4)2S、CCI4、C2H2、SiC.
晶体硅、金刚石。
①其中只含有离子键的离子晶体是 ;
②其中既有离子键,又有极性键和配位键的离子晶体是 ;
③其中既有离子键,又有非极性键的是 ;
④其中含有非极性键的非极性分子的是 ;
⑤其中非极性键的极性分子的是 ;
⑥其中含有极性键的的原子晶体是 ;
.(7分)下图是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
⑴下列 (填写编号)组元素的单质可能都是电的良导体。(2分)
①a、c、h ②b、g、k ③c、h、l ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:A.原子核对核外电子的吸引力;B.形成稳定结构的倾向。
下图是一些气态原子失去核外不同电子所需的能量(KJ·mol-1)
锂 X Y
失去第一个电子 519 502 580
失去第二个电子 7296 4570 1820
失去第三个电子 11799 6920 2750
失去第四个电子 9550 11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量远远大于失去第一个电子所需要的能量 。
②表中X可能为以上13种元素中的 (填写字母),它与j元素形成的化合物的化学式为 。
③Y是周期表中 族元素。
④以上13种元素中 (填写字母)元素原子失去核外第一个电子需要的能量最多。
.(4分)氰(CN)2为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素的相似。
(1)写出氰与苛性钠溶液反应的化学方程式:
(2)已知氰分子键角之间夹角为180°并有对称性,(CN)2的结构式为 ,
(CN)2分子为 (填“极性”或“非极性”)分子。
(3)CN-中电子数为 。
四、计算题(18分)
.在互相平行的石墨晶格面上,原子排列成正六边形栅格,即“蜂窝结构”,如图所示。相邻两平面间的距离d为3.35×10-8 cm,石墨的密度为2.270g·cm-3。由于层与层之间可滑动,相邻平面间抽象出一个正六棱柱。求 正六边形面积
=6×a2×Sin60°
→ a
①一个该正六棱柱实际占有的碳原子数是多少?
②同一平面上原子间距离a为多少?
2005-2006学年度上学期末考试高二化学(理科)试题参考答案
(物质结构与性质)
一、二选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
答案 A D B D D B A C C D A B D C C B A B BC A
三、填空题
21.(6分)
①NaCI ②(NH4)2S ③Na2O2 ④C2H2 ⑤H2O2 ⑥SiC
22.(7分)
⑴ ①④ (2分)
⑵ ① Li原子失去1个电子后形成稳定结构,再失去1个电子很困难。
② a ,Na2O或Na2O2
③ ⅢA
④ m
23.(4分)
⑴ (CN)2+2NaOH=NaCN+NaCNO+H2O
⑵ N C C N , 非极性。
⑶ 14
四、计算题(18分)
解:① 一个正六棱柱实际占有的碳原子数是:(个) (6分)
② (8分)
(12分)
g·cm-3 (16分)
a≈1.42×10-8 cm ( 17分)
答:(略) (18分)
—OH
—CHO
PAGE
第 4 页,共 5页
