物质的量复习[上学期]
图片预览




文档简介
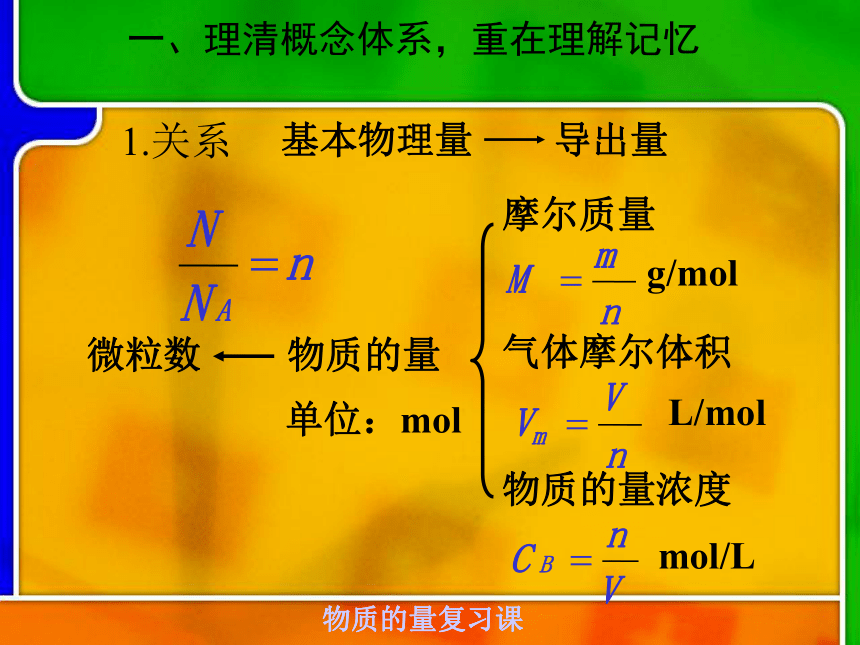
课件17张PPT。物质的量复习课微观粒子宏观物质物质的量个旧二中 彭超一、理清概念体系,重在理解记忆1.关系微粒数物质的量复习课2、理解概念1)物质的量2)摩尔质量4)气体摩尔体积5)阿伏加德罗定律6)物质的量浓度3)阿伏加德罗常数物质的量复习课二、以物质的量为中心建立各物理量之间的关系物质的
量浓度
(mol/L)物质的量(mol)物质的粒子数(mol/L)物质的
质量(g)气体体积(L)÷V液(L)×V液(L) ×M (g/mol) ÷M (g/mol) ×NA ÷NA ×Vm
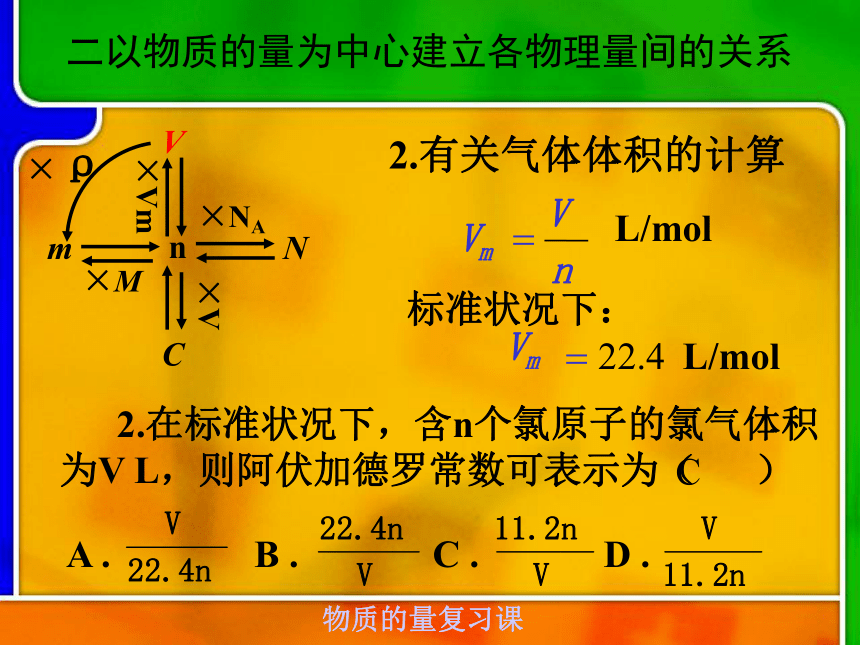
(L/mol) ÷ Vm (L/mol)二以物质的量为中心建立各物理量间的关系nNm×M× NA×VmVC×V1.有关NA的计算1.下列说法不正确的是( ) A.常温常压下,1molHe含有的原子为2NA? B.2.3g钠变成钠离子时失去0.1NA个电子
C.1molH2O的质量与NA个水分子的质量相等 D.标准状况下,22.4LCH4和H2混合物所含的
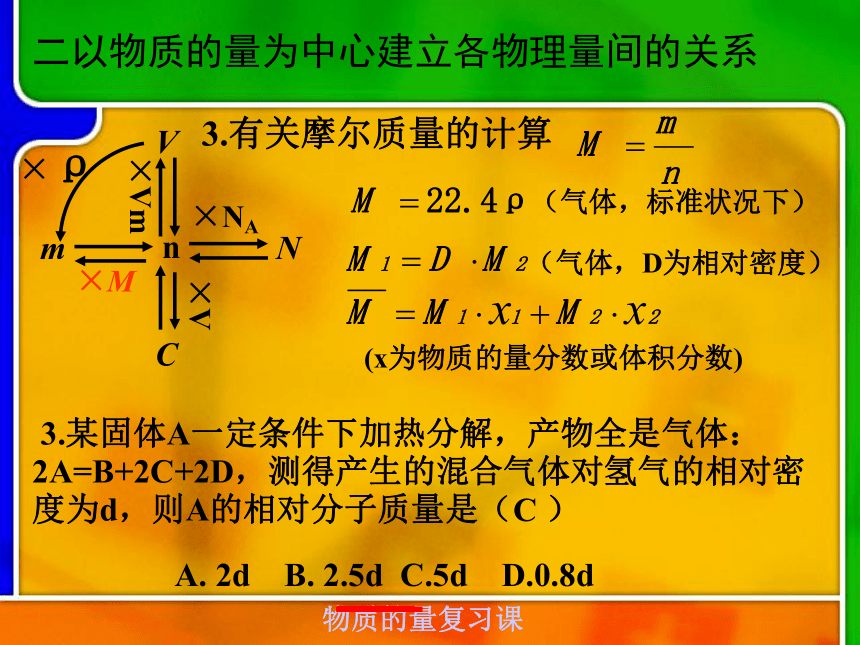
分子数为NA? A二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V2.有关气体体积的计算 2.在标准状况下,含n个氯原子的氯气体积为V L,则阿伏加德罗常数可表示为( )CA . B . C . D . L/molnVVm=标准状况下:Vm=22.4L/mol二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V3.有关摩尔质量的计算 3.某固体A一定条件下加热分解,产物全是气体:2A=B+2C+2D,测得产生的混合气体对氢气的相对密度为d,则A的相对分子质量是( )A. 2d B. 2.5d C.5d D.0.8dC(气体,D为相对密度)(气体,标准状况下)(x为物质的量分数或体积分数)二以物质的量为中心建立各物理量间的关系4.有关阿伏加德罗定律的计算4.同温同压下,某容器充满O2时重116g ,充满CO2时重122g,充满某气体时重114 g,则该气体的相对分子质量是( )
A.28 B.60 C.32 D.44A二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V5.有关溶液浓度的计算5.将标准状况下的aLHCl(气)溶于1L水中,所得盐酸溶液的密度为d g·m-3,则该盐酸溶液的物质的量浓度为二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V5.有关溶液浓度的计算6、50mL2mol·L-1的硫酸溶液中,加入50mL水,下列说法中正确的是( )
A.混合溶液的物质的量浓度为1mol·L-1
B.溶合液中含有0.2molH2SO4
C.混合液中的体积恰好为100mL
D.无法正确计算混合液的物质的量浓度2.主要仪器:烧杯、玻璃棒、容量瓶、胶头滴管;1.操作步骤:①计算②称量(或量取)③溶解(或稀释)④冷却⑤转移⑥洗涤⑦定容⑧摇匀⑨装瓶贴签。一定物质的量浓度溶液的配制3.误差分析:在配制溶液中哪些操作可能引起溶液浓度的误差? 可能影响溶液浓度的操作固体药品的称量与液体药品的量取不准确;
把溶液向容量瓶中转移,溶液洒了;
未洗涤烧杯和玻璃棒或洗涤了量筒;
定容时水加多了或加少了;定容时未平视刻度线。实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1) 应用托盘天平称取十水碳酸钠晶体_______g
(2) 若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
(4)若实验遇下列情况,溶液的浓度有何影响?
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶__________
C.容量瓶内壁附有水珠而未干燥处理____________
D.溶解后没有冷却便进行定容______________2.阿伏加德罗常数:0.012kg(12g)12C中所含的碳原子数。近似值为6.02×1023mol-11.摩尔:摩尔是物质的量的单位,用符号 mol表示,每摩尔物质含有阿伏加德罗常数个粒子。3.摩尔质量:单位物质的量的物质所具有的质量,单位为g·mol-1.
1mol物质的质量=相对分子质量理解概念 5.物质的量浓度:以单位体积溶液里所含溶质物质的量来表示溶液组成的物理量。单位为mol·L-1.4.气体摩尔体积:单位物质的量的气体所占的体积,单位为L·mol-1。
在标准状况时Vm=22.4 L·mol-1.理解概念6.阿伏加德罗定律同温同压下 两种气体的体积比=物质的量之比,
即:同温同压下 两种气体的密度比=摩尔质量之比,即:D1对2 在相同温度、相同压强时,相同的体积的
任何气体,都含有相同数目的分子数。理解概念7.混合气体的平均相对分子质量=理解概念
量浓度
(mol/L)物质的量(mol)物质的粒子数(mol/L)物质的
质量(g)气体体积(L)÷V液(L)×V液(L) ×M (g/mol) ÷M (g/mol) ×NA ÷NA ×Vm
(L/mol) ÷ Vm (L/mol)二以物质的量为中心建立各物理量间的关系nNm×M× NA×VmVC×V1.有关NA的计算1.下列说法不正确的是( ) A.常温常压下,1molHe含有的原子为2NA? B.2.3g钠变成钠离子时失去0.1NA个电子
C.1molH2O的质量与NA个水分子的质量相等 D.标准状况下,22.4LCH4和H2混合物所含的
分子数为NA? A二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V2.有关气体体积的计算 2.在标准状况下,含n个氯原子的氯气体积为V L,则阿伏加德罗常数可表示为( )CA . B . C . D . L/molnVVm=标准状况下:Vm=22.4L/mol二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V3.有关摩尔质量的计算 3.某固体A一定条件下加热分解,产物全是气体:2A=B+2C+2D,测得产生的混合气体对氢气的相对密度为d,则A的相对分子质量是( )A. 2d B. 2.5d C.5d D.0.8dC(气体,D为相对密度)(气体,标准状况下)(x为物质的量分数或体积分数)二以物质的量为中心建立各物理量间的关系4.有关阿伏加德罗定律的计算4.同温同压下,某容器充满O2时重116g ,充满CO2时重122g,充满某气体时重114 g,则该气体的相对分子质量是( )
A.28 B.60 C.32 D.44A二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V5.有关溶液浓度的计算5.将标准状况下的aLHCl(气)溶于1L水中,所得盐酸溶液的密度为d g·m-3,则该盐酸溶液的物质的量浓度为二以物质的量为中心建立各物理量间的关系nNm×M×NA×VmVC×V5.有关溶液浓度的计算6、50mL2mol·L-1的硫酸溶液中,加入50mL水,下列说法中正确的是( )
A.混合溶液的物质的量浓度为1mol·L-1
B.溶合液中含有0.2molH2SO4
C.混合液中的体积恰好为100mL
D.无法正确计算混合液的物质的量浓度2.主要仪器:烧杯、玻璃棒、容量瓶、胶头滴管;1.操作步骤:①计算②称量(或量取)③溶解(或稀释)④冷却⑤转移⑥洗涤⑦定容⑧摇匀⑨装瓶贴签。一定物质的量浓度溶液的配制3.误差分析:在配制溶液中哪些操作可能引起溶液浓度的误差? 可能影响溶液浓度的操作固体药品的称量与液体药品的量取不准确;
把溶液向容量瓶中转移,溶液洒了;
未洗涤烧杯和玻璃棒或洗涤了量筒;
定容时水加多了或加少了;定容时未平视刻度线。实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1) 应用托盘天平称取十水碳酸钠晶体_______g
(2) 若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
(4)若实验遇下列情况,溶液的浓度有何影响?
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶__________
C.容量瓶内壁附有水珠而未干燥处理____________
D.溶解后没有冷却便进行定容______________2.阿伏加德罗常数:0.012kg(12g)12C中所含的碳原子数。近似值为6.02×1023mol-11.摩尔:摩尔是物质的量的单位,用符号 mol表示,每摩尔物质含有阿伏加德罗常数个粒子。3.摩尔质量:单位物质的量的物质所具有的质量,单位为g·mol-1.
1mol物质的质量=相对分子质量理解概念 5.物质的量浓度:以单位体积溶液里所含溶质物质的量来表示溶液组成的物理量。单位为mol·L-1.4.气体摩尔体积:单位物质的量的气体所占的体积,单位为L·mol-1。
在标准状况时Vm=22.4 L·mol-1.理解概念6.阿伏加德罗定律同温同压下 两种气体的体积比=物质的量之比,
即:同温同压下 两种气体的密度比=摩尔质量之比,即:D1对2 在相同温度、相同压强时,相同的体积的
任何气体,都含有相同数目的分子数。理解概念7.混合气体的平均相对分子质量=理解概念
