物质的量第二课时[上学期]
文档属性
| 名称 | 物质的量第二课时[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 385.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-21 10:17:00 | ||
图片预览



文档简介
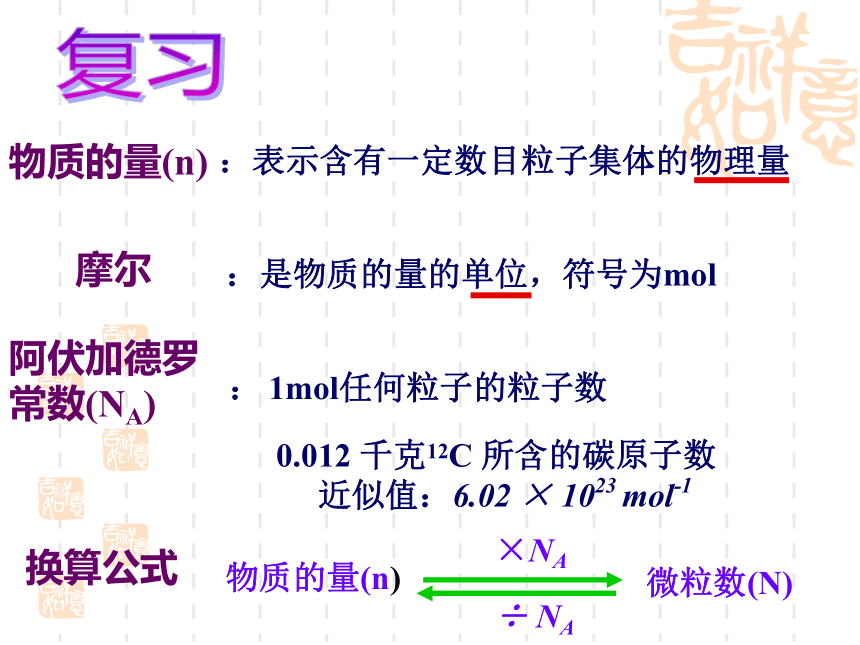
课件23张PPT。第一节 物质的量(第二课时)主讲人:曾珍物质的量(n)摩尔阿伏加德罗常数(NA):表示含有一定数目粒子集体的物理量:是物质的量的单位,符号为mol0.012 千克12C 所含的碳原子数
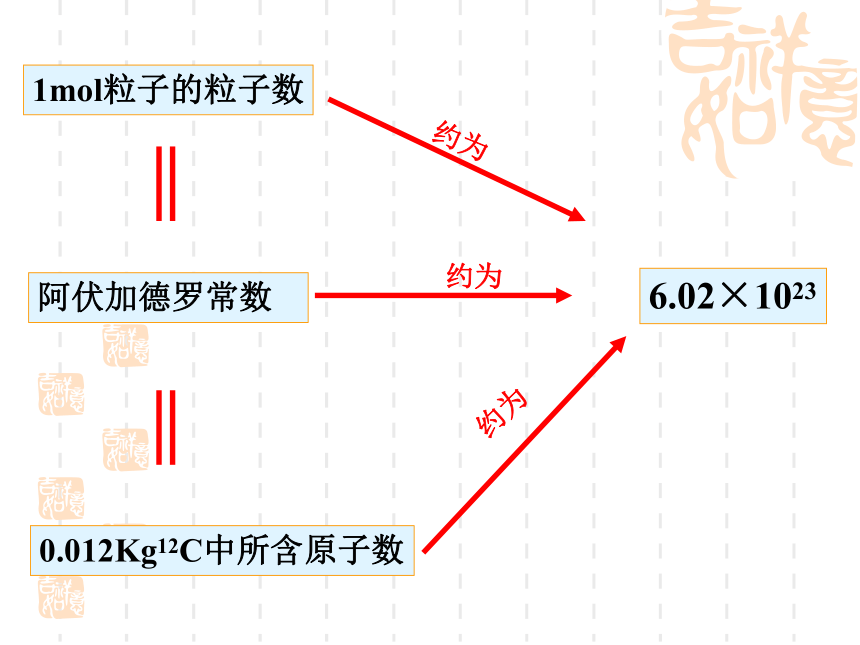
近似值:6.02 × 1023 mol-1复习换算公式: 1mol任何粒子的粒子数1mol粒子的粒子数0.012Kg12C中所含原子数阿伏加德罗常数6.02×1023约为约为约为下列关于阿伏加德罗常数的说法正确的是
( )
A、阿伏加德罗常数是12g碳中所含的碳原
子数
B、阿伏加德罗常数是0.012kg12C中所含的
原子数
C、阿伏加德罗常数是6.02×1023 mol-1
D、阿伏加德罗常数的符号为NA,近似值为
6.02×1023 mol-1复习题BD(1)在1mol CO分子中,
约含有 个CO分子,
约含有 个C原子,
约含有 个O原子,
约含有 个原子,
约含有 个质子,
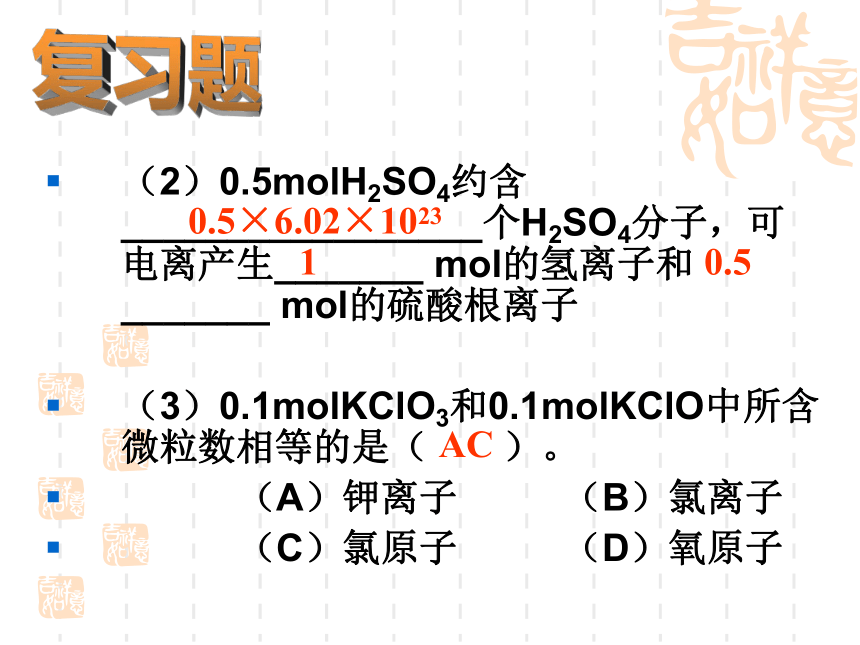
约含有 个电子,6.02×10236.02×10238.428×10241.204×10246.02×10238.428×1024复习题(2)0.5molH2SO4约含_________________个H2SO4分子,可电离产生_______ mol的氢离子和_______ mol的硫酸根离子
(3)0.1molKClO3和0.1molKClO中所含微粒数相等的是( )。
(A)钾离子 (B)氯离子
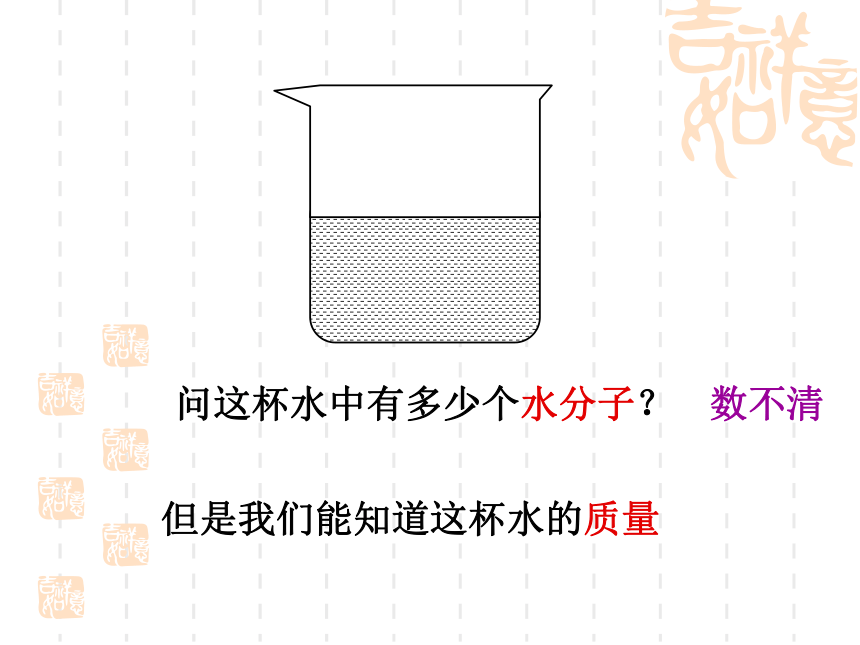
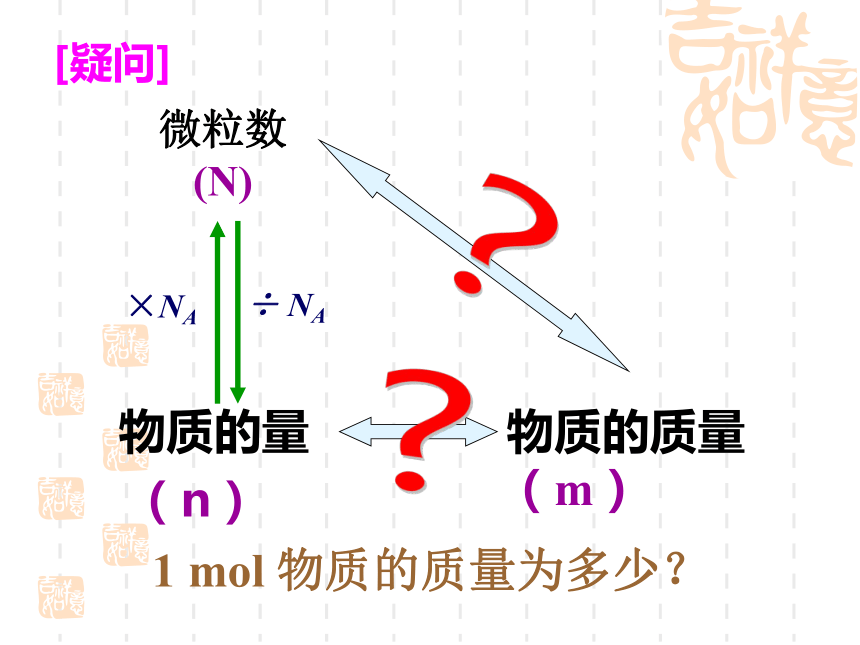
(C)氯原子 (D)氧原子AC0.5×6.02×1023 1 0.5复习题问这杯水中有多少个水分子?数不清但是我们能知道这杯水的质量[疑问] 物质的量
(n)?物质的质量(m)1 mol 物质的质量为多少?微粒数
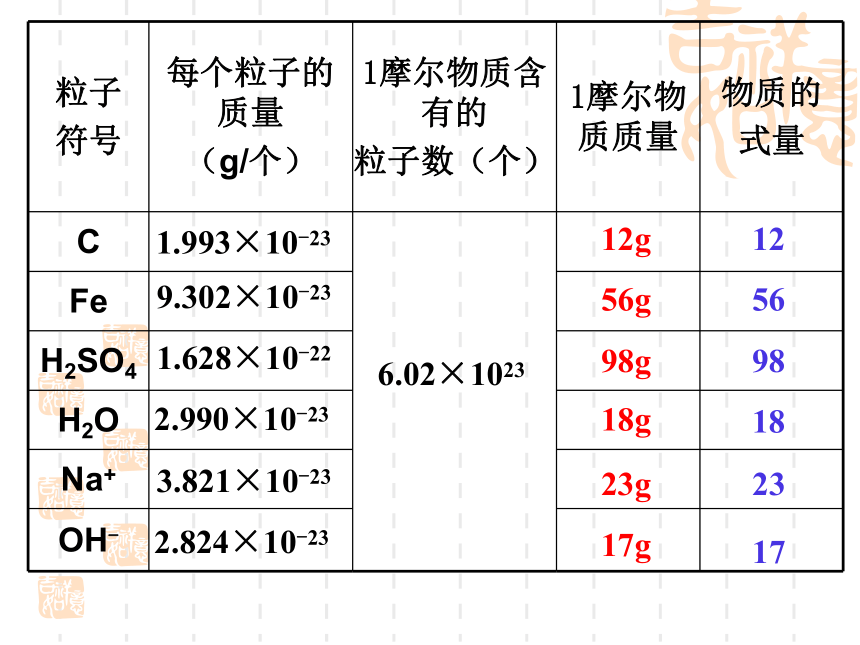
(N) ×NA ÷ NA?1.993×10-239.302×10-231.628×10-222.990×10-233.821×10-232.824×10-23126.02×102312g5656g9898g1818g2323g1717g①1mol任何原子的质量以克为单位时在数值上等于这种原子的相对原子质量。 ②1mol任何分子的质量以克为单位时在数值上等于这种分子的相对分子质量。 ③1mol任何离子的质量以克为单位时在数值上等于这种离子的式量。(离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计) 结论64324435.52358.5课堂练习:分析归纳: 1mol粒子的质量以克为单位时在数值上都与该粒子式量相等摩尔质量* 定义:单位物质的量的物质所具有的质量叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)和 Kg/mol(或Kg·mol-1)*** 数值:等于粒子的式量。**** 表示方法:如,M(H2O)=18 g·mol-1符号为M相对原子质量
相对分子质量1mol物质的质量摩尔质量单位数值相
同1gg·mol-1区别碳元素的相对原子质量为12,一个12C的质量为b g,一个A原子的质量为a g,则A的相对原子质量为 ( )A1molH2O的质量_____18g36g54g 3molH2O的质量_____2molH2O的质量_____nmolH2O的质量____18ngH2O的摩尔质量为18g·mol-1想一想物质的质量物质的量摩尔质量nmM =[例 1] 90克水的物质的量是多少?解: 水的相对分子质量是18,水的摩尔质量是 18g/mol 。n (H2O) = 90g18g/mol= 5 mol答:90克水的物质的量是5mol。练习:71gNa2SO4中含有Na+和SO42-的物质的量各是多少?n(Na2SO4)m(Na2SO4)M(Na2SO4)= ————= ————71g142g·mol-1=0.5mol则Na+的物质的量为1mol,SO42-的物质的量为0.5mol解:硫酸钠的相对分子质量为142,摩尔质量为142g·mol-1答:71gNa2SO4中含有Na+的物质的量为1mol,SO42-的物质的量为0.5mol回答 (1)100 mol H2O 质量是1800 g,含有6.02×1025个H2O分子。(2)0.1 mol OH-质量是1.7g,含6.02×1022个OH- 。用一定量钠与足量的水反应,得到4mol的H2,则参加反应的Na的物质的量为多少?参加反应的Na的质量为多少?小结摩尔质量* 定义:单位物质的量的物质所具有的质量叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)*** 数值:等于物质或粒子的式量。符号为M物质的量的意义:是联系宏观和微观的纽带或桥梁。书上P47 第三大题的1(3)、4(1)、6上交。其余的做在书上。
步步高P72 1-19做好,明天校对。作业
近似值:6.02 × 1023 mol-1复习换算公式: 1mol任何粒子的粒子数1mol粒子的粒子数0.012Kg12C中所含原子数阿伏加德罗常数6.02×1023约为约为约为下列关于阿伏加德罗常数的说法正确的是
( )
A、阿伏加德罗常数是12g碳中所含的碳原
子数
B、阿伏加德罗常数是0.012kg12C中所含的
原子数
C、阿伏加德罗常数是6.02×1023 mol-1
D、阿伏加德罗常数的符号为NA,近似值为
6.02×1023 mol-1复习题BD(1)在1mol CO分子中,
约含有 个CO分子,
约含有 个C原子,
约含有 个O原子,
约含有 个原子,
约含有 个质子,
约含有 个电子,6.02×10236.02×10238.428×10241.204×10246.02×10238.428×1024复习题(2)0.5molH2SO4约含_________________个H2SO4分子,可电离产生_______ mol的氢离子和_______ mol的硫酸根离子
(3)0.1molKClO3和0.1molKClO中所含微粒数相等的是( )。
(A)钾离子 (B)氯离子
(C)氯原子 (D)氧原子AC0.5×6.02×1023 1 0.5复习题问这杯水中有多少个水分子?数不清但是我们能知道这杯水的质量[疑问] 物质的量
(n)?物质的质量(m)1 mol 物质的质量为多少?微粒数
(N) ×NA ÷ NA?1.993×10-239.302×10-231.628×10-222.990×10-233.821×10-232.824×10-23126.02×102312g5656g9898g1818g2323g1717g①1mol任何原子的质量以克为单位时在数值上等于这种原子的相对原子质量。 ②1mol任何分子的质量以克为单位时在数值上等于这种分子的相对分子质量。 ③1mol任何离子的质量以克为单位时在数值上等于这种离子的式量。(离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计) 结论64324435.52358.5课堂练习:分析归纳: 1mol粒子的质量以克为单位时在数值上都与该粒子式量相等摩尔质量* 定义:单位物质的量的物质所具有的质量叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)和 Kg/mol(或Kg·mol-1)*** 数值:等于粒子的式量。**** 表示方法:如,M(H2O)=18 g·mol-1符号为M相对原子质量
相对分子质量1mol物质的质量摩尔质量单位数值相
同1gg·mol-1区别碳元素的相对原子质量为12,一个12C的质量为b g,一个A原子的质量为a g,则A的相对原子质量为 ( )A1molH2O的质量_____18g36g54g 3molH2O的质量_____2molH2O的质量_____nmolH2O的质量____18ngH2O的摩尔质量为18g·mol-1想一想物质的质量物质的量摩尔质量nmM =[例 1] 90克水的物质的量是多少?解: 水的相对分子质量是18,水的摩尔质量是 18g/mol 。n (H2O) = 90g18g/mol= 5 mol答:90克水的物质的量是5mol。练习:71gNa2SO4中含有Na+和SO42-的物质的量各是多少?n(Na2SO4)m(Na2SO4)M(Na2SO4)= ————= ————71g142g·mol-1=0.5mol则Na+的物质的量为1mol,SO42-的物质的量为0.5mol解:硫酸钠的相对分子质量为142,摩尔质量为142g·mol-1答:71gNa2SO4中含有Na+的物质的量为1mol,SO42-的物质的量为0.5mol回答 (1)100 mol H2O 质量是1800 g,含有6.02×1025个H2O分子。(2)0.1 mol OH-质量是1.7g,含6.02×1022个OH- 。用一定量钠与足量的水反应,得到4mol的H2,则参加反应的Na的物质的量为多少?参加反应的Na的质量为多少?小结摩尔质量* 定义:单位物质的量的物质所具有的质量叫摩尔质量。 ** 单位:g/mol(或 g·mol-1)*** 数值:等于物质或粒子的式量。符号为M物质的量的意义:是联系宏观和微观的纽带或桥梁。书上P47 第三大题的1(3)、4(1)、6上交。其余的做在书上。
步步高P72 1-19做好,明天校对。作业
