1.3 常见的酸 (第1课时)(课件 38张ppt)
文档属性
| 名称 | 1.3 常见的酸 (第1课时)(课件 38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2018-12-04 08:08:48 | ||
图片预览










文档简介
第3节
常见的酸
浙教版科学九年级上册第一章
第1课时
学习目标:
1.知道盐酸的物理性质和化学性质。
2.学会氯离子的的检验方法。
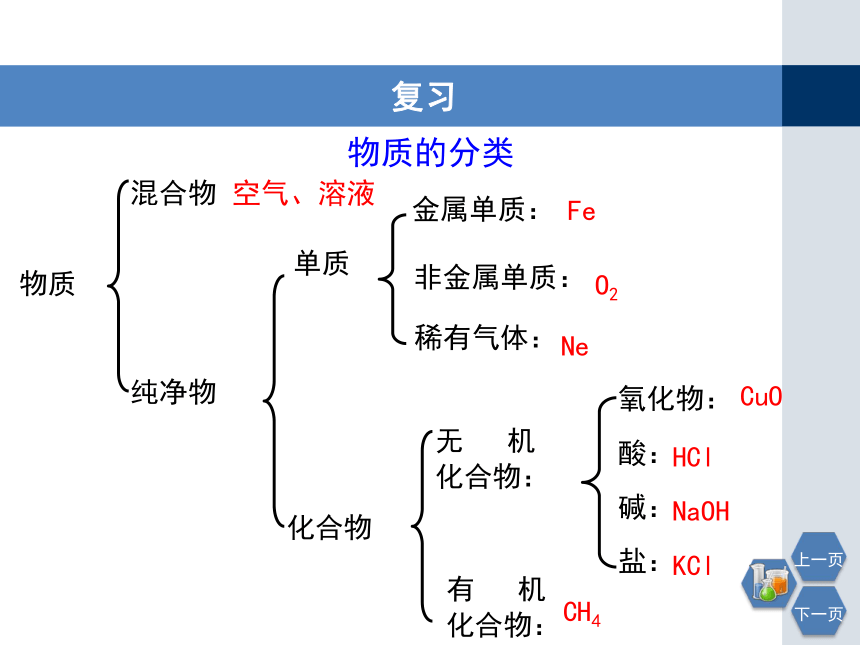
物质的分类
物质
单质
化合物
纯净物
混合物
空气、溶液
金属单质:
非金属单质:
稀有气体:
Fe
O2
Ne
无 机
化合物:
有 机
化合物:
CuO
CH4
氧化物:
酸:
碱:
盐:
HCl
NaOH
KCl
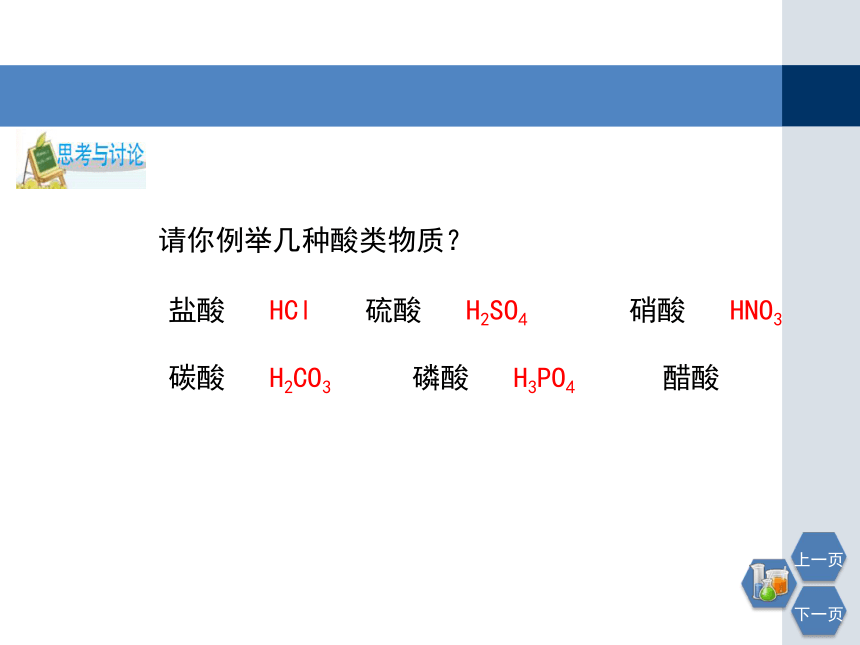
复习
请你例举几种酸类物质?
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
碳酸
H2CO3
磷酸
H3PO4
醋酸
酸是常见的一大类物质。
常见的酸有:
HCl
H2SO4
HNO3
一、盐 酸
1.查阅盐酸试剂瓶的标签上写了哪些内容。你能看懂那些内容吗?
盐酸(分析纯)
化学式:HCl 质量分数:37%
净含量:500ml 密度:1.19g/ml
【性状】本品为无色透明液体,
有刺激性气味挥发。
2.观察试剂瓶中盐酸的颜色和状态。
纯净的盐酸是无色的液体。
(工业盐酸因含杂质Fe3+,呈黄色)
3. 打开浓盐酸试剂瓶(脸不要正对瓶口上方),
观察瓶口有什么现象发生。用手轻轻扇动,小
心地闻一下盐酸的气味。盐酸具有______气味。
刺激性
在瓶口出现白雾现象。
浓盐酸具有挥发性。能挥发出氯化氢气体。氯化氢气体遇到空气中的水蒸气,形成盐酸小液滴,所以出现白雾现象。
如果浓盐酸敞口放置,会发生什么变化?
如果浓盐酸敞口放置,由于浓盐酸具有挥发性,因而会导致溶液质量和溶液中溶质的质量分数都减小。
4. 在盛有少量稀盐酸的试管里滴入几滴硝酸银溶
液,观察发生了什么变化_______________。
有白色沉淀生成
化学方程式:
HCl
+
AgNO3
AgCl
=
HNO3
+
再滴稀硝酸,观察其现象_______________。
白色沉淀不消失
白色沉淀不消失,说明了什么?
AgCl沉淀是一种既不溶于水,又不溶于酸的沉淀
实验室中常用这种方法检验盐酸或能电离出氯离子(Cl-)的物质的存在。
化学方程式:
NaCl
+
AgNO3
AgCl
=
NaNO3
+
在盛有少量氯化钠溶液的试管里滴入几滴硝酸银溶液,观察发生了什么变化_______________。
有白色沉淀生成
检验Cl-时,为什么要滴加稀HNO3溶液?
向碳酸钠溶液中滴几滴AgNO3溶液,再滴稀硝酸,观察?
滴AgNO3后有白色沉淀生成,再滴稀硝酸,白色沉淀消失,且有气泡出现。
Na2CO3
+
AgNO3
Ag2CO3
=
+
NaNO3
Ag2CO3
+
HNO3
=
AgNO3
+
+
H2O
CO2
检验Cl-时,要加几滴稀硝酸,目的是除去CO32-等杂质离子的干扰。
2
2
2
2
(一)盐酸(HCl)的个性
1.盐酸是氯化氢(HCl)气体的水溶液。纯净的盐酸是无色透明并有刺激性气味和酸味的液体。常用的浓盐酸中溶质的质量分数约为37%,密度为1.19克/厘米3。
2.浓盐酸具有挥发性。
3.盐酸与硝酸银溶液反应,能生成不溶于稀硝酸的AgCl白色沉淀。
盐酸还有哪些化学性质呢?
(二)稀盐酸(HCl)的化学性质
1.取2支试管,分别加入少量稀盐酸溶液。然后在2支试管内分别滴入几滴紫色石蕊试液、无色酚酞试液,观察并记录呈现的颜色。
1.盐酸能与指示剂反应
能使紫色石蕊试液变红,无色酚酞试液不变色。
2.把鸡蛋壳放入盛有盐酸的试管中,将燃着的火柴伸入试管口,如图1-19所示。你看到了什么现象?
产生大量气泡,燃着的木条熄灭
鸡蛋壳的主要成分是_______。
碳酸钙
盐酸溶液能与碳酸钙反应。反应中,碳酸钙固体溶解,并产生CO2气体,这些现象都是物质变化的证据。
化学方程式:
CaCO3
+
HCl
=
CaCl2
+
+
H2O
CO2
2.盐酸能与盐反应生成新盐和新酸
盐酸
+
盐
新盐
+
新酸
2
3.取一枚生锈的铁钉(铁锈的主要成分是Fe2O3 ),观察它的颜色。小心地让生锈的铁钉沿着试管壁滑到试管底部,向试管中滴加少量稀盐酸,振荡,如图1-20所示。过一会儿取出铁钉,用水冲洗干净。铁钉表面和溶液颜色发生了什么变化?
铁锈逐渐溶解,溶液变成黄色
化学方程式:
Fe2O3
+
HCl
H2O
=
FeCl3
+
6
2
3
溶液为什么会呈现黄色?
反应后有FeCl3生成,所以溶液变成黄色。
4. 向盛有少量氧化铜粉末的试管中加入2毫升
盐酸,微微加热。你看到了什么现象?
黑色粉末逐渐消失,溶液变成蓝色
化学方程式:
CuO
+
HCl
H2O
=
CuCl2
+
2
溶液为什么会呈现蓝色?
反应后有CuCl2生成,所以呈蓝色。
3.盐酸能与金属氧化物反应生成盐和水
盐酸
+
金属氧化物
盐
+
水
在盐酸除铁锈的实验中,气体是由什么反应生成的
在盐酸除铁锈的实验中
可观察到的现象?
可以看到铁钉表面?
盐酸与氧化铁反应的化学方程式?
【情景和问题的提出】
铁锈逐渐溶解,溶液变成黄色
有气泡生成
Fe2O3 + 6HCl == 2FeCl3 + 3 H2O
1.建立假设:
你的假设是:_________________________
盐酸与金属铁反应生成气体
那么这气体是怎么来的?是什么气体?
2.设计实验:
Fe2O3
稀HCl
溶 液
Fe
Fe
蒸馏水
Zn
稀HCl
溶 液
稀HCl
溶 液
A
B
C
D
【实验现象】
A试管中Fe2O3溶解,溶液变黄色,无气泡产生。
B试管中铁钉表面产生气泡。
C试管中铁钉表面无气泡产生。
D试管中锌粒表面产生气泡,且产生气泡速度比铁快。
用燃着的火柴靠近有气泡产生的试管口,观察现象。
或产生爆鸣声,或气体发生燃烧。
化学方程式:
产生的气体是:__________
氢气(H2)
Fe2O3
+
HCl
H2O
=
FeCl3
+
6
2
3
A试管:
Fe
+
HCl
H2
=
FeCl2
+
2
B试管:
Zn
+
HCl
H2
=
ZnCl2
+
2
D试管:
3.实验结果分析:
你的实验支持你的假设吗?为什么?
实验支持假设。
通过实验A、B、C比较分析
得出气体是由金属铁和稀盐酸反应的结论。
分析实验B、D,得出盐酸和金属反应产生氢气
4.盐酸能与金属反应生成盐和氢气
盐酸
+
(活泼)金属
盐
+
氢气
胃酸过多的病人常服用一种叫“胃舒平”(复方氢氧化铝)的药片来治病,该药片的主要成分是氢氧化铝。为什么“胃舒平”药片能医治胃酸过多症呢?
“胃舒平”药片的主要成分氢氧化铝,是一种碱,能和胃酸反应,所以可以用来治疗胃酸过多。
化学方程式:
Al(OH)3
+
HCl
H2O
=
AlCl3
+
3
3
5.盐酸能与碱反应生成盐和水
盐酸
+
碱
盐
+
水
稀盐酸(HCl)的化学性质
1.盐酸能与指示剂反应
能使紫色石蕊试液变红,无色酚酞试液不变色。
2.盐酸能与金属反应生成盐和氢气
盐酸
+
(活泼)金属
盐
+
氢气
3.盐酸能与金属氧化物反应生成盐和水
盐酸
+
金属氧化物
盐
+
水
小结
4.盐酸能与碱反应生成盐和水
盐酸
+
碱
盐
+
水
5.盐酸能与盐反应生成新盐和新酸
盐酸
+
盐
新盐
+
新酸
1.稀盐酸溶液能使紫色石蕊试液变成红色,这是因为其溶液
里都含有大量的( )
A.氯化氢分子 B.水分子
C.氢离子 D.氯离子
C
3.检验某溶液是否显酸性,取少量该溶液进行实
验,其中错误的做法是( )
A. 滴加酚酞试液 B. 滴加石蕊试液
C. 滴加碳酸钠溶液 D. 加入石灰石
A
2.下列四种物质分别加入稀盐酸后没有气体放出的是( )
A. 铁钉 B. 碳酸钠
C. 大理石 D. 氢氧化钙
D
4.盐酸在生产和生活中的用途很广。下列各项用
途是利用盐酸的哪些性质?试写出有关反应的
化学方程式。
(1)电镀前用盐酸清洗钢铁表面的铁锈。
(2)用稀盐酸清除锅炉内表面的水垢
[主要成分为CaCO3 和Mg(OH)2]
(3)胃痛吃几块苏打饼干[含纯碱]可减轻胃痛。
Fe2O3
+
HCl
H2O
=
FeCl3
+
6
2
3
CaCO3
+
HCl
=
CaCl2
+
+
H2O
CO2
2
Mg(OH)2
+
HCl
H2O
=
MgCl2
+
2
2
Na2CO3
+
HCl
=
NaCl
+
+
H2O
CO2
2
2
End
Thank
you
常见的酸
浙教版科学九年级上册第一章
第1课时
学习目标:
1.知道盐酸的物理性质和化学性质。
2.学会氯离子的的检验方法。
物质的分类
物质
单质
化合物
纯净物
混合物
空气、溶液
金属单质:
非金属单质:
稀有气体:
Fe
O2
Ne
无 机
化合物:
有 机
化合物:
CuO
CH4
氧化物:
酸:
碱:
盐:
HCl
NaOH
KCl
复习
请你例举几种酸类物质?
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
碳酸
H2CO3
磷酸
H3PO4
醋酸
酸是常见的一大类物质。
常见的酸有:
HCl
H2SO4
HNO3
一、盐 酸
1.查阅盐酸试剂瓶的标签上写了哪些内容。你能看懂那些内容吗?
盐酸(分析纯)
化学式:HCl 质量分数:37%
净含量:500ml 密度:1.19g/ml
【性状】本品为无色透明液体,
有刺激性气味挥发。
2.观察试剂瓶中盐酸的颜色和状态。
纯净的盐酸是无色的液体。
(工业盐酸因含杂质Fe3+,呈黄色)
3. 打开浓盐酸试剂瓶(脸不要正对瓶口上方),
观察瓶口有什么现象发生。用手轻轻扇动,小
心地闻一下盐酸的气味。盐酸具有______气味。
刺激性
在瓶口出现白雾现象。
浓盐酸具有挥发性。能挥发出氯化氢气体。氯化氢气体遇到空气中的水蒸气,形成盐酸小液滴,所以出现白雾现象。
如果浓盐酸敞口放置,会发生什么变化?
如果浓盐酸敞口放置,由于浓盐酸具有挥发性,因而会导致溶液质量和溶液中溶质的质量分数都减小。
4. 在盛有少量稀盐酸的试管里滴入几滴硝酸银溶
液,观察发生了什么变化_______________。
有白色沉淀生成
化学方程式:
HCl
+
AgNO3
AgCl
=
HNO3
+
再滴稀硝酸,观察其现象_______________。
白色沉淀不消失
白色沉淀不消失,说明了什么?
AgCl沉淀是一种既不溶于水,又不溶于酸的沉淀
实验室中常用这种方法检验盐酸或能电离出氯离子(Cl-)的物质的存在。
化学方程式:
NaCl
+
AgNO3
AgCl
=
NaNO3
+
在盛有少量氯化钠溶液的试管里滴入几滴硝酸银溶液,观察发生了什么变化_______________。
有白色沉淀生成
检验Cl-时,为什么要滴加稀HNO3溶液?
向碳酸钠溶液中滴几滴AgNO3溶液,再滴稀硝酸,观察?
滴AgNO3后有白色沉淀生成,再滴稀硝酸,白色沉淀消失,且有气泡出现。
Na2CO3
+
AgNO3
Ag2CO3
=
+
NaNO3
Ag2CO3
+
HNO3
=
AgNO3
+
+
H2O
CO2
检验Cl-时,要加几滴稀硝酸,目的是除去CO32-等杂质离子的干扰。
2
2
2
2
(一)盐酸(HCl)的个性
1.盐酸是氯化氢(HCl)气体的水溶液。纯净的盐酸是无色透明并有刺激性气味和酸味的液体。常用的浓盐酸中溶质的质量分数约为37%,密度为1.19克/厘米3。
2.浓盐酸具有挥发性。
3.盐酸与硝酸银溶液反应,能生成不溶于稀硝酸的AgCl白色沉淀。
盐酸还有哪些化学性质呢?
(二)稀盐酸(HCl)的化学性质
1.取2支试管,分别加入少量稀盐酸溶液。然后在2支试管内分别滴入几滴紫色石蕊试液、无色酚酞试液,观察并记录呈现的颜色。
1.盐酸能与指示剂反应
能使紫色石蕊试液变红,无色酚酞试液不变色。
2.把鸡蛋壳放入盛有盐酸的试管中,将燃着的火柴伸入试管口,如图1-19所示。你看到了什么现象?
产生大量气泡,燃着的木条熄灭
鸡蛋壳的主要成分是_______。
碳酸钙
盐酸溶液能与碳酸钙反应。反应中,碳酸钙固体溶解,并产生CO2气体,这些现象都是物质变化的证据。
化学方程式:
CaCO3
+
HCl
=
CaCl2
+
+
H2O
CO2
2.盐酸能与盐反应生成新盐和新酸
盐酸
+
盐
新盐
+
新酸
2
3.取一枚生锈的铁钉(铁锈的主要成分是Fe2O3 ),观察它的颜色。小心地让生锈的铁钉沿着试管壁滑到试管底部,向试管中滴加少量稀盐酸,振荡,如图1-20所示。过一会儿取出铁钉,用水冲洗干净。铁钉表面和溶液颜色发生了什么变化?
铁锈逐渐溶解,溶液变成黄色
化学方程式:
Fe2O3
+
HCl
H2O
=
FeCl3
+
6
2
3
溶液为什么会呈现黄色?
反应后有FeCl3生成,所以溶液变成黄色。
4. 向盛有少量氧化铜粉末的试管中加入2毫升
盐酸,微微加热。你看到了什么现象?
黑色粉末逐渐消失,溶液变成蓝色
化学方程式:
CuO
+
HCl
H2O
=
CuCl2
+
2
溶液为什么会呈现蓝色?
反应后有CuCl2生成,所以呈蓝色。
3.盐酸能与金属氧化物反应生成盐和水
盐酸
+
金属氧化物
盐
+
水
在盐酸除铁锈的实验中,气体是由什么反应生成的
在盐酸除铁锈的实验中
可观察到的现象?
可以看到铁钉表面?
盐酸与氧化铁反应的化学方程式?
【情景和问题的提出】
铁锈逐渐溶解,溶液变成黄色
有气泡生成
Fe2O3 + 6HCl == 2FeCl3 + 3 H2O
1.建立假设:
你的假设是:_________________________
盐酸与金属铁反应生成气体
那么这气体是怎么来的?是什么气体?
2.设计实验:
Fe2O3
稀HCl
溶 液
Fe
Fe
蒸馏水
Zn
稀HCl
溶 液
稀HCl
溶 液
A
B
C
D
【实验现象】
A试管中Fe2O3溶解,溶液变黄色,无气泡产生。
B试管中铁钉表面产生气泡。
C试管中铁钉表面无气泡产生。
D试管中锌粒表面产生气泡,且产生气泡速度比铁快。
用燃着的火柴靠近有气泡产生的试管口,观察现象。
或产生爆鸣声,或气体发生燃烧。
化学方程式:
产生的气体是:__________
氢气(H2)
Fe2O3
+
HCl
H2O
=
FeCl3
+
6
2
3
A试管:
Fe
+
HCl
H2
=
FeCl2
+
2
B试管:
Zn
+
HCl
H2
=
ZnCl2
+
2
D试管:
3.实验结果分析:
你的实验支持你的假设吗?为什么?
实验支持假设。
通过实验A、B、C比较分析
得出气体是由金属铁和稀盐酸反应的结论。
分析实验B、D,得出盐酸和金属反应产生氢气
4.盐酸能与金属反应生成盐和氢气
盐酸
+
(活泼)金属
盐
+
氢气
胃酸过多的病人常服用一种叫“胃舒平”(复方氢氧化铝)的药片来治病,该药片的主要成分是氢氧化铝。为什么“胃舒平”药片能医治胃酸过多症呢?
“胃舒平”药片的主要成分氢氧化铝,是一种碱,能和胃酸反应,所以可以用来治疗胃酸过多。
化学方程式:
Al(OH)3
+
HCl
H2O
=
AlCl3
+
3
3
5.盐酸能与碱反应生成盐和水
盐酸
+
碱
盐
+
水
稀盐酸(HCl)的化学性质
1.盐酸能与指示剂反应
能使紫色石蕊试液变红,无色酚酞试液不变色。
2.盐酸能与金属反应生成盐和氢气
盐酸
+
(活泼)金属
盐
+
氢气
3.盐酸能与金属氧化物反应生成盐和水
盐酸
+
金属氧化物
盐
+
水
小结
4.盐酸能与碱反应生成盐和水
盐酸
+
碱
盐
+
水
5.盐酸能与盐反应生成新盐和新酸
盐酸
+
盐
新盐
+
新酸
1.稀盐酸溶液能使紫色石蕊试液变成红色,这是因为其溶液
里都含有大量的( )
A.氯化氢分子 B.水分子
C.氢离子 D.氯离子
C
3.检验某溶液是否显酸性,取少量该溶液进行实
验,其中错误的做法是( )
A. 滴加酚酞试液 B. 滴加石蕊试液
C. 滴加碳酸钠溶液 D. 加入石灰石
A
2.下列四种物质分别加入稀盐酸后没有气体放出的是( )
A. 铁钉 B. 碳酸钠
C. 大理石 D. 氢氧化钙
D
4.盐酸在生产和生活中的用途很广。下列各项用
途是利用盐酸的哪些性质?试写出有关反应的
化学方程式。
(1)电镀前用盐酸清洗钢铁表面的铁锈。
(2)用稀盐酸清除锅炉内表面的水垢
[主要成分为CaCO3 和Mg(OH)2]
(3)胃痛吃几块苏打饼干[含纯碱]可减轻胃痛。
Fe2O3
+
HCl
H2O
=
FeCl3
+
6
2
3
CaCO3
+
HCl
=
CaCl2
+
+
H2O
CO2
2
Mg(OH)2
+
HCl
H2O
=
MgCl2
+
2
2
Na2CO3
+
HCl
=
NaCl
+
+
H2O
CO2
2
2
End
Thank
you
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
