1.5 酸和碱之间发生的反应(课件 32张ppt)
文档属性
| 名称 | 1.5 酸和碱之间发生的反应(课件 32张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2018-12-04 08:19:06 | ||
图片预览







文档简介
第1节
酸和碱之间发生的反应
浙教版科学九年级上册第一章
学习目标:
1.通过自主探究寻找酸和碱之间发生反应的证据;
2.例举酸碱反应在生活中的应用。
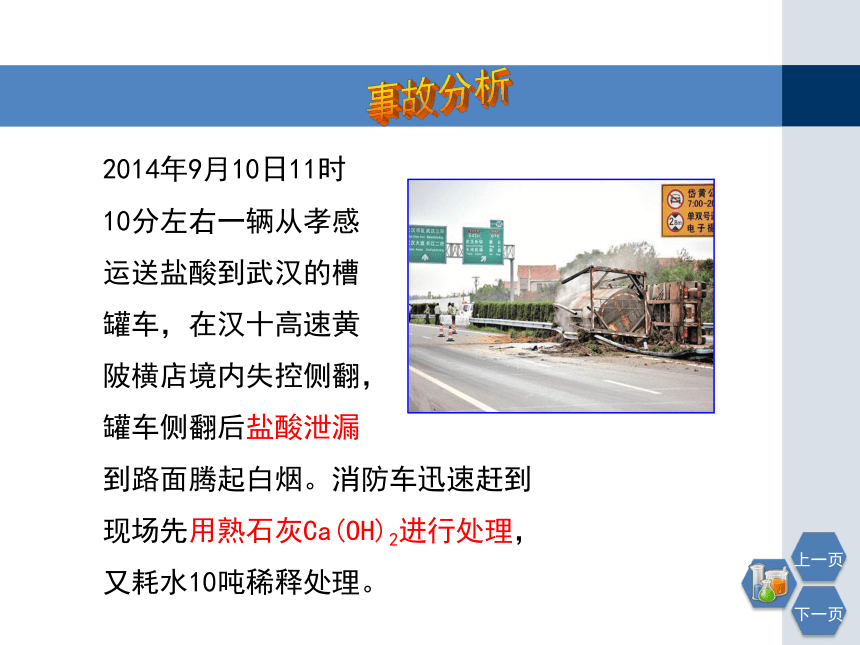
2014年9月10日11时
10分左右一辆从孝感
运送盐酸到武汉的槽
罐车,在汉十高速黄
陂横店境内失控侧翻,
罐车侧翻后盐酸泄漏
到路面腾起白烟。消防车迅速赶到现场先用熟石灰Ca(OH)2进行处理,又耗水10吨稀释处理。
酸和碱之间的反应
【情景和问题的提出】
酸具有酸性,pH<7,能使紫色石蕊试液变___色,
碱具有碱性,pH>7,能使紫色石蕊试液变___色,如果酸和碱之间发生反应,结果会怎么样?
红
蓝
1.建立假设:
你的假设是:
酸与碱反应,酸的酸性会减弱,
碱的碱性也会减弱,结果可能会中和,pH=7
2.设计实验:
用稀盐酸与氢氧化钠溶液实验
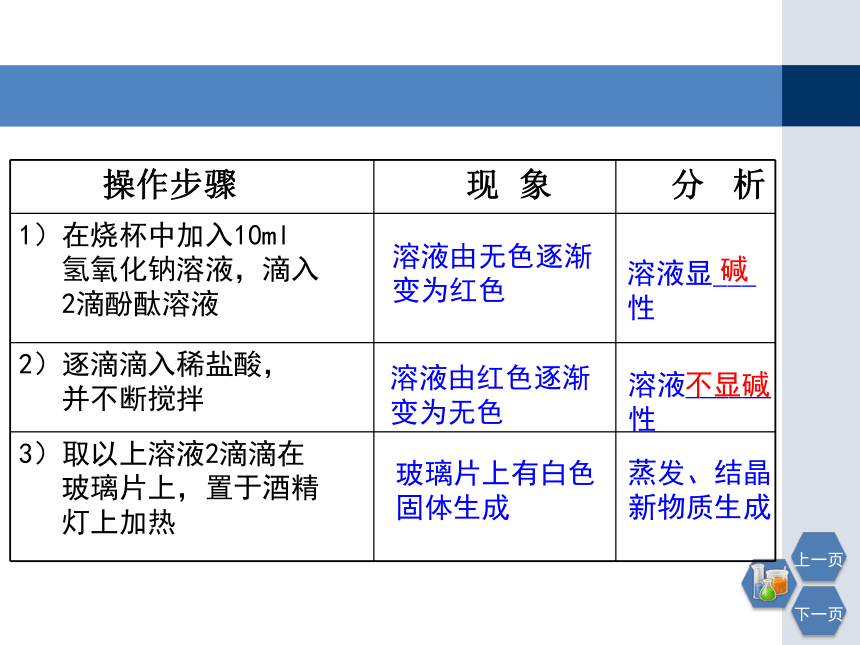
溶液由无色逐渐变为红色
溶液由红色逐渐变为无色
玻璃片上有白色固体生成
溶液显___ 性
溶液______ 性
蒸发、结晶
新物质生成
碱
不显碱
操作步骤 现 象 分 析
1)在烧杯中加入10ml
氢氧化钠溶液,滴入
2滴酚酞溶液
2)逐滴滴入稀盐酸,
并不断搅拌
3)取以上溶液2滴滴在
玻璃片上,置于酒精
灯上加热
1.酚酞在实验中起什么作用?还有什么方法可以起到类似的作用?
酚酞起指示作用,根据酚酞试液由红色变为无色来判断NaOH和HCl是否反应完全。
还可以用紫色石蕊试液来判断反应恰好完成。
2.为什么在操作中必须逐滴滴入稀盐酸?
防止稀盐酸滴加过量。
3.玻璃片上的物质还是氢氧化钠吗?为什么?
不是,因为氢氧化钠已经完全反应。酚酞试液已经由红色变为无色。
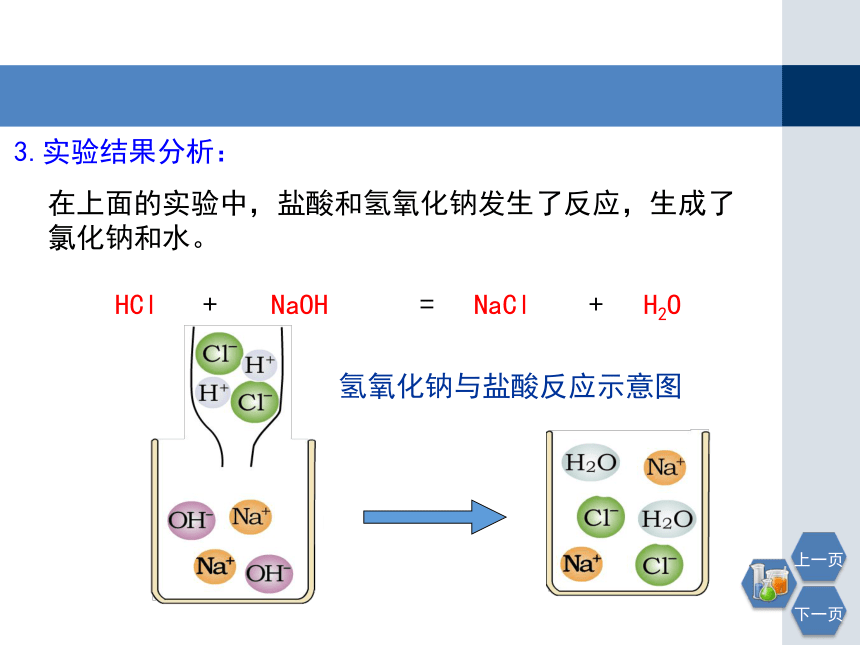
3.实验结果分析:
在上面的实验中,盐酸和氢氧化钠发生了反应,生成了氯化钠和水。
氢氧化钠与盐酸反应示意图
NaOH
+
HCl
H2O
=
NaCl
+
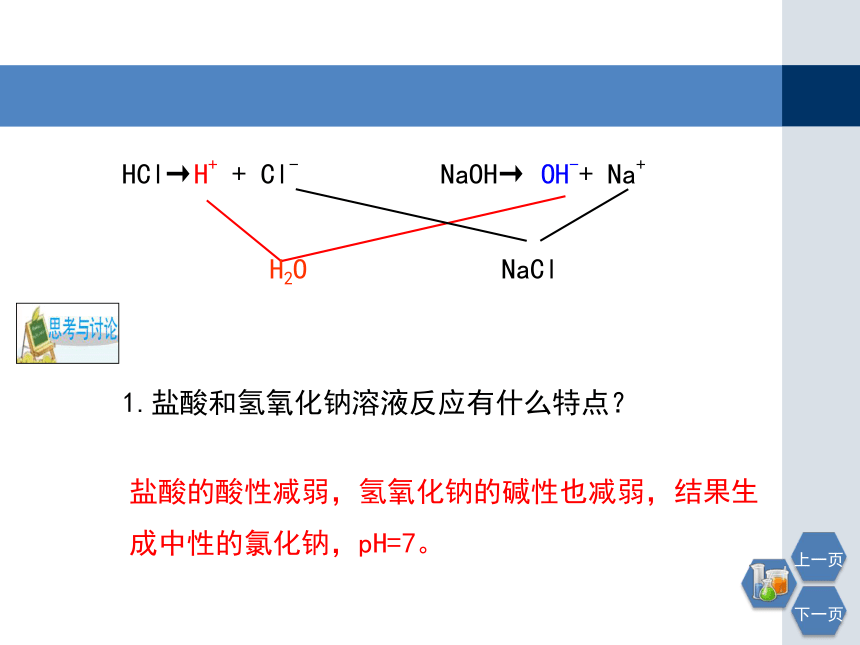
HCl→H+ + Cl-
NaOH→ OH-+ Na+
H2O
NaCl
1.盐酸和氢氧化钠溶液反应有什么特点?
盐酸的酸性减弱,氢氧化钠的碱性也减弱,结果生成中性的氯化钠,pH=7。
pH=7
2.硫酸和氢氧化钾溶液反应也有这样的特点吗?
氢氧化钾
酚酞
显红色
氢氧化钾
稀硫酸
KOH
+
H2SO4
H2O
=
K2SO4
+
2
2
化学方程式:
2014年9月10日11时
10分左右一辆从孝感
运送盐酸到武汉的槽
罐车,在汉十高速黄
陂横店境内失控侧翻,
罐车侧翻后盐酸泄漏
到路面腾起白烟。消防车迅速赶到现场先用熟石灰Ca(OH)2进行处理,又耗水10吨稀释处理。
Ca(OH)2
+
HCl
H2O
=
CaCl2
+
2
2
化学方程式:
以上3个反应有什么共同的特点呢?
NaOH
+
HCl
H2O
=
NaCl
+
KOH
+
H2SO4
H2O
=
K2SO4
+
2
2
Ca(OH)2
+
HCl
H2O
=
CaCl2
+
2
2
酸
碱
水
盐
+
=
+
一、酸碱反应
酸跟碱作用生成盐和水的反应叫酸碱反应。
1.定义
视频
读下图,用你自己的话,概括一下酸与碱之间反应的实质。
酸中的氢离子跟碱中的氢氧根离子结合生成水。
OH_
+
H+
H2O
=
2.实质
二、酸碱反应的应用
1.农业上用施加熟石灰[主要含Ca(OH)2]的方法来降低土壤的酸性。
2.用碱处理酸性的工业废水
3.精制石油时,用氢氧化钠来中和过量的酸。
你能例举生活中酸碱反应的应用吗?
4.用氢氧化铝来中和胃中过量的酸。
Al(OH)3
+
HCl
H2O
=
AlCl3
+
3
3
胃乐说明书
[药品名称] 胃乐胶囊
[性状] 本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦
[主要成分] 氢氧化铝[Al(OH)3]、甘草提取物、白芨、木香等
[药理作用] 中和胃酸过多、抗溃疡、镇痛、抗炎
[功能与主治] 用于慢性胃炎胃酸和多酸胃痛。行气止痛,收敛生肌,
促进溃疡愈合。
[用法与用量] 口服,一次2~3粒,一日3次,空腹服用
[规格] 0.4g/粒
[贮藏] 密封,置干燥阴凉处
[包装] 20粒/盒
[有效期] 两年
1.为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法可消除肿痛?
【查阅资料】蚊虫叮咬时能在人的皮肤内分泌蚁酸刺激皮肤,蚁酸是一种有机酸,名称叫做甲酸,化学式为HCOOH
可涂抹一些含有弱碱性物质的药水。如:氨水(NH3·H2O)、肥皂水。
2.被蜜蜂这蛰后,用肥皂水或氨水清洗;被马蜂蛰后,用食醋止痛止痒;你知道这是为什么?
蜜蜂毒液显 性,马蜂毒液显 性。
碱
酸
三、土壤酸碱性测定
【实验目标】
1.初步学会土壤取样测试的方法。
2.学会用 pH 试纸测定土壤酸碱度。
3.了解保护土壤资源的重要性,提出改良土壤酸碱性的建
议。
【实验器材】
木棍,废报纸,玻璃棒,试管,蒸馏水,pH试纸(精密pH试纸及比色卡),窗纱(或金属筛),布袋。
【实验过程】
一、土壤取样方法
二、待测液的准备
三、pH试纸测试操作方法
【实验讨论】
1.当地作物地土壤酸碱性如何?是否适宜这类植物的生长。
2.提出改良当地土壤酸碱性的建议。
【实验过程】
一、土壤取样方法
二、待测液的准备
一、酸碱反应
酸跟碱作用生成盐和水的反应叫酸碱反应。
OH_
+
H+
H2O
=
实质:
二、酸碱反应的应用
1. 改善土壤的酸性。
2. 处理工业废水
3. 精制石油时,中和过量的酸。
三、土壤酸碱性测定
1. 土壤取样方法
2. 待测液的准备
3. pH试纸测试操作方法
小结
1. 将一定量的某盐酸加水充分稀释,所得溶液的 pH( )
A. 一定等于 7 B. 一定大于 7
C. 一定小于 7 D. 一定等于 0
C
2. 一些国家正在试用碳酸水浇灌某些植物,其作用是( )
A. 调节土壤的 pH,改良酸性土壤
B. 调节土壤的 pH,改良碱性土壤
C. 促进植物的光合作用
D. 在植物上方形成温室
C
B
3.一般中和酸性土壤用_______ 其化学式为__________
熟石灰
Ca(OH)2
4. 下列说法正确的是-----------------------( )
A、能电离出OH-的化合物不一定是碱
B、紫色石蕊试液能使酸溶液变红
C、pH值大于7的一定是碱溶液
D、生成盐和水的反应都是酸碱反应
A
5.实验室中有两瓶没有标签的无色溶液,已知
其中一瓶是盐酸溶液,另一瓶是氢氧化钠溶液,
你能用哪些方法将两者区分开来?
1).运用酸碱指示剂、pH试纸、pH计检测。
2).利用碳酸钠、碳酸钙与盐酸溶液反应产生气体检测。
3).利用氯化铁、氯化铜与氢氧化钠溶液反应产生沉淀。
4).通过加热蒸发办法,观察有无晶体剩余来检测。
6.完全中和25克氢氧化钠溶液,用去了质量分数为20%的稀硫酸24.5克,求氢氧化钠的溶液的质量分数。
解:
设:氢氧化钠的溶液的质量分数为x%
NaOH
+
H2SO4
H2O
=
Na2SO4
+
2
2
98
80
24.5克
20%
×
25克
×
x%
98
80
=
24.5克
20%
×
25克
×
x%
x%
=
16%
答:氢氧化钠的溶液的质量分数为16%
End
Thank
you
酸和碱之间发生的反应
浙教版科学九年级上册第一章
学习目标:
1.通过自主探究寻找酸和碱之间发生反应的证据;
2.例举酸碱反应在生活中的应用。
2014年9月10日11时
10分左右一辆从孝感
运送盐酸到武汉的槽
罐车,在汉十高速黄
陂横店境内失控侧翻,
罐车侧翻后盐酸泄漏
到路面腾起白烟。消防车迅速赶到现场先用熟石灰Ca(OH)2进行处理,又耗水10吨稀释处理。
酸和碱之间的反应
【情景和问题的提出】
酸具有酸性,pH<7,能使紫色石蕊试液变___色,
碱具有碱性,pH>7,能使紫色石蕊试液变___色,如果酸和碱之间发生反应,结果会怎么样?
红
蓝
1.建立假设:
你的假设是:
酸与碱反应,酸的酸性会减弱,
碱的碱性也会减弱,结果可能会中和,pH=7
2.设计实验:
用稀盐酸与氢氧化钠溶液实验
溶液由无色逐渐变为红色
溶液由红色逐渐变为无色
玻璃片上有白色固体生成
溶液显___ 性
溶液______ 性
蒸发、结晶
新物质生成
碱
不显碱
操作步骤 现 象 分 析
1)在烧杯中加入10ml
氢氧化钠溶液,滴入
2滴酚酞溶液
2)逐滴滴入稀盐酸,
并不断搅拌
3)取以上溶液2滴滴在
玻璃片上,置于酒精
灯上加热
1.酚酞在实验中起什么作用?还有什么方法可以起到类似的作用?
酚酞起指示作用,根据酚酞试液由红色变为无色来判断NaOH和HCl是否反应完全。
还可以用紫色石蕊试液来判断反应恰好完成。
2.为什么在操作中必须逐滴滴入稀盐酸?
防止稀盐酸滴加过量。
3.玻璃片上的物质还是氢氧化钠吗?为什么?
不是,因为氢氧化钠已经完全反应。酚酞试液已经由红色变为无色。
3.实验结果分析:
在上面的实验中,盐酸和氢氧化钠发生了反应,生成了氯化钠和水。
氢氧化钠与盐酸反应示意图
NaOH
+
HCl
H2O
=
NaCl
+
HCl→H+ + Cl-
NaOH→ OH-+ Na+
H2O
NaCl
1.盐酸和氢氧化钠溶液反应有什么特点?
盐酸的酸性减弱,氢氧化钠的碱性也减弱,结果生成中性的氯化钠,pH=7。
pH=7
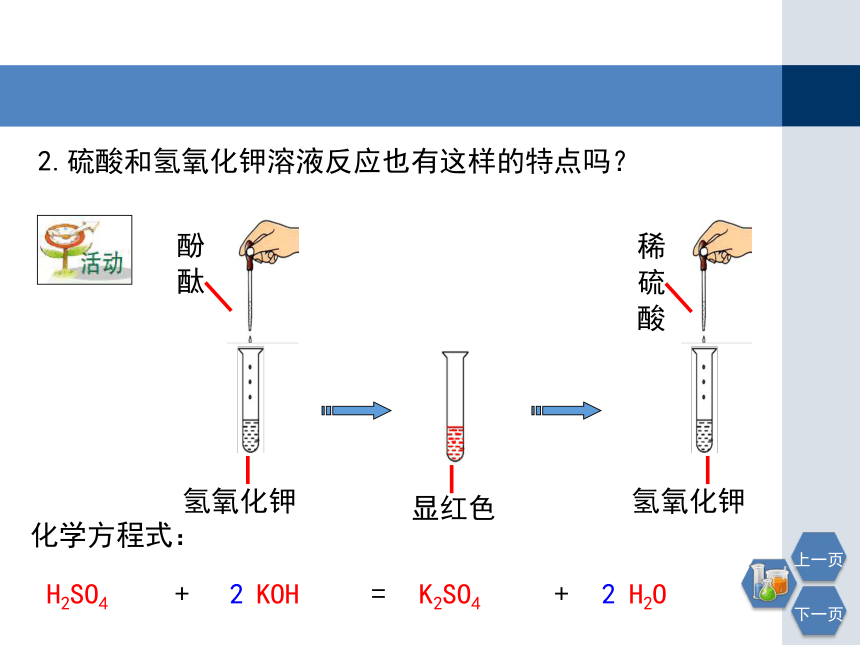
2.硫酸和氢氧化钾溶液反应也有这样的特点吗?
氢氧化钾
酚酞
显红色
氢氧化钾
稀硫酸
KOH
+
H2SO4
H2O
=
K2SO4
+
2
2
化学方程式:
2014年9月10日11时
10分左右一辆从孝感
运送盐酸到武汉的槽
罐车,在汉十高速黄
陂横店境内失控侧翻,
罐车侧翻后盐酸泄漏
到路面腾起白烟。消防车迅速赶到现场先用熟石灰Ca(OH)2进行处理,又耗水10吨稀释处理。
Ca(OH)2
+
HCl
H2O
=
CaCl2
+
2
2
化学方程式:
以上3个反应有什么共同的特点呢?
NaOH
+
HCl
H2O
=
NaCl
+
KOH
+
H2SO4
H2O
=
K2SO4
+
2
2
Ca(OH)2
+
HCl
H2O
=
CaCl2
+
2
2
酸
碱
水
盐
+
=
+
一、酸碱反应
酸跟碱作用生成盐和水的反应叫酸碱反应。
1.定义
视频
读下图,用你自己的话,概括一下酸与碱之间反应的实质。
酸中的氢离子跟碱中的氢氧根离子结合生成水。
OH_
+
H+
H2O
=
2.实质
二、酸碱反应的应用
1.农业上用施加熟石灰[主要含Ca(OH)2]的方法来降低土壤的酸性。
2.用碱处理酸性的工业废水
3.精制石油时,用氢氧化钠来中和过量的酸。
你能例举生活中酸碱反应的应用吗?
4.用氢氧化铝来中和胃中过量的酸。
Al(OH)3
+
HCl
H2O
=
AlCl3
+
3
3
胃乐说明书
[药品名称] 胃乐胶囊
[性状] 本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦
[主要成分] 氢氧化铝[Al(OH)3]、甘草提取物、白芨、木香等
[药理作用] 中和胃酸过多、抗溃疡、镇痛、抗炎
[功能与主治] 用于慢性胃炎胃酸和多酸胃痛。行气止痛,收敛生肌,
促进溃疡愈合。
[用法与用量] 口服,一次2~3粒,一日3次,空腹服用
[规格] 0.4g/粒
[贮藏] 密封,置干燥阴凉处
[包装] 20粒/盒
[有效期] 两年
1.为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法可消除肿痛?
【查阅资料】蚊虫叮咬时能在人的皮肤内分泌蚁酸刺激皮肤,蚁酸是一种有机酸,名称叫做甲酸,化学式为HCOOH
可涂抹一些含有弱碱性物质的药水。如:氨水(NH3·H2O)、肥皂水。
2.被蜜蜂这蛰后,用肥皂水或氨水清洗;被马蜂蛰后,用食醋止痛止痒;你知道这是为什么?
蜜蜂毒液显 性,马蜂毒液显 性。
碱
酸
三、土壤酸碱性测定
【实验目标】
1.初步学会土壤取样测试的方法。
2.学会用 pH 试纸测定土壤酸碱度。
3.了解保护土壤资源的重要性,提出改良土壤酸碱性的建
议。
【实验器材】
木棍,废报纸,玻璃棒,试管,蒸馏水,pH试纸(精密pH试纸及比色卡),窗纱(或金属筛),布袋。
【实验过程】
一、土壤取样方法
二、待测液的准备
三、pH试纸测试操作方法
【实验讨论】
1.当地作物地土壤酸碱性如何?是否适宜这类植物的生长。
2.提出改良当地土壤酸碱性的建议。
【实验过程】
一、土壤取样方法
二、待测液的准备
一、酸碱反应
酸跟碱作用生成盐和水的反应叫酸碱反应。
OH_
+
H+
H2O
=
实质:
二、酸碱反应的应用
1. 改善土壤的酸性。
2. 处理工业废水
3. 精制石油时,中和过量的酸。
三、土壤酸碱性测定
1. 土壤取样方法
2. 待测液的准备
3. pH试纸测试操作方法
小结
1. 将一定量的某盐酸加水充分稀释,所得溶液的 pH( )
A. 一定等于 7 B. 一定大于 7
C. 一定小于 7 D. 一定等于 0
C
2. 一些国家正在试用碳酸水浇灌某些植物,其作用是( )
A. 调节土壤的 pH,改良酸性土壤
B. 调节土壤的 pH,改良碱性土壤
C. 促进植物的光合作用
D. 在植物上方形成温室
C
B
3.一般中和酸性土壤用_______ 其化学式为__________
熟石灰
Ca(OH)2
4. 下列说法正确的是-----------------------( )
A、能电离出OH-的化合物不一定是碱
B、紫色石蕊试液能使酸溶液变红
C、pH值大于7的一定是碱溶液
D、生成盐和水的反应都是酸碱反应
A
5.实验室中有两瓶没有标签的无色溶液,已知
其中一瓶是盐酸溶液,另一瓶是氢氧化钠溶液,
你能用哪些方法将两者区分开来?
1).运用酸碱指示剂、pH试纸、pH计检测。
2).利用碳酸钠、碳酸钙与盐酸溶液反应产生气体检测。
3).利用氯化铁、氯化铜与氢氧化钠溶液反应产生沉淀。
4).通过加热蒸发办法,观察有无晶体剩余来检测。
6.完全中和25克氢氧化钠溶液,用去了质量分数为20%的稀硫酸24.5克,求氢氧化钠的溶液的质量分数。
解:
设:氢氧化钠的溶液的质量分数为x%
NaOH
+
H2SO4
H2O
=
Na2SO4
+
2
2
98
80
24.5克
20%
×
25克
×
x%
98
80
=
24.5克
20%
×
25克
×
x%
x%
=
16%
答:氢氧化钠的溶液的质量分数为16%
End
Thank
you
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
