氯气的性质与制取[下学期]
文档属性
| 名称 | 氯气的性质与制取[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 643.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-07-02 11:02:00 | ||
图片预览



文档简介
课件11张PPT。第四章 卤素 卤族化学元素:氟、氯、溴、碘、砹第一节 氯气 Cl218世纪70年代,瑞典化学家 舍勒 首先并发现并制得了氯气。一、Cl2的实验室制法氯气是一种有毒的,密度比空气大的气体。它能溶于水,可使湿润的蓝色石蕊试纸变红,并能与NaOH溶液反应。
实验室制取氯气的反应方程式:
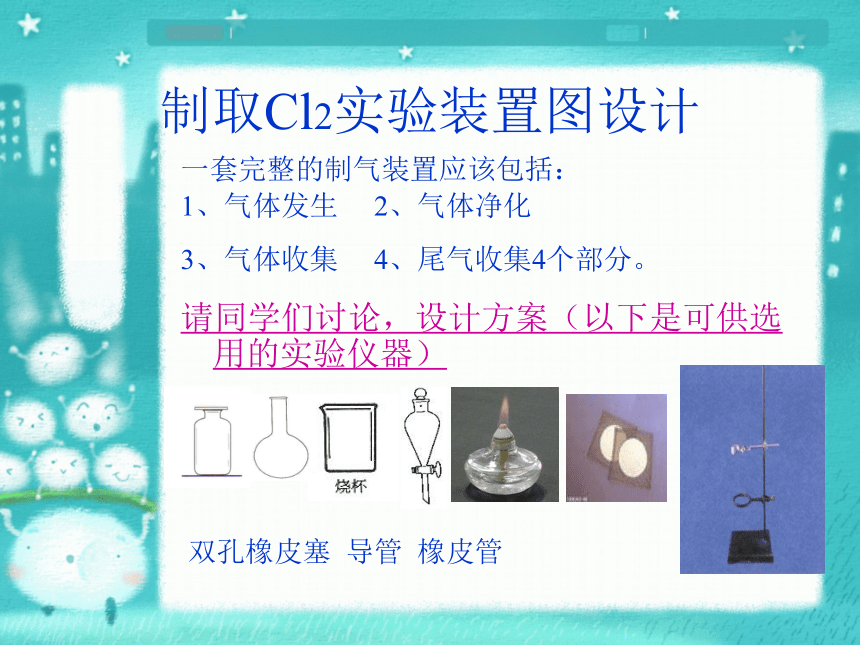
4HCl(浓)+MnO2(固)=MnCl2+Cl2↑+H2O制取Cl2实验装置图设计一套完整的制气装置应该包括:
1、气体发生 2、气体净化
3、气体收集 4、尾气收集4个部分。
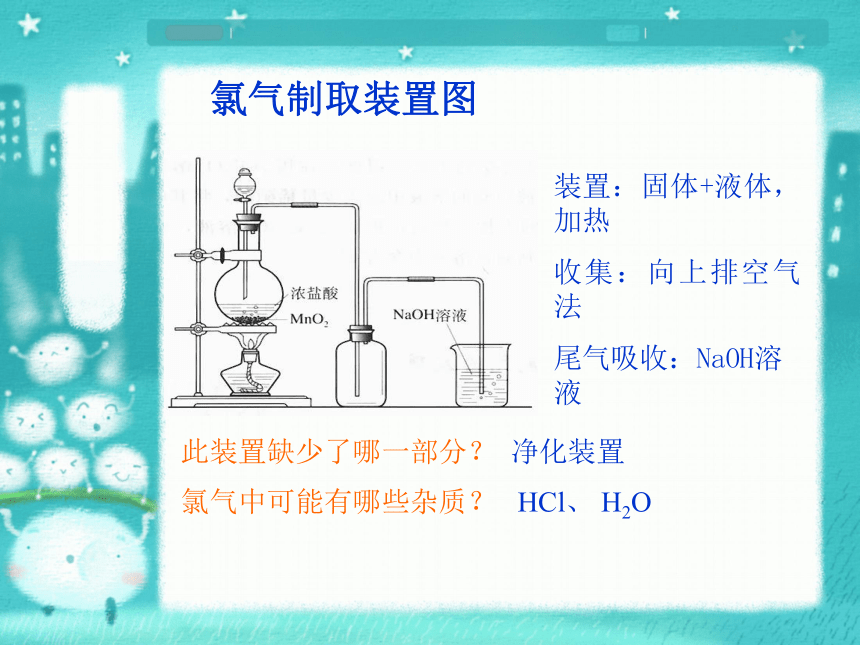
请同学们讨论,设计方案(以下是可供选用的实验仪器)双孔橡皮塞 导管 橡皮管 氯气制取装置图装置:固体+液体,加热
收集:向上排空气法
尾气吸收:NaOH溶液 此装置缺少了哪一部分?净化装置氯气中可能有哪些杂质?HCl、 H2O二、氯气的化学性质 1)Cl2与H2O的反应 (实验)Cl2使湿润的有色布条褪色
干布条不褪色,湿布条褪色 Cl2会和水反应生成具有漂白作用的新物质
现象:结论:Cl2+H2O? HCl+HClO+1价 具有漂白作用HClO次氯酸不稳定,见光易分解放出氧气2HClO 2HCl+O2↑ 光照思考:
1)氯水为何要现用现制?
2)如何来保存氯水? 2)Cl2与碱的反应 Cl2可以与NaOH溶液充分反应,可生成溶于水的NaCl和NaClO反应方程式:Cl2+2NaOH→NaCl+NaClO+H2O工业上生产漂粉精的原理:是通过Cl2与石灰乳作用制成的 Cl2+2Ca(OH)2→CaCl2+ Ca(ClO)2+ H2O 漂粉精有效成份思考:为什么工业上不直接用次氯酸漂白? 次氯酸钙具有漂白作用,但是见光易分解,不容易保存,但是转换成了次氯酸盐就要稳定许多。漂白粉漂白的原理是:
Ca(ClO)2+CO2+H2O→CaCO3↓+ HClO反应能进行的原因是什么?酸性比较:
H2CO3> HClO 强酸可以制弱酸 本节课总结:我们学习了氯气的实验室制法,氯气和水、碱的反应课后思考题1)制得的氯气中含有HCl和H2O等杂质,应该如何除去?其中的原理是什么?
2)氯气与水的反应是可逆反应,那么新制的氯水中含有那些微粒?
3)用湿润蓝色石蕊试纸检验氯气时,请预计以下实验现象,其中的化学原理是什么? 再见!
实验室制取氯气的反应方程式:
4HCl(浓)+MnO2(固)=MnCl2+Cl2↑+H2O制取Cl2实验装置图设计一套完整的制气装置应该包括:
1、气体发生 2、气体净化
3、气体收集 4、尾气收集4个部分。
请同学们讨论,设计方案(以下是可供选用的实验仪器)双孔橡皮塞 导管 橡皮管 氯气制取装置图装置:固体+液体,加热
收集:向上排空气法
尾气吸收:NaOH溶液 此装置缺少了哪一部分?净化装置氯气中可能有哪些杂质?HCl、 H2O二、氯气的化学性质 1)Cl2与H2O的反应 (实验)Cl2使湿润的有色布条褪色
干布条不褪色,湿布条褪色 Cl2会和水反应生成具有漂白作用的新物质
现象:结论:Cl2+H2O? HCl+HClO+1价 具有漂白作用HClO次氯酸不稳定,见光易分解放出氧气2HClO 2HCl+O2↑ 光照思考:
1)氯水为何要现用现制?
2)如何来保存氯水? 2)Cl2与碱的反应 Cl2可以与NaOH溶液充分反应,可生成溶于水的NaCl和NaClO反应方程式:Cl2+2NaOH→NaCl+NaClO+H2O工业上生产漂粉精的原理:是通过Cl2与石灰乳作用制成的 Cl2+2Ca(OH)2→CaCl2+ Ca(ClO)2+ H2O 漂粉精有效成份思考:为什么工业上不直接用次氯酸漂白? 次氯酸钙具有漂白作用,但是见光易分解,不容易保存,但是转换成了次氯酸盐就要稳定许多。漂白粉漂白的原理是:
Ca(ClO)2+CO2+H2O→CaCO3↓+ HClO反应能进行的原因是什么?酸性比较:
H2CO3> HClO 强酸可以制弱酸 本节课总结:我们学习了氯气的实验室制法,氯气和水、碱的反应课后思考题1)制得的氯气中含有HCl和H2O等杂质,应该如何除去?其中的原理是什么?
2)氯气与水的反应是可逆反应,那么新制的氯水中含有那些微粒?
3)用湿润蓝色石蕊试纸检验氯气时,请预计以下实验现象,其中的化学原理是什么? 再见!
