第三节氨与铵盐[上学期]
文档属性
| 名称 | 第三节氨与铵盐[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 242.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-11-07 00:00:00 | ||
图片预览





文档简介
课件19张PPT。第三节 氨 铵盐柳市中学高一化学组制作教学目标:1、回忆复习NH3分子的结构(电子式、结构式和分子的极性)
2、掌握NH3的物理性质
3、掌握NH3的化学性质
4、学会NH3的实验室制法
5、了解NH3的用途一、氨回忆复习:
写出N2与H2化合生成NH3的化学方程式并写出NH3分子的电子式。
NH3分子的构形
NH3分子的极性
由极性键构成的极性分子1、 NH3物理性质颜色、状态、气味:
密度:
熔点:无色、有刺激性气味的气体0.771 g/L (比空气轻)-33.5℃ (易液化)2、 NH3的化学性质2、 NH3的化学性质(1) NH3与水的反应
讨论:
1、你看到什么现象?
2、为什么会产生这种现象?
3、这个实验说明NH3具有哪些性质?
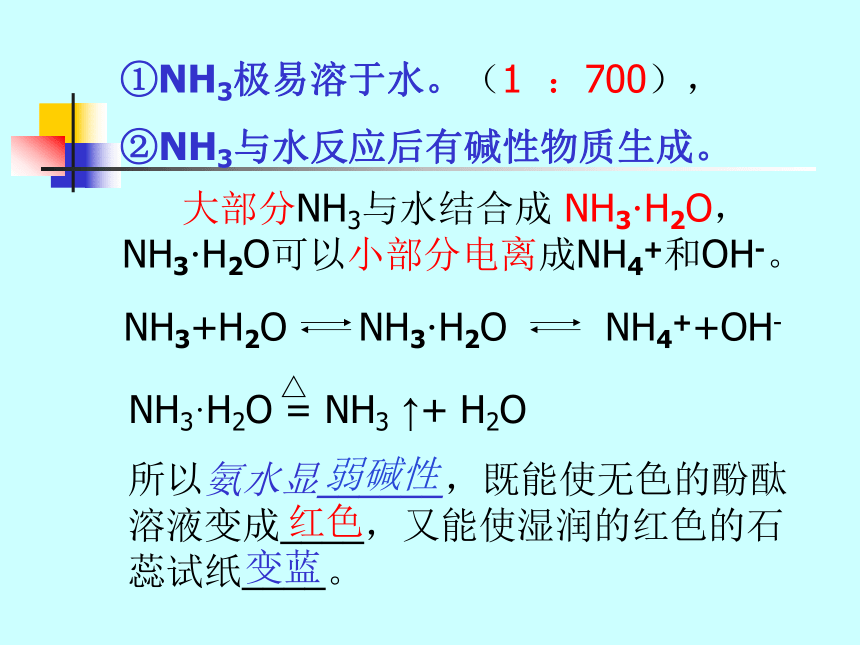
①NH3极易溶于水。(1 :700),
所以氨水显______,既能使无色的酚酞溶液变成____,又能使湿润的红色的石蕊试纸____。
②NH3与水反应后有碱性物质生成。 大部分NH3与水结合成 NH3·H2O,
NH3·H2O可以小部分电离成NH4+和OH-。红色变蓝弱碱性氨水中的分子有:H2O、NH3 和 NH3·H2O
氨水中的离子有:NH4+、H+ 和 OH-
液氨 是氨气加压或降温后形成的液态物质,
液氨所含的微粒是NH3。所以:氨水是混合物。所以:液氨是纯净物。 讨论:
氨水的主要成份有哪些?
氨水与液态氨有何区别?(2) NH3与酸反应生成铵盐
NH3与盐酸的反应:
NH3 + HCl = NH4Cl
(2) NH3与酸反应生成铵盐
NH3与盐酸的反应:
NH3是一种碱性气体练习:NH3 与H2SO4 及稀HNO3的
化学反应方程式。
2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3(3) NH3与氧气的反应:
讨论:已知NH3能将黑色的CuO还原为
红色的Cu,请写出此反应的化学方程式:NH3是一种还原性气体讨论:
①少量的 NH3 与足量的 Cl2 反应的产物是什么?请写出该化学反应的方程式。
②过量的NH3与少量的Cl2反应的产物又是什么?请写出该化学反应的方程式。2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3)8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)3、NH3的实验室制法原理:加热铵盐与碱的固体混合物
如:将固体NH4Cl与Ca(OH)2混合加热,即得到NH3讨论:
NH3如何收集?
如何检验NH3已经收满?剩余的NH3如何处理?
若要制备干燥的NH3 ,可用什么作干燥剂?
3、NH3的实验室制法4.NH3的用途是一种重要的化工产品,如:生产氮肥、制铵盐、纯碱等。
用于有机合成工业,如:合成纤维、塑料、染料、尿素等。
作为冷冻机和制冰机中的致冷剂。本节课小结:复习NH3的结构NH3的物理性质NH3的化学性质碱性气体还原性气体NH3的实验室制法:加热铵盐与碱的混合物NH3的用途同学们再见!高邮市第一中学
高一年级化学组多媒体课件
制作人:李永松
2001年4月28日
2、掌握NH3的物理性质
3、掌握NH3的化学性质
4、学会NH3的实验室制法
5、了解NH3的用途一、氨回忆复习:
写出N2与H2化合生成NH3的化学方程式并写出NH3分子的电子式。
NH3分子的构形
NH3分子的极性
由极性键构成的极性分子1、 NH3物理性质颜色、状态、气味:
密度:
熔点:无色、有刺激性气味的气体0.771 g/L (比空气轻)-33.5℃ (易液化)2、 NH3的化学性质2、 NH3的化学性质(1) NH3与水的反应
讨论:
1、你看到什么现象?
2、为什么会产生这种现象?
3、这个实验说明NH3具有哪些性质?
①NH3极易溶于水。(1 :700),
所以氨水显______,既能使无色的酚酞溶液变成____,又能使湿润的红色的石蕊试纸____。
②NH3与水反应后有碱性物质生成。 大部分NH3与水结合成 NH3·H2O,
NH3·H2O可以小部分电离成NH4+和OH-。红色变蓝弱碱性氨水中的分子有:H2O、NH3 和 NH3·H2O
氨水中的离子有:NH4+、H+ 和 OH-
液氨 是氨气加压或降温后形成的液态物质,
液氨所含的微粒是NH3。所以:氨水是混合物。所以:液氨是纯净物。 讨论:
氨水的主要成份有哪些?
氨水与液态氨有何区别?(2) NH3与酸反应生成铵盐
NH3与盐酸的反应:
NH3 + HCl = NH4Cl
(2) NH3与酸反应生成铵盐
NH3与盐酸的反应:
NH3是一种碱性气体练习:NH3 与H2SO4 及稀HNO3的
化学反应方程式。
2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3(3) NH3与氧气的反应:
讨论:已知NH3能将黑色的CuO还原为
红色的Cu,请写出此反应的化学方程式:NH3是一种还原性气体讨论:
①少量的 NH3 与足量的 Cl2 反应的产物是什么?请写出该化学反应的方程式。
②过量的NH3与少量的Cl2反应的产物又是什么?请写出该化学反应的方程式。2NH3 + 3Cl2 = N2 + 6HCl (少量的NH3)8NH3 +3Cl2 = N2 + 6NH4Cl(过量的NH3)3、NH3的实验室制法原理:加热铵盐与碱的固体混合物
如:将固体NH4Cl与Ca(OH)2混合加热,即得到NH3讨论:
NH3如何收集?
如何检验NH3已经收满?剩余的NH3如何处理?
若要制备干燥的NH3 ,可用什么作干燥剂?
3、NH3的实验室制法4.NH3的用途是一种重要的化工产品,如:生产氮肥、制铵盐、纯碱等。
用于有机合成工业,如:合成纤维、塑料、染料、尿素等。
作为冷冻机和制冰机中的致冷剂。本节课小结:复习NH3的结构NH3的物理性质NH3的化学性质碱性气体还原性气体NH3的实验室制法:加热铵盐与碱的混合物NH3的用途同学们再见!高邮市第一中学
高一年级化学组多媒体课件
制作人:李永松
2001年4月28日
