硝酸[上学期]
图片预览




文档简介
课件14张PPT。硝 酸一 硝酸的物理性质 纯硝酸是无色、易挥发、有刺激性气味 的液体。
硝酸能以任意比溶解于水。
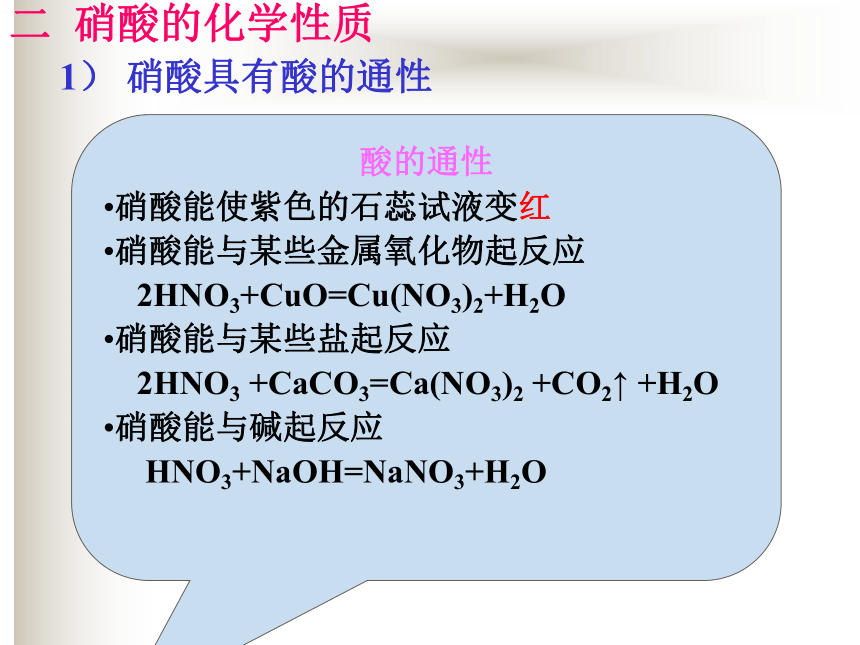
质量分数为69%的硝酸为浓硝酸; 质量分数为98%以上的硝酸为发烟硝酸。二 硝酸的化学性质1) 硝酸具有酸的通性 酸有那些通性?酸的通性
硝酸能使紫色的石蕊试液变红
硝酸能与某些金属氧化物起反应
2HNO3+CuO=Cu(NO3)2+H2O
硝酸能与某些盐起反应
2HNO3 +CaCO3=Ca(NO3)2 +CO2↑ +H2O
硝酸能与碱起反应
HNO3+NaOH=NaNO3+H2O
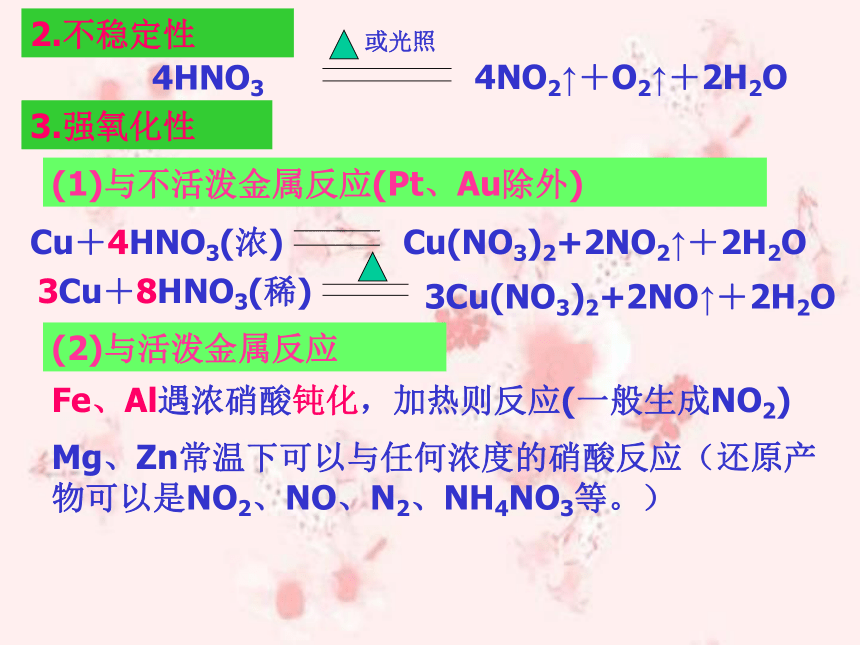
2.不稳定性3.强氧化性(1)与不活泼金属反应(Pt、Au除外)Cu(NO3)2+2NO2↑+2H2O(2)与活泼金属反应Fe、Al遇浓硝酸钝化,加热则反应(一般生成NO2)Mg、Zn常温下可以与任何浓度的硝酸反应(还原产物可以是NO2、NO、N2、NH4NO3等。)(3)硝酸氧化非金属:C+4HNO3=CO2 ↑+4NO2↑+2H2O
S+6HNO3=H2SO4+6NO2↑+2H2O(4)硝酸氧化还原性微粒:如S2-、H2S、I-、HI、SO32-、Fe2-等。
(5)氧化性:浓硝酸>稀硝酸
(6)足量金属与浓硝酸反应产生NO2、NO混合气体
(7)王水:浓硝酸与浓盐酸1∶3的混合物。4、NO3—的检验:
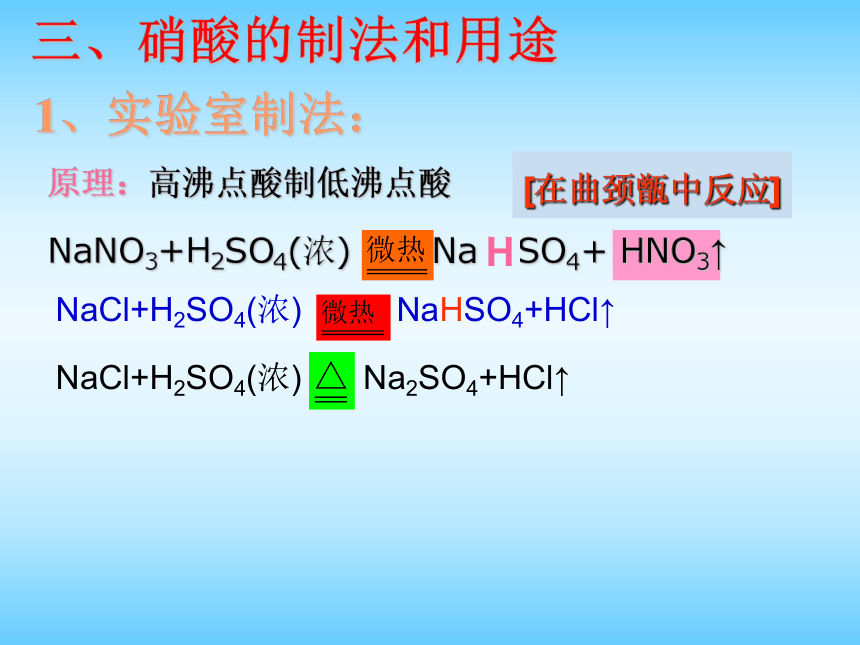
未知物 产生红棕色气体 有NO3-NaNO3+H2SO4(浓) Na H SO4+ HNO3↑三、硝酸的制法和用途1、实验室制法: [在曲颈甑中反应] NaCl+H2SO4(浓) Na2SO4+HCl↑NaCl+H2SO4(浓) NaHSO4+HCl↑H原理:高沸点酸制低沸点酸2、工业制法:氨的催化氧化法2NO+O2==2NO23NO2+H2O==2HNO3+NO3、用途◆重要的化工原料,制炸药、染料、塑料、硝酸盐等等◆鉴别真金假金◆实验室里的重要化学试剂1、98%以上的浓硝酸又称为“发烟”硝酸,是真正的烟吗?为什么有“发烟”现象?2、常用的浓硝酸质量分数为69.2%,密度为1.42克/厘米3,求物质的量浓度。思考1、工业盐酸也发黄,原因是什么?2、如何保存浓硝酸?棕色瓶(玻璃或塑料塞)置于冷暗处3、已知反应4NO2+O2+2H2O=4HNO3, 这个反应和硝酸分解反应是可逆反应吗?不是可逆反应,反应条件不同4、如何除去久置浓硝酸中的黄色?加水或通氧气思考含铁离子思考1、硝酸和铜反应,体现了硝酸的什么性质?强氧化性和酸性2、硝酸氧化铜,是氢离子体现氧化性,还是硝酸根离子体现氧化性?硝酸根离子3、氧化等物质的量的铜,消耗的浓稀硝酸哪个多?其中做酸的浓稀硝酸比值是多少?做氧化剂的浓稀硝酸比值是多少?浓硝酸多、1:1、3:14、1摩尔浓硝酸完全作氧化剂得1摩尔电子,
1摩尔稀硝酸完全作氧化剂得3摩尔电子,
能否说稀硝酸的氧化性比浓硝酸强?氧化性强弱不是指得电子的数目,而是指得电子的能力思考5、 Amol铜和一定量的浓硝酸反应,已知两者反应完全,得到气体Bmol,问(1)生成什么气体?
(2)浓硝酸中含硝酸的物质的量是多少?NO和NO2、(2A+B)mol1、硝酸氧化金属一般不产生氢气,一般浓硝酸的还原产 物是NO2,稀硝酸的还原产物为NO(在某些条件下, 硝酸的还原产物也可是N2O或NH4NO3等氮的化合物)2、硝酸几乎能与所有的金属(除金、铂等)发生氧化还原反应。3、铁和铝在冷的、浓的硝酸中会发生钝化现象5、硝酸有强氧化性,对皮肤衣物纸张等都有腐蚀作用, 所以使用浓硝酸时,一定要格外小心,万一弄到皮 肤 上,立即用大量的水冲洗,再用小苏打或肥皂洗涤。4、硝酸中滴加石蕊,溶液变红,加热褪色注意:
硝酸能以任意比溶解于水。
质量分数为69%的硝酸为浓硝酸; 质量分数为98%以上的硝酸为发烟硝酸。二 硝酸的化学性质1) 硝酸具有酸的通性 酸有那些通性?酸的通性
硝酸能使紫色的石蕊试液变红
硝酸能与某些金属氧化物起反应
2HNO3+CuO=Cu(NO3)2+H2O
硝酸能与某些盐起反应
2HNO3 +CaCO3=Ca(NO3)2 +CO2↑ +H2O
硝酸能与碱起反应
HNO3+NaOH=NaNO3+H2O
2.不稳定性3.强氧化性(1)与不活泼金属反应(Pt、Au除外)Cu(NO3)2+2NO2↑+2H2O(2)与活泼金属反应Fe、Al遇浓硝酸钝化,加热则反应(一般生成NO2)Mg、Zn常温下可以与任何浓度的硝酸反应(还原产物可以是NO2、NO、N2、NH4NO3等。)(3)硝酸氧化非金属:C+4HNO3=CO2 ↑+4NO2↑+2H2O
S+6HNO3=H2SO4+6NO2↑+2H2O(4)硝酸氧化还原性微粒:如S2-、H2S、I-、HI、SO32-、Fe2-等。
(5)氧化性:浓硝酸>稀硝酸
(6)足量金属与浓硝酸反应产生NO2、NO混合气体
(7)王水:浓硝酸与浓盐酸1∶3的混合物。4、NO3—的检验:
未知物 产生红棕色气体 有NO3-NaNO3+H2SO4(浓) Na H SO4+ HNO3↑三、硝酸的制法和用途1、实验室制法: [在曲颈甑中反应] NaCl+H2SO4(浓) Na2SO4+HCl↑NaCl+H2SO4(浓) NaHSO4+HCl↑H原理:高沸点酸制低沸点酸2、工业制法:氨的催化氧化法2NO+O2==2NO23NO2+H2O==2HNO3+NO3、用途◆重要的化工原料,制炸药、染料、塑料、硝酸盐等等◆鉴别真金假金◆实验室里的重要化学试剂1、98%以上的浓硝酸又称为“发烟”硝酸,是真正的烟吗?为什么有“发烟”现象?2、常用的浓硝酸质量分数为69.2%,密度为1.42克/厘米3,求物质的量浓度。思考1、工业盐酸也发黄,原因是什么?2、如何保存浓硝酸?棕色瓶(玻璃或塑料塞)置于冷暗处3、已知反应4NO2+O2+2H2O=4HNO3, 这个反应和硝酸分解反应是可逆反应吗?不是可逆反应,反应条件不同4、如何除去久置浓硝酸中的黄色?加水或通氧气思考含铁离子思考1、硝酸和铜反应,体现了硝酸的什么性质?强氧化性和酸性2、硝酸氧化铜,是氢离子体现氧化性,还是硝酸根离子体现氧化性?硝酸根离子3、氧化等物质的量的铜,消耗的浓稀硝酸哪个多?其中做酸的浓稀硝酸比值是多少?做氧化剂的浓稀硝酸比值是多少?浓硝酸多、1:1、3:14、1摩尔浓硝酸完全作氧化剂得1摩尔电子,
1摩尔稀硝酸完全作氧化剂得3摩尔电子,
能否说稀硝酸的氧化性比浓硝酸强?氧化性强弱不是指得电子的数目,而是指得电子的能力思考5、 Amol铜和一定量的浓硝酸反应,已知两者反应完全,得到气体Bmol,问(1)生成什么气体?
(2)浓硝酸中含硝酸的物质的量是多少?NO和NO2、(2A+B)mol1、硝酸氧化金属一般不产生氢气,一般浓硝酸的还原产 物是NO2,稀硝酸的还原产物为NO(在某些条件下, 硝酸的还原产物也可是N2O或NH4NO3等氮的化合物)2、硝酸几乎能与所有的金属(除金、铂等)发生氧化还原反应。3、铁和铝在冷的、浓的硝酸中会发生钝化现象5、硝酸有强氧化性,对皮肤衣物纸张等都有腐蚀作用, 所以使用浓硝酸时,一定要格外小心,万一弄到皮 肤 上,立即用大量的水冲洗,再用小苏打或肥皂洗涤。4、硝酸中滴加石蕊,溶液变红,加热褪色注意:
