化学反应速率[上学期]
图片预览






文档简介
课件23张PPT。2.1化学反应速率
天啊!呛死我了!
受不了
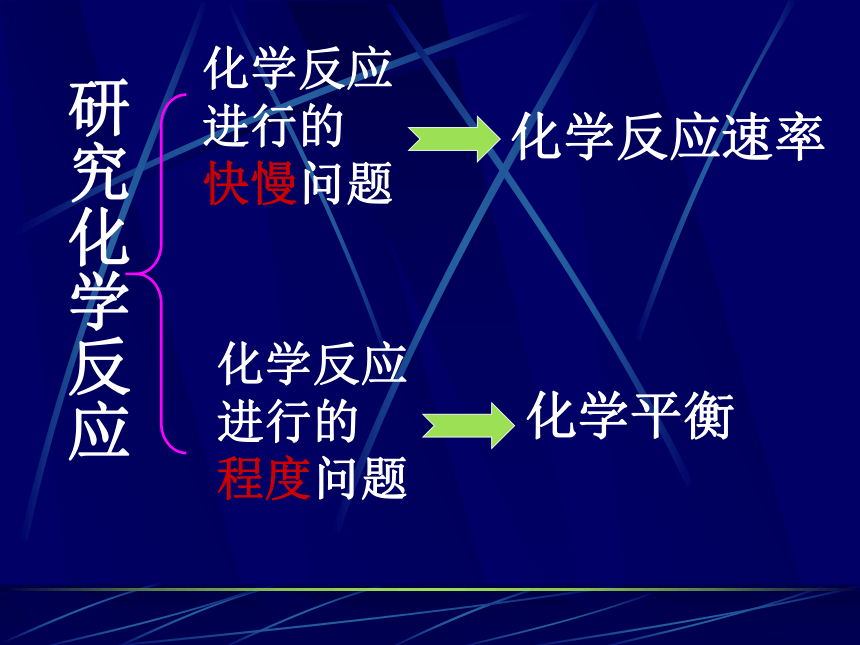
了……?研究化学反应化学反应
进行的
快慢问题化学反应
进行的
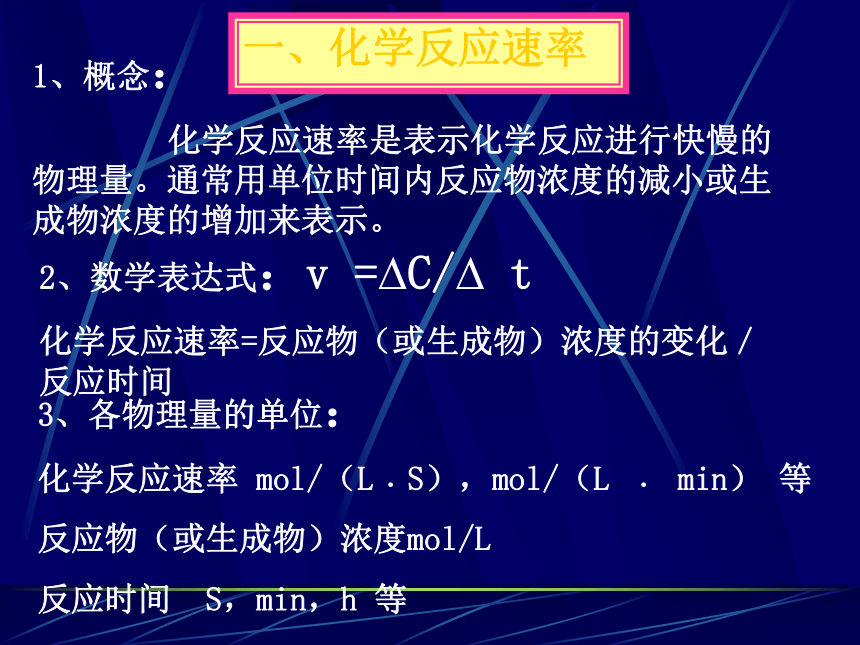
程度问题化学反应速率化学平衡摄于1908年——几百年了我神态安详摄于1968年——这几十年我一下老了?1、概念:
化学反应速率是表示化学反应进行快慢的物理量。通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示。2、数学表达式:v =?C/? t
化学反应速率=反应物(或生成物)浓度的变化/反应时间3、各物理量的单位:
化学反应速率 mol/(L﹒S),mol/(L ﹒ min) 等
反应物(或生成物)浓度mol/L
反应时间 S,min,h 等一、化学反应速率 在体积为2L的密闭容器中充入2mol的氮气与8mol氢气,一定条件下发生反应。5min后,测得容器内生成的氨气的浓度为1mol/L,求:
①分别用H2 、 N2 、 NH3的浓度变化表示的反应速率
②以上三者数值是否相等?是否矛盾?数值大小有何关系?有何规律?
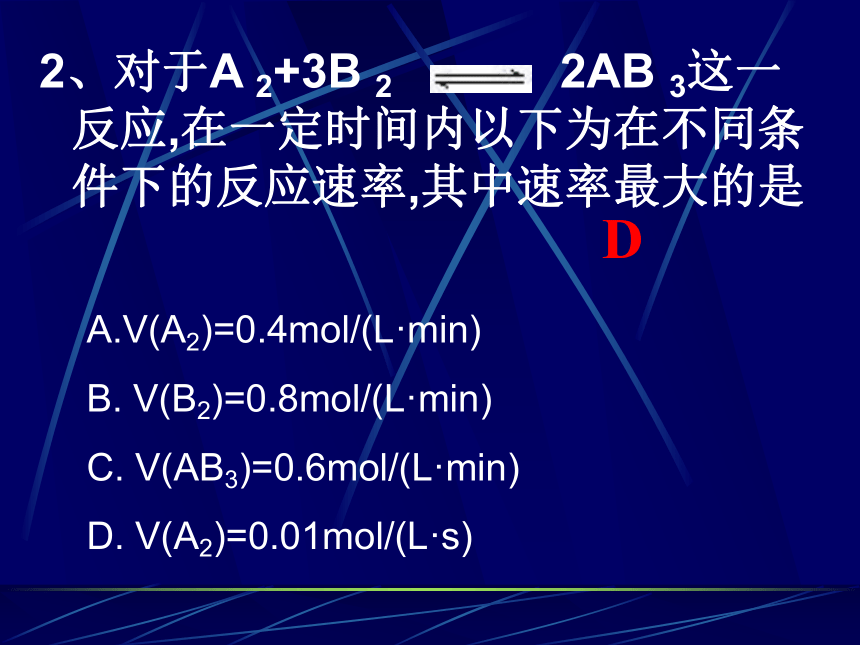
③计算所得速率数值是平均速率还是瞬时速率?讨论V(H2)=0.3mol/(L.min) V(N2)=0.1mol/(L.min ) V(NH3)=0.2mol/(L.min)2、对于A 2+3B 2 2AB 3这一反应,在一定时间内以下为在不同条件下的反应速率,其中速率最大的是 DA.V(A2)=0.4mol/(L·min)
B. V(B2)=0.8mol/(L·min)
C. V(AB3)=0.6mol/(L·min)
D. V(A2)=0.01mol/(L·s)
[讨论1] 影响化学反应速率的条件有哪些? 要求:小组讨论,举例说明 为什么反应物浓度不同,化学反应速率不同?试从微观角度解释浓度对化学反应速率的影响。阅读课本P34-36页,回答以下几个问题:
1.化学反应的实质是什么?
2.反应物之间的碰撞,是否一定发生化学反应?
3.什么是有效碰撞?
4.什么是活化分子?活化分子百分数?[巩固练习] 判断题a.有效碰撞是指反应物分子间的碰撞。
b.有效碰撞是指反应物分子中活化分子间的碰撞。
c.有效碰撞是指能发生化学反应的碰撞。
d.有效碰撞是指活化分子间有合适取向的碰撞。同学们觉得活化分子、有效碰撞
之间有什么联系?××√√化学反应的发生是由于发生了有效碰撞,
发生有效碰撞的必须是活化分子,但活化分子之间的碰撞却不一定都是有效碰撞。分子运动相互碰撞分子具有足够的能量活化分子有 合 适 的 取 向有效碰撞发生化学反应化学反应发生的条件[情境回归]1mol/L盐酸 10mL0.1mol/L盐酸 10mL比较:①活化分子总数
②单位体积内活化分子数
③单位体积内有效碰撞次数
④化学反应速率
0.1mol/L盐酸 200mL从微观角度分析,为什么浓度增加,化学反应速率加快?思考 压强对化学反应速率的影响AB[讨论2] 对于任意一个反应,改变压强是不是一定会引起化学反应速率的改变?牛奶盐水鸭温度对化学反应速率的影响升高温度活化分子的百分比增大有效碰撞次数增多反应速率加快单位体积内活化分子数增多使用催化剂降低反应所需的能量活化分子的百分比增大单位体积活化分子的数目增多有效碰撞次数增多化学反应速率加快催化剂对化学反应速率的影响反应物颗粒大小、光、超声波、电磁波、激光、放射线、溶剂的性质等,也会对化学反应速率产生影响。其他因素对化学反应速率的影响祝大家学习进步!
受不了
了……?研究化学反应化学反应
进行的
快慢问题化学反应
进行的
程度问题化学反应速率化学平衡摄于1908年——几百年了我神态安详摄于1968年——这几十年我一下老了?1、概念:
化学反应速率是表示化学反应进行快慢的物理量。通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示。2、数学表达式:v =?C/? t
化学反应速率=反应物(或生成物)浓度的变化/反应时间3、各物理量的单位:
化学反应速率 mol/(L﹒S),mol/(L ﹒ min) 等
反应物(或生成物)浓度mol/L
反应时间 S,min,h 等一、化学反应速率 在体积为2L的密闭容器中充入2mol的氮气与8mol氢气,一定条件下发生反应。5min后,测得容器内生成的氨气的浓度为1mol/L,求:
①分别用H2 、 N2 、 NH3的浓度变化表示的反应速率
②以上三者数值是否相等?是否矛盾?数值大小有何关系?有何规律?
③计算所得速率数值是平均速率还是瞬时速率?讨论V(H2)=0.3mol/(L.min) V(N2)=0.1mol/(L.min ) V(NH3)=0.2mol/(L.min)2、对于A 2+3B 2 2AB 3这一反应,在一定时间内以下为在不同条件下的反应速率,其中速率最大的是 DA.V(A2)=0.4mol/(L·min)
B. V(B2)=0.8mol/(L·min)
C. V(AB3)=0.6mol/(L·min)
D. V(A2)=0.01mol/(L·s)
[讨论1] 影响化学反应速率的条件有哪些? 要求:小组讨论,举例说明 为什么反应物浓度不同,化学反应速率不同?试从微观角度解释浓度对化学反应速率的影响。阅读课本P34-36页,回答以下几个问题:
1.化学反应的实质是什么?
2.反应物之间的碰撞,是否一定发生化学反应?
3.什么是有效碰撞?
4.什么是活化分子?活化分子百分数?[巩固练习] 判断题a.有效碰撞是指反应物分子间的碰撞。
b.有效碰撞是指反应物分子中活化分子间的碰撞。
c.有效碰撞是指能发生化学反应的碰撞。
d.有效碰撞是指活化分子间有合适取向的碰撞。同学们觉得活化分子、有效碰撞
之间有什么联系?××√√化学反应的发生是由于发生了有效碰撞,
发生有效碰撞的必须是活化分子,但活化分子之间的碰撞却不一定都是有效碰撞。分子运动相互碰撞分子具有足够的能量活化分子有 合 适 的 取 向有效碰撞发生化学反应化学反应发生的条件[情境回归]1mol/L盐酸 10mL0.1mol/L盐酸 10mL比较:①活化分子总数
②单位体积内活化分子数
③单位体积内有效碰撞次数
④化学反应速率
0.1mol/L盐酸 200mL从微观角度分析,为什么浓度增加,化学反应速率加快?思考 压强对化学反应速率的影响AB[讨论2] 对于任意一个反应,改变压强是不是一定会引起化学反应速率的改变?牛奶盐水鸭温度对化学反应速率的影响升高温度活化分子的百分比增大有效碰撞次数增多反应速率加快单位体积内活化分子数增多使用催化剂降低反应所需的能量活化分子的百分比增大单位体积活化分子的数目增多有效碰撞次数增多化学反应速率加快催化剂对化学反应速率的影响反应物颗粒大小、光、超声波、电磁波、激光、放射线、溶剂的性质等,也会对化学反应速率产生影响。其他因素对化学反应速率的影响祝大家学习进步!
