第一节化学反应速率(第3课时)[上学期]
文档属性
| 名称 | 第一节化学反应速率(第3课时)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-09-20 00:00:00 | ||
图片预览

文档简介
,{孨倐Sf[蚐擽 悋s ,{3�?鰁 .�P�P�T(共6张PPT)
第二章 化学平衡
第二节 反应速率 (第3课时)
授课教师
合川中学 张荣礼
一、影响化学反应速率的条件
第一节 化学反应速率
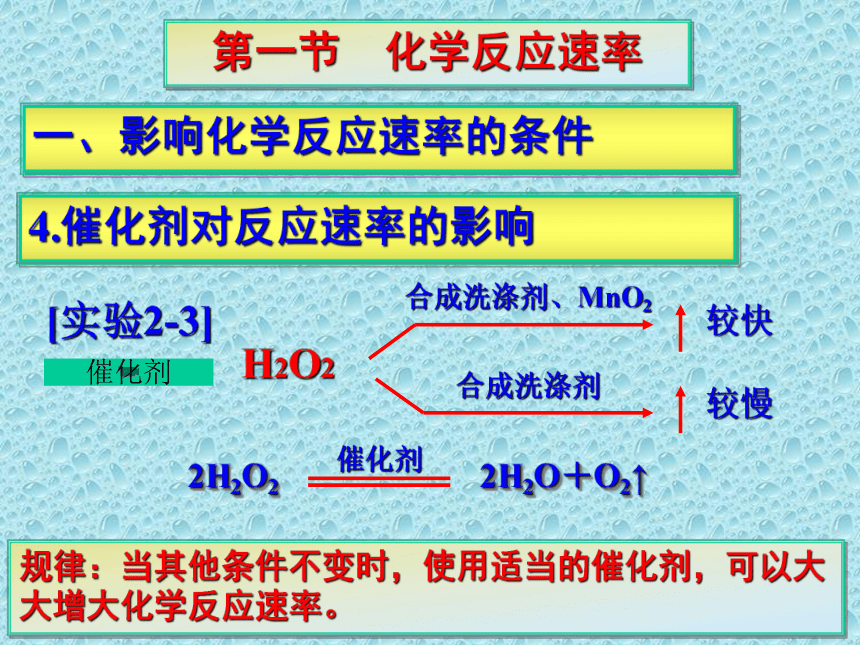
4.催化剂对反应速率的影响
[实验2-3]
H2O2
合成洗涤剂
较快
较慢
合成洗涤剂、MnO2
催化剂
规律:当其他条件不变时,使用适当的催化剂,可以大大增大化学反应速率。
2H2O2 2H2O+O2↑
催化剂
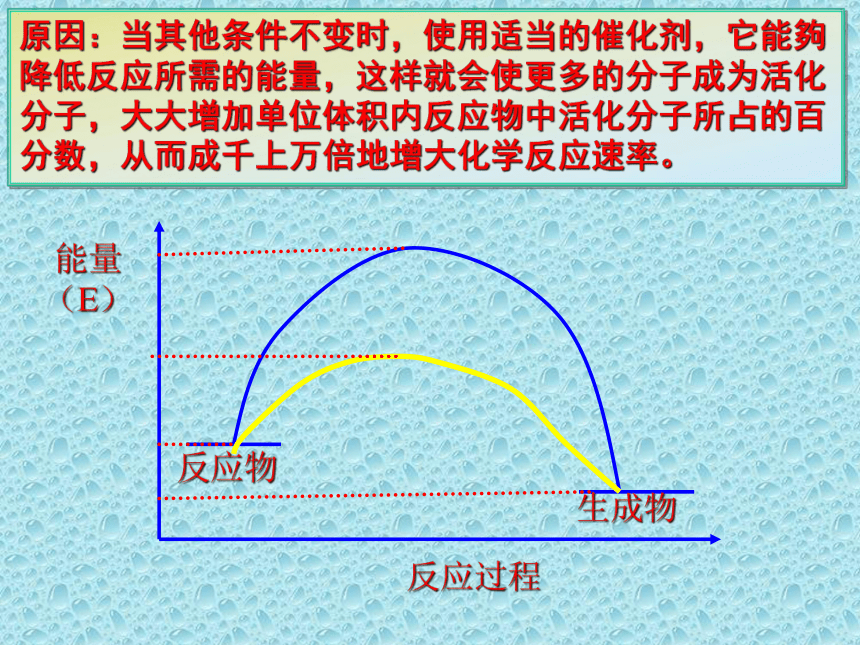
原因:当其他条件不变时,使用适当的催化剂,它能夠降低反应所需的能量,这样就会使更多的分子成为活化分子,大大增加单位体积内反应物中活化分子所占的百分数,从而成千上万倍地增大化学反应速率。
反应过程
反应物
生成物
能量(E)
思考1:催化剂在反应过程中会不会参加化学反应?
思考2:催化剂是否只能加快化学反应?
地位:化工生产中约有85%使用催化剂
使用注意:避免催化剂中中毒。
综上所述,对于同一个化学反应,条件不现时,反应速率会发生变化。浓度、压强、温度、催化剂等都能影响化学反应速率。此外,光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等,也会对化学反应速率产生影响。
规律:当其他条件不变时,固体颗粒度越小,反应速率越大。
5.固体颗粒度对反应速率的影响
S1= c㎡
S2= c㎡
6
60
1㎝
采用哪些方法可以增大Fe与盐酸反应的化学反应速率?在这些方法中,哪些是由于增加了活化分子的百分数所造成的?
讨论
第二章 化学平衡
第二节 反应速率 (第3课时)
授课教师
合川中学 张荣礼
一、影响化学反应速率的条件
第一节 化学反应速率
4.催化剂对反应速率的影响
[实验2-3]
H2O2
合成洗涤剂
较快
较慢
合成洗涤剂、MnO2
催化剂
规律:当其他条件不变时,使用适当的催化剂,可以大大增大化学反应速率。
2H2O2 2H2O+O2↑
催化剂
原因:当其他条件不变时,使用适当的催化剂,它能夠降低反应所需的能量,这样就会使更多的分子成为活化分子,大大增加单位体积内反应物中活化分子所占的百分数,从而成千上万倍地增大化学反应速率。
反应过程
反应物
生成物
能量(E)
思考1:催化剂在反应过程中会不会参加化学反应?
思考2:催化剂是否只能加快化学反应?
地位:化工生产中约有85%使用催化剂
使用注意:避免催化剂中中毒。
综上所述,对于同一个化学反应,条件不现时,反应速率会发生变化。浓度、压强、温度、催化剂等都能影响化学反应速率。此外,光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等,也会对化学反应速率产生影响。
规律:当其他条件不变时,固体颗粒度越小,反应速率越大。
5.固体颗粒度对反应速率的影响
S1= c㎡
S2= c㎡
6
60
1㎝
采用哪些方法可以增大Fe与盐酸反应的化学反应速率?在这些方法中,哪些是由于增加了活化分子的百分数所造成的?
讨论
