第一节.物质结构、元素周期律第二节.化学反应速率第三节.电解质溶液[上学期]
文档属性
| 名称 | 第一节.物质结构、元素周期律第二节.化学反应速率第三节.电解质溶液[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 39.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-21 18:02:00 | ||
图片预览










文档简介
课件35张PPT。第四章.基本理论第一节.物质结构、元素周期律
第二节.化学反应速率
第三节.电解质溶液第一节.物质结构、元素周期律
一.知识要点:(口诀)物质结构1.三种微粒六种量,两素概念算清帐;
2.一种状态二原理,一套规律要记详;
3.三键一力四数据,两种分子四晶体;
4.四种符号四图式,一定联系周期律。元素周期律1.周期表格要牢记,变化体现周期律;
2.七主七付七周期,VIII族零族镧锕系;
3.同族金增非递减,同周金减非增递;
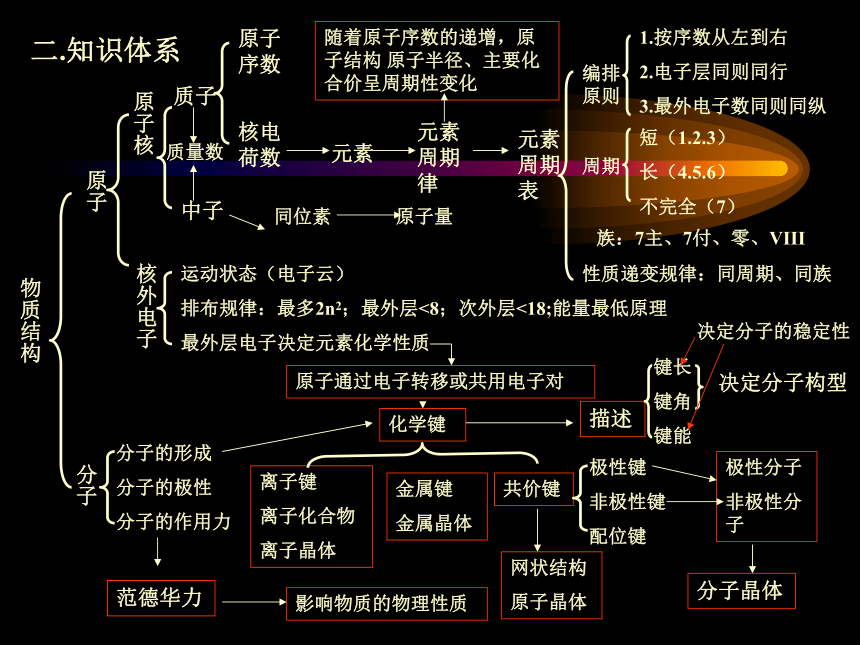
4.元素排布分四区,三角变化有联系。 二.知识体系物质结构原子原子核核外电子原子序数核电荷数元素元素周期表元素周期律编排原则1.按序数从左到右
2.电子层同则同行
3.最外电子数同则同纵周期短(1.2.3)
长(4.5.6)
不完全(7)族:7主、7付、零、VIII性质递变规律:同周期、同族质子中子随着原子序数的递增,原子结构 原子半径、主要化合价呈周期性变化质量数同位素原子量运动状态(电子云)
排布规律:最多2n2;最外层<8;次外层<18;能量最低原理
最外层电子决定元素化学性质原子通过电子转移或共用电子对化学键离子键
离子化合物
离子晶体共价键金属键
金属晶体极性键
非极性键
配位键描述键长
键角
键能决定分子构型分子分子的形成
分子的极性
分子的作用力范德华力影响物质的物理性质网状结构
原子晶体极性分子
非极性分子分子晶体三.三种微粒六种量,两素概念算清帐.
1.三种微粒 1)比较微粒 质量 相对质量 电性 意义
质子 1.6726×10-27kg 1.007 一个单位正电荷 决定元素的种类
中子 1.6743 ×10-27kg 1.008 不带电、中性 决定同位素和质量数
电子 9.1095×10-27kg 1/1836 一个单位负电荷 价电子决定元素化性原子核原子2)核组成符号 AZX质子:Z 个
中子:A-Z 个
核外电子:Z个3)两个关系式
原子序数=核电荷数=质子数=原子核外电子数 (阴、阳离子=?)
质量数(A)=质子数(Z)+中子数(N) 例1(99)“铱星”计划中的铱的一种同位素是19177Ir其核内中子数是 A. 77 B. 114 C. 191 D. 268
例2(99)已知铱有两种同位素191Ir和193Ir,而铱的平均原子量为192.22,则两种同位素的原子个数比是 A.39:61 B. 61:39 C.1:1 D.39:111.B 2.A 191x+193(1-x)=192.22 (或用十字交叉法)
例3(00)136C— NMR(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
D例4.(20g)1999年新发现114号元素的同位素,其中子数为184,该同位素的质量数是 A.70 B.114 C.228 D.298
D
例5(93s)核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量(mol) A.n(A-N+8)/(A+16) B.n(A-N+10)/(A+16) C.(A-N+2) D.n(A-N+6)/A
氧化物为RO,质子数=A-N+8;式量=A+16;选A
例6(95)178O和168O原子的核外电子数的比较 A. 大于 B.小于 C.等于 D.不能确定
C
例7(99s)12553I可治疗肿瘤,其核内中子数与核外电子数之差是
A.72 B.19 C.53 D.125B2.六种量
量 概念 意义
质子数 质子的数目 决定元素的种类和“位置”
中子数 中子的数目 决定原子的物性和质量数
电子数 电子的数目 价电子决定元素的化学性质
质量数 质子数与中子数之和 决定原子的近似原子量
元素平均原子量:A=A1?x1+ A2?x2+ A3?x3……
元素近似平均原子量:A=A’1?x1+ A’2?x2+ A’3?x3……
其中 A1 A2 A3……为各同位素的原子量
A’1 A’2 A’3……为各同位素的质量数
x1 x2 x3…… 为各同位素的丰度或摩尔分数四.一种状态二原理,一套规律要记详
1.一种状态:核外电子运动状态
1)电子云:电子在核外空间一定范围内出现,好象带负电荷的云雾笼罩原子核周围,人们形象地称它为电子云。2)电子层概念:能量高低不同和离核远近不同的空间区域
符号: K L M N O P Q
电子层数: 1 2 3 4 5 6 7
能量: 低—————————高
离核距离:近—————————远记忆2.二原理
1)最大容纳原理:每个电子层最多容纳2n2个电子。
2)能量最低原理:电子在填入电子层时,先占能量低的电子 层后占能量高的电子层。
3.一套规律要记详:核外电子排布规律
1)每个电子层最多排2n2个电子
2)最外层? 8个电子,次外层? 18个电子,倒第三层? 32
3)先占内层,后占外层
要求:主族元素和第四周期元素原子结构简图会写
方法:记住每周期希有气体的结构简图
IA IIA外延;IIIA~IIVA内推例1(96)M电子层与L电子层最多可容纳的电子数的比较 A. 大于 B.小于 C.等于 D.不能确定
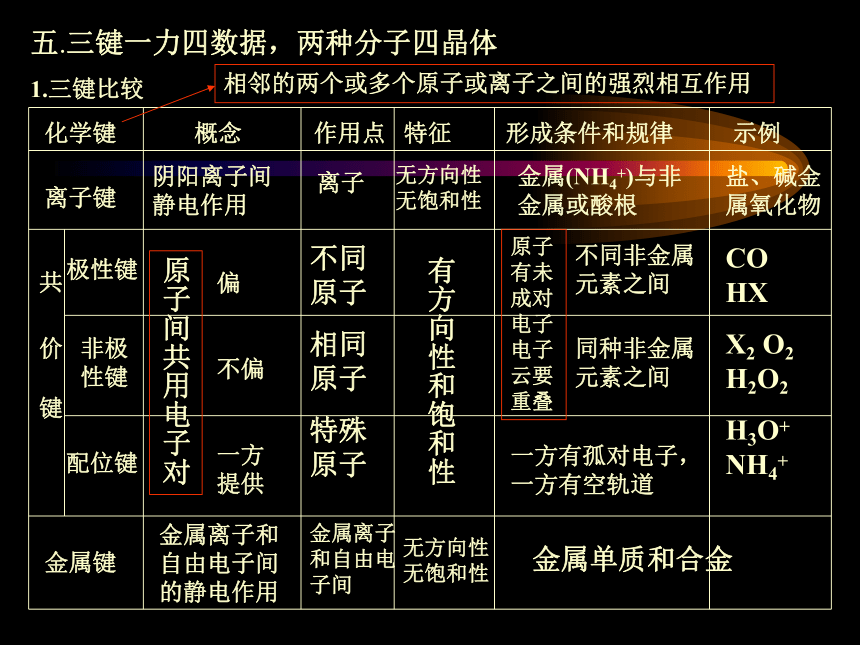
A五.三键一力四数据,两种分子四晶体
1.三键比较化学键 概念 作用点 特征 形成条件和规律 示例离子键阴阳离子间静电作用离子无方向性无饱和性金属(NH4+)与非金属或酸根盐、碱金属氧化物共 价 键极性键非极性键配位键原子间共用电子对偏
不偏
一方提供不同原子
相同原子
特殊原子有方向性和饱和性原子有未成对电子电子云要重叠不同非金属元素之间同种非金属元素之间一方有孤对电子,一方有空轨道CO HX
X2 O2 H2O2
H3O+ NH4+金属键金属离子和自由电子间的静电作用金属离子和自由电子间无方向性无饱和性金属单质和合金2.一力:分子间作用力(范德华力)
1)概念:存在于分子之间的微弱作用力。(只有分子晶体有)
2)意义:决定分子晶体的物理性质。如力越大熔沸点越高组成和结构相似:分子量越大,力越大。
如熔沸点 CF4HCl同分异构体:支链越多,力越小。如
如熔沸点 正戊烷>异戊烷>新戊烷4)与化学键的比较 化学键 分子间力
概念 原子或离子间强烈相互作用 分子间微弱的相互作用
范围 分子内或离子、原子、金属晶体内 分子间
能量 键能一般为120~800kJ/mol 约几个~十几个kJ/mol
性质影响 主要影响物质的化学性质 主要影响物质的物理性质3.四数据1)原子半径概念:成键原子核间距离的一半。变化规律:与离子半径关系:原子半径<相应的阴离子半径
原子 半径>相应的阳离子半径
意义:原子半径的大小可判断得失电子的难易,大易失。比较微粒大小的依据(三看)
一看电子层数:电子层数越多半径越大 Na>Na+
二看核电荷数:电子层数相同时,核电荷数越大半径越小。
S2->Cl->Ar>K+>Ca2+; O2->F->Ne>Na+>Mg2+>Al3+
三看电子数:电子层和核电荷数都相同时,电子数越多半径越大。 Cl->Cl;Fe2+>Fe3+2)键长、键角、键能 概念 意义
键长 成键两原子核间的平均距离 键长越短键越强结合越牢固
键能 形成1mol化学键所放出的能量 键能越大键越强结合越牢固
键角 分子内相邻两共价键之间的夹角 决定分子构型,判断分子极性4.两种分子(极性、非极性分子)分子 极性分子 非极性分子
概念 正负电荷中心不重和 正负电荷中心重和
判断 极性键、结构不对称 非极性键或极性键、结构对称
实例
双原子 CO NO HX X2 H2 O2 N2
叁原子(AB2) V型 H2O H2S NO2 SO2 直线型 CO2 CS2
肆原子(AB3) 三角锥型 NH3 PH3 平面正三角 BF3 SO3 ( P4,C2H2)
五原子(AB4) CHCl3 CH2Cl2 CH3Cl 正四面体 CH4 CCl4 5.四晶体晶体类型 离子晶体 原子晶体 分子晶体 金属晶体
概念 离子间离子键 原子间共价键 分子间分子力 金属离子和e金属键
晶体质点 阴、阳离子 原子 分子 金属离子原子和e
作用力 离子键 共价键 分子间力 金属键
物理性质
熔沸点 较高 最高 很低 一般高少数低
硬度 较硬 最硬 硬度小 多数硬少数软
溶解性 易溶于水 难溶任何溶剂 相似相溶 难溶
导电性 溶、熔可 硅、石墨可 部分水溶液可 固、熔可
实例 盐MOH MO C Si SiO2 SiC HX XOn HXOn 金属或合金物质熔沸点高低的比较
1.晶体内微粒间作用力越大,熔沸点越高,只有分子晶体熔化时不破坏化学键
2.不同晶体(一般):原子晶体>离子晶体>分子晶体
熔点范围 : 上千度~几千度 > 近千度~几百度 > 多数零下最多几百度3.同种晶体离子晶体:比较离子键强弱,离子半径越小,电荷越多,熔 沸点越高 MgO>MgCl2>NaCl>KCl>KBr
原子晶体:比较共价键强弱(看键能和键长)
金刚石(C) > 水晶(SiO2) > SiC > Si
分子晶体:比较分子间力
1)组成和结构相似时,分子量越大熔沸点越高 F2 2)同分异构体:支链越多熔沸点越低 正戊烷>异戊烷>新戊烷
金属晶体:比较金属键,熔沸点同族从上到下减小,同周期 从左到右增大。Li>Na>K>Rb>Cs ;NaB (阳离子小阴离子大)
例2(99)下列各分子中所有原子都满足最外层8电子结构的是 A. BeCl2 B. PCl3 C. PCl5 D. N2
B.D
例3(98)下列各分子中所有原子都满足最外层8电子结构的是 A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
A. 用排除法
例4(93)下列各分子中所有原子不能都满足最外层8电子结构的是 A.CO2 B.PCl3 C.CCl4 D.NO2
D.用排除法
例5(92s)下列晶体中金属阳离子与自由电子作用最强的是 A. Na B. Mg C. Al D.Si
C
例6(92s)下列叙述正确的是 A.离子化合物中可能含有共价键 B.构成分子晶体的微粒一定含有共价键 C.共价化合物中可能含有离子键 D.非极性分子中一定含有非极性键
A. B(He)
例7(93s)下列性质中可证明某化合物一定存在离子键的是 A.可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电
D例8(92)下列分子中含有极性键的非极性分子的是 A. H2O B. Cl2 C. NH3 D.CCl4
D.
例9(93s)下列叙述正确的是 A.P4和NO2都是共价化合物 B.CCl4和NH3都是以极性键结合的极性分子 C.在CaO和SiO2晶体中都不存在单个小分子 D.甲烷是对称平面结构,所以是非极性分子
C.
例10(93)下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
B.例11(93s)A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A B C三种离子半径大小的顺序是 A. A>B>C B. B>A>C C. C>A>B D. C>B>A
B.
例12(96)关于化学键的下列叙述中正确的是 A.离子化合物中可能含有共价键 C.离子化合物中只含离子键 B.共价化合物中可能含有离子键 D.共价化合物不含离子键
A.D
例13(96s)下列过程中共价键被破坏的是 A.碘升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
D.六.四种符号四图式,一定联系周期律1.四种符号元素符号:Al S
离子符号:Al3+ S2- (SO42-)
价标符号:Al+3 S-2 (SO4-2)
核组成符号:2713Al 3216S2.四图式化学式 Na2O2 NH4Cl C2H4 NH3
电子式
结构式
结构简式3.周期律概念: 元素的性质(原子半径、主要化合价)随着原子序数的 递增而呈周期性的变化
规律:原子半径同周期从左到右渐小,同族从上到下渐大。
主要化合价:+1 +2 +3 +4 +5 +6 +7 0 -4 -3 -2 -1
原因:核外电子排布随着原子序数的递增而呈周期性的变化 (1~8) 金属性、非金属性、还原性、氧化性、氢化物稳定性、最高价氧化物的水化物酸碱性7.元素周期表
1)周期表格要牢记,变化体现周期律,七主七付七周期,VIII族零族镧锕系元素周期表编排原则1.按原子序数递增的顺序从左到右排列
2.将电子层数相同元素排成一个横行
3.把最外电子数相同的元素排成一个纵行构造周期:表中的每一横行。短(1.2.3)长(4.5.6)不完全(7)
族: 7主 (长短周期元素)、7付 (仅有长周期元素)、 零(希有气体)、VIII(8.9.10三纵行)
镧锕系:为紧凑周期表而列在外。要求能画简易周期表(主族和前四周期)
18纵7横,I~VIII; I~0。高A低 B。练习
记忆:1)原子序数:记两头推中间(1H+2+8+8+18+18+32+32)
2)每周期所含元素(2. 8. 8. 18. 18. 32. 23)
3)希有气体结构(内推本周期IIIA~VIIA,外推下周期 IA IIA2)原子结构变化规律同周期电子层数=周期序数
最外层电子数从左到右 1~7(8)同主族电子层数从上到下依次增大
最外层电子数=族序数=价电子数=最高正价数3)同族金增非递减,同周金减非增递内容 同周期(从左到右) 同主族(从上到下)
电子层数 相同(等于周期序数) 逐渐增加
最外电子数 逐渐增加(1~8) 相同(等于族序数)
最高正价 +1~~+7 等于族序数
原子半径 逐渐减小 逐渐增大
离子半径 阴阳离子半径均渐小 阴阳离子半径均渐大
得电子能力(氧化性) 逐渐增强 逐渐减弱
失电子能力(还原性) 逐渐减弱 逐渐增强
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
最高价氧化物水化物酸碱性 碱性渐弱酸性渐强 碱性渐强酸性渐弱
气态氢化物稳定性 逐渐增强 逐渐减弱A.同周期元素性质变化规律族 IA IIA IIIA IVA VA VIA VIIA
最外电子数 1 2 3 4 5 6 7
原子半径 大—————————————————————小
得(失)电子能力 弱(强)————————————————强(弱)
氧化(还原)性 弱(强)————————————————强(弱)
最高正价 +1 +2 +3 +4 +5 +6 +7
对应氧化物 R2O RO R2O3 RO2 R2O5 RO3 R2O7
对应水化物 ROH R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4
酸碱性 碱性渐弱, 酸性渐强
最低负价 -4 -3 -2 -1
对应氢化物 RH4 RH3 H2R HR
稳定性 逐渐增强
溶于水酸碱性 碱性渐弱,酸性渐强B.判断金属性和非金属性的依据证明金属性同条件下与水或酸,越易越强。
最高价氧化物所对应的水化物的碱性,越强越强
相互置换
电化学:原电池的负极,电解时后还原金属性强证明非金属性最高价氧化物所对应的水化物的酸性,越强越强
与H2反应的条件和生成氢化物的稳定性
相互置换
电解时后氧化的非金属性强4).元素排布分四区,三角变化有联系位置性质结构最外层电子数
电子层数(族)纵
(横)周期原子序数相似性递变性1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“水化物”的酸碱性
3.氢化物的稳定性5)周期表的应用
A.推断元素位置、结构和性质元素名称元素特征
周期数、族数
原子序数
原子量物理或化学特性
原子结构特征含量等其它特征
元素的性质
原子或离子结构
最高或最低化合价
根据分子式的计算
根据化学方程式的计算B特殊知识点找元素之最最活泼金属Cs、最活泼非金属F2
最轻的金属Li、最轻的非金属H2
最高熔沸点是C、最低熔沸点是He
最稳定的气态氢化物HF,含H%最大的是CH4
最强酸HClO4、最强碱CsOH
地壳中含量最多的金属和非金属 Al O找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhC比较或推断一些性质比较同族元素的 金属性 Ba>Ca>Mg
非金属性 F>Cl>Br
最高价氧化物的水化物的酸碱性 KOH>NaOH>LiOH
氢化物的稳定性 CH4>SiH4
比较同周期元素及其化合物的性质
碱性: NaOH>Mg(OH)2>Al(OH)3
稳定性: HF>H2O>NH3
比较不同周期元素的性质(先找出与其同周期元素参照)
推断一些未知元素及其化合物的性质
预测88Ra的性质例1(98)X、Y、Z为短周期元素,最外层电子数分别为1、4、6,则下列化合物的化学式不可能的是 A. XYZ B. X2YZ C. X2YZ2 D. X2YZ3
A. B可为 HCHO ; C可为 HCOOH; D可为 Na2CO3
例2(00)下列每组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是 A.食盐和蔗糖熔化 B.钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
C
例3(99)关于晶体的下列说法正确的是 A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子 C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低
A.例4(99)关于IA和IIA族元素的下列说法中正确的是 A.在同一周期中,IA单质的熔点比IIA族的高 B.浓度都是0.01mol/L时,KOH溶液的PH值比Ba(OH)2的小 C.氧化钠的熔点比氧化镁的高 D.加热时,碳酸钠比碳酸镁易分解
B.
例5(98)下列叙述正确的是 A.同主族金属的原子半径越大熔点越高 B.希有气体原子序数越大沸点越高 C.分子间作用力越弱分子晶体的熔点越低 D.同周期元素的原子半径越小越易失去电子
B.C例6(98)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为 A. XY B. XY2 C. XY3 D. X2Y3
A. X可能是 Li (2 1) ; Si (2 8 4) Y可能是 H和Li
例7(98s)IIA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为 A. Mg B. Ca C. Sr D. Ba
B.C
例8(98s)钛的同位素4622Ti 、 4722Ti 、 4822Ti 、 4922Ti 、 5022Ti中,中子数不可能为 A. 30 B. 28 C.26 D.24
A. 最小值46-22=24;最大值50-22=28例9(97s)短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是 A.M2+的离子半径比N2-的小 B.M的原子序数比N小 C.M和N原子的电子层数相等 D.M和N原子最外层电子数相等
A. M在N的下一周期
例10(97)X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是 A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
D
例11(97)铍的原子序数为4,下列叙述正确的是 A.铍的原子半径大于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8 C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气
A.C例12(97)下列各组微粒中,核外电子总数相等的是 A.K+和Na+ B.CO2和NO2 C.CO和CO2 D.N2和CO
D.
例13(97)19世纪中叶,门捷列夫的突出贡献是 A.提出原子学说 B.发现元素周期律 C.提出分子学说 D.发现氧气
B.
例14(96s)随着卤素原子半径的增大,下列递变规律正确的是 A.单质的熔沸点逐渐降低 B.卤素离子的还原性逐渐增强 C.气态氢化物稳定性逐渐增强 D.单质氧化性逐渐增强
B.
例15(96s)下列各组分子中都属于含极性键的非极性分子的是 A.CO2. H2S B.C2H4.CH4 C. Cl2. C2H2 D.NH3 . HCl
B.
第二节.化学反应速率
第三节.电解质溶液第一节.物质结构、元素周期律
一.知识要点:(口诀)物质结构1.三种微粒六种量,两素概念算清帐;
2.一种状态二原理,一套规律要记详;
3.三键一力四数据,两种分子四晶体;
4.四种符号四图式,一定联系周期律。元素周期律1.周期表格要牢记,变化体现周期律;
2.七主七付七周期,VIII族零族镧锕系;
3.同族金增非递减,同周金减非增递;
4.元素排布分四区,三角变化有联系。 二.知识体系物质结构原子原子核核外电子原子序数核电荷数元素元素周期表元素周期律编排原则1.按序数从左到右
2.电子层同则同行
3.最外电子数同则同纵周期短(1.2.3)
长(4.5.6)
不完全(7)族:7主、7付、零、VIII性质递变规律:同周期、同族质子中子随着原子序数的递增,原子结构 原子半径、主要化合价呈周期性变化质量数同位素原子量运动状态(电子云)
排布规律:最多2n2;最外层<8;次外层<18;能量最低原理
最外层电子决定元素化学性质原子通过电子转移或共用电子对化学键离子键
离子化合物
离子晶体共价键金属键
金属晶体极性键
非极性键
配位键描述键长
键角
键能决定分子构型分子分子的形成
分子的极性
分子的作用力范德华力影响物质的物理性质网状结构
原子晶体极性分子
非极性分子分子晶体三.三种微粒六种量,两素概念算清帐.
1.三种微粒 1)比较微粒 质量 相对质量 电性 意义
质子 1.6726×10-27kg 1.007 一个单位正电荷 决定元素的种类
中子 1.6743 ×10-27kg 1.008 不带电、中性 决定同位素和质量数
电子 9.1095×10-27kg 1/1836 一个单位负电荷 价电子决定元素化性原子核原子2)核组成符号 AZX质子:Z 个
中子:A-Z 个
核外电子:Z个3)两个关系式
原子序数=核电荷数=质子数=原子核外电子数 (阴、阳离子=?)
质量数(A)=质子数(Z)+中子数(N) 例1(99)“铱星”计划中的铱的一种同位素是19177Ir其核内中子数是 A. 77 B. 114 C. 191 D. 268
例2(99)已知铱有两种同位素191Ir和193Ir,而铱的平均原子量为192.22,则两种同位素的原子个数比是 A.39:61 B. 61:39 C.1:1 D.39:111.B 2.A 191x+193(1-x)=192.22 (或用十字交叉法)
例3(00)136C— NMR(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
D例4.(20g)1999年新发现114号元素的同位素,其中子数为184,该同位素的质量数是 A.70 B.114 C.228 D.298
D
例5(93s)核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量(mol) A.n(A-N+8)/(A+16) B.n(A-N+10)/(A+16) C.(A-N+2) D.n(A-N+6)/A
氧化物为RO,质子数=A-N+8;式量=A+16;选A
例6(95)178O和168O原子的核外电子数的比较 A. 大于 B.小于 C.等于 D.不能确定
C
例7(99s)12553I可治疗肿瘤,其核内中子数与核外电子数之差是
A.72 B.19 C.53 D.125B2.六种量
量 概念 意义
质子数 质子的数目 决定元素的种类和“位置”
中子数 中子的数目 决定原子的物性和质量数
电子数 电子的数目 价电子决定元素的化学性质
质量数 质子数与中子数之和 决定原子的近似原子量
元素平均原子量:A=A1?x1+ A2?x2+ A3?x3……
元素近似平均原子量:A=A’1?x1+ A’2?x2+ A’3?x3……
其中 A1 A2 A3……为各同位素的原子量
A’1 A’2 A’3……为各同位素的质量数
x1 x2 x3…… 为各同位素的丰度或摩尔分数四.一种状态二原理,一套规律要记详
1.一种状态:核外电子运动状态
1)电子云:电子在核外空间一定范围内出现,好象带负电荷的云雾笼罩原子核周围,人们形象地称它为电子云。2)电子层概念:能量高低不同和离核远近不同的空间区域
符号: K L M N O P Q
电子层数: 1 2 3 4 5 6 7
能量: 低—————————高
离核距离:近—————————远记忆2.二原理
1)最大容纳原理:每个电子层最多容纳2n2个电子。
2)能量最低原理:电子在填入电子层时,先占能量低的电子 层后占能量高的电子层。
3.一套规律要记详:核外电子排布规律
1)每个电子层最多排2n2个电子
2)最外层? 8个电子,次外层? 18个电子,倒第三层? 32
3)先占内层,后占外层
要求:主族元素和第四周期元素原子结构简图会写
方法:记住每周期希有气体的结构简图
IA IIA外延;IIIA~IIVA内推例1(96)M电子层与L电子层最多可容纳的电子数的比较 A. 大于 B.小于 C.等于 D.不能确定
A五.三键一力四数据,两种分子四晶体
1.三键比较化学键 概念 作用点 特征 形成条件和规律 示例离子键阴阳离子间静电作用离子无方向性无饱和性金属(NH4+)与非金属或酸根盐、碱金属氧化物共 价 键极性键非极性键配位键原子间共用电子对偏
不偏
一方提供不同原子
相同原子
特殊原子有方向性和饱和性原子有未成对电子电子云要重叠不同非金属元素之间同种非金属元素之间一方有孤对电子,一方有空轨道CO HX
X2 O2 H2O2
H3O+ NH4+金属键金属离子和自由电子间的静电作用金属离子和自由电子间无方向性无饱和性金属单质和合金2.一力:分子间作用力(范德华力)
1)概念:存在于分子之间的微弱作用力。(只有分子晶体有)
2)意义:决定分子晶体的物理性质。如力越大熔沸点越高组成和结构相似:分子量越大,力越大。
如熔沸点 CF4
如熔沸点 正戊烷>异戊烷>新戊烷4)与化学键的比较 化学键 分子间力
概念 原子或离子间强烈相互作用 分子间微弱的相互作用
范围 分子内或离子、原子、金属晶体内 分子间
能量 键能一般为120~800kJ/mol 约几个~十几个kJ/mol
性质影响 主要影响物质的化学性质 主要影响物质的物理性质3.四数据1)原子半径概念:成键原子核间距离的一半。变化规律:与离子半径关系:原子半径<相应的阴离子半径
原子 半径>相应的阳离子半径
意义:原子半径的大小可判断得失电子的难易,大易失。比较微粒大小的依据(三看)
一看电子层数:电子层数越多半径越大 Na>Na+
二看核电荷数:电子层数相同时,核电荷数越大半径越小。
S2->Cl->Ar>K+>Ca2+; O2->F->Ne>Na+>Mg2+>Al3+
三看电子数:电子层和核电荷数都相同时,电子数越多半径越大。 Cl->Cl;Fe2+>Fe3+2)键长、键角、键能 概念 意义
键长 成键两原子核间的平均距离 键长越短键越强结合越牢固
键能 形成1mol化学键所放出的能量 键能越大键越强结合越牢固
键角 分子内相邻两共价键之间的夹角 决定分子构型,判断分子极性4.两种分子(极性、非极性分子)分子 极性分子 非极性分子
概念 正负电荷中心不重和 正负电荷中心重和
判断 极性键、结构不对称 非极性键或极性键、结构对称
实例
双原子 CO NO HX X2 H2 O2 N2
叁原子(AB2) V型 H2O H2S NO2 SO2 直线型 CO2 CS2
肆原子(AB3) 三角锥型 NH3 PH3 平面正三角 BF3 SO3 ( P4,C2H2)
五原子(AB4) CHCl3 CH2Cl2 CH3Cl 正四面体 CH4 CCl4 5.四晶体晶体类型 离子晶体 原子晶体 分子晶体 金属晶体
概念 离子间离子键 原子间共价键 分子间分子力 金属离子和e金属键
晶体质点 阴、阳离子 原子 分子 金属离子原子和e
作用力 离子键 共价键 分子间力 金属键
物理性质
熔沸点 较高 最高 很低 一般高少数低
硬度 较硬 最硬 硬度小 多数硬少数软
溶解性 易溶于水 难溶任何溶剂 相似相溶 难溶
导电性 溶、熔可 硅、石墨可 部分水溶液可 固、熔可
实例 盐MOH MO C Si SiO2 SiC HX XOn HXOn 金属或合金物质熔沸点高低的比较
1.晶体内微粒间作用力越大,熔沸点越高,只有分子晶体熔化时不破坏化学键
2.不同晶体(一般):原子晶体>离子晶体>分子晶体
熔点范围 : 上千度~几千度 > 近千度~几百度 > 多数零下最多几百度3.同种晶体离子晶体:比较离子键强弱,离子半径越小,电荷越多,熔 沸点越高 MgO>MgCl2>NaCl>KCl>KBr
原子晶体:比较共价键强弱(看键能和键长)
金刚石(C) > 水晶(SiO2) > SiC > Si
分子晶体:比较分子间力
1)组成和结构相似时,分子量越大熔沸点越高 F2
金属晶体:比较金属键,熔沸点同族从上到下减小,同周期 从左到右增大。Li>Na>K>Rb>Cs ;Na
例2(99)下列各分子中所有原子都满足最外层8电子结构的是 A. BeCl2 B. PCl3 C. PCl5 D. N2
B.D
例3(98)下列各分子中所有原子都满足最外层8电子结构的是 A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
A. 用排除法
例4(93)下列各分子中所有原子不能都满足最外层8电子结构的是 A.CO2 B.PCl3 C.CCl4 D.NO2
D.用排除法
例5(92s)下列晶体中金属阳离子与自由电子作用最强的是 A. Na B. Mg C. Al D.Si
C
例6(92s)下列叙述正确的是 A.离子化合物中可能含有共价键 B.构成分子晶体的微粒一定含有共价键 C.共价化合物中可能含有离子键 D.非极性分子中一定含有非极性键
A. B(He)
例7(93s)下列性质中可证明某化合物一定存在离子键的是 A.可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电
D例8(92)下列分子中含有极性键的非极性分子的是 A. H2O B. Cl2 C. NH3 D.CCl4
D.
例9(93s)下列叙述正确的是 A.P4和NO2都是共价化合物 B.CCl4和NH3都是以极性键结合的极性分子 C.在CaO和SiO2晶体中都不存在单个小分子 D.甲烷是对称平面结构,所以是非极性分子
C.
例10(93)下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
B.例11(93s)A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A B C三种离子半径大小的顺序是 A. A>B>C B. B>A>C C. C>A>B D. C>B>A
B.
例12(96)关于化学键的下列叙述中正确的是 A.离子化合物中可能含有共价键 C.离子化合物中只含离子键 B.共价化合物中可能含有离子键 D.共价化合物不含离子键
A.D
例13(96s)下列过程中共价键被破坏的是 A.碘升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
D.六.四种符号四图式,一定联系周期律1.四种符号元素符号:Al S
离子符号:Al3+ S2- (SO42-)
价标符号:Al+3 S-2 (SO4-2)
核组成符号:2713Al 3216S2.四图式化学式 Na2O2 NH4Cl C2H4 NH3
电子式
结构式
结构简式3.周期律概念: 元素的性质(原子半径、主要化合价)随着原子序数的 递增而呈周期性的变化
规律:原子半径同周期从左到右渐小,同族从上到下渐大。
主要化合价:+1 +2 +3 +4 +5 +6 +7 0 -4 -3 -2 -1
原因:核外电子排布随着原子序数的递增而呈周期性的变化 (1~8) 金属性、非金属性、还原性、氧化性、氢化物稳定性、最高价氧化物的水化物酸碱性7.元素周期表
1)周期表格要牢记,变化体现周期律,七主七付七周期,VIII族零族镧锕系元素周期表编排原则1.按原子序数递增的顺序从左到右排列
2.将电子层数相同元素排成一个横行
3.把最外电子数相同的元素排成一个纵行构造周期:表中的每一横行。短(1.2.3)长(4.5.6)不完全(7)
族: 7主 (长短周期元素)、7付 (仅有长周期元素)、 零(希有气体)、VIII(8.9.10三纵行)
镧锕系:为紧凑周期表而列在外。要求能画简易周期表(主族和前四周期)
18纵7横,I~VIII; I~0。高A低 B。练习
记忆:1)原子序数:记两头推中间(1H+2+8+8+18+18+32+32)
2)每周期所含元素(2. 8. 8. 18. 18. 32. 23)
3)希有气体结构(内推本周期IIIA~VIIA,外推下周期 IA IIA2)原子结构变化规律同周期电子层数=周期序数
最外层电子数从左到右 1~7(8)同主族电子层数从上到下依次增大
最外层电子数=族序数=价电子数=最高正价数3)同族金增非递减,同周金减非增递内容 同周期(从左到右) 同主族(从上到下)
电子层数 相同(等于周期序数) 逐渐增加
最外电子数 逐渐增加(1~8) 相同(等于族序数)
最高正价 +1~~+7 等于族序数
原子半径 逐渐减小 逐渐增大
离子半径 阴阳离子半径均渐小 阴阳离子半径均渐大
得电子能力(氧化性) 逐渐增强 逐渐减弱
失电子能力(还原性) 逐渐减弱 逐渐增强
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
最高价氧化物水化物酸碱性 碱性渐弱酸性渐强 碱性渐强酸性渐弱
气态氢化物稳定性 逐渐增强 逐渐减弱A.同周期元素性质变化规律族 IA IIA IIIA IVA VA VIA VIIA
最外电子数 1 2 3 4 5 6 7
原子半径 大—————————————————————小
得(失)电子能力 弱(强)————————————————强(弱)
氧化(还原)性 弱(强)————————————————强(弱)
最高正价 +1 +2 +3 +4 +5 +6 +7
对应氧化物 R2O RO R2O3 RO2 R2O5 RO3 R2O7
对应水化物 ROH R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4
酸碱性 碱性渐弱, 酸性渐强
最低负价 -4 -3 -2 -1
对应氢化物 RH4 RH3 H2R HR
稳定性 逐渐增强
溶于水酸碱性 碱性渐弱,酸性渐强B.判断金属性和非金属性的依据证明金属性同条件下与水或酸,越易越强。
最高价氧化物所对应的水化物的碱性,越强越强
相互置换
电化学:原电池的负极,电解时后还原金属性强证明非金属性最高价氧化物所对应的水化物的酸性,越强越强
与H2反应的条件和生成氢化物的稳定性
相互置换
电解时后氧化的非金属性强4).元素排布分四区,三角变化有联系位置性质结构最外层电子数
电子层数(族)纵
(横)周期原子序数相似性递变性1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“水化物”的酸碱性
3.氢化物的稳定性5)周期表的应用
A.推断元素位置、结构和性质元素名称元素特征
周期数、族数
原子序数
原子量物理或化学特性
原子结构特征含量等其它特征
元素的性质
原子或离子结构
最高或最低化合价
根据分子式的计算
根据化学方程式的计算B特殊知识点找元素之最最活泼金属Cs、最活泼非金属F2
最轻的金属Li、最轻的非金属H2
最高熔沸点是C、最低熔沸点是He
最稳定的气态氢化物HF,含H%最大的是CH4
最强酸HClO4、最强碱CsOH
地壳中含量最多的金属和非金属 Al O找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhC比较或推断一些性质比较同族元素的 金属性 Ba>Ca>Mg
非金属性 F>Cl>Br
最高价氧化物的水化物的酸碱性 KOH>NaOH>LiOH
氢化物的稳定性 CH4>SiH4
比较同周期元素及其化合物的性质
碱性: NaOH>Mg(OH)2>Al(OH)3
稳定性: HF>H2O>NH3
比较不同周期元素的性质(先找出与其同周期元素参照)
推断一些未知元素及其化合物的性质
预测88Ra的性质例1(98)X、Y、Z为短周期元素,最外层电子数分别为1、4、6,则下列化合物的化学式不可能的是 A. XYZ B. X2YZ C. X2YZ2 D. X2YZ3
A. B可为 HCHO ; C可为 HCOOH; D可为 Na2CO3
例2(00)下列每组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是 A.食盐和蔗糖熔化 B.钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
C
例3(99)关于晶体的下列说法正确的是 A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子 C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低
A.例4(99)关于IA和IIA族元素的下列说法中正确的是 A.在同一周期中,IA单质的熔点比IIA族的高 B.浓度都是0.01mol/L时,KOH溶液的PH值比Ba(OH)2的小 C.氧化钠的熔点比氧化镁的高 D.加热时,碳酸钠比碳酸镁易分解
B.
例5(98)下列叙述正确的是 A.同主族金属的原子半径越大熔点越高 B.希有气体原子序数越大沸点越高 C.分子间作用力越弱分子晶体的熔点越低 D.同周期元素的原子半径越小越易失去电子
B.C例6(98)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为 A. XY B. XY2 C. XY3 D. X2Y3
A. X可能是 Li (2 1) ; Si (2 8 4) Y可能是 H和Li
例7(98s)IIA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为 A. Mg B. Ca C. Sr D. Ba
B.C
例8(98s)钛的同位素4622Ti 、 4722Ti 、 4822Ti 、 4922Ti 、 5022Ti中,中子数不可能为 A. 30 B. 28 C.26 D.24
A. 最小值46-22=24;最大值50-22=28例9(97s)短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是 A.M2+的离子半径比N2-的小 B.M的原子序数比N小 C.M和N原子的电子层数相等 D.M和N原子最外层电子数相等
A. M在N的下一周期
例10(97)X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是 A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
D
例11(97)铍的原子序数为4,下列叙述正确的是 A.铍的原子半径大于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8 C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气
A.C例12(97)下列各组微粒中,核外电子总数相等的是 A.K+和Na+ B.CO2和NO2 C.CO和CO2 D.N2和CO
D.
例13(97)19世纪中叶,门捷列夫的突出贡献是 A.提出原子学说 B.发现元素周期律 C.提出分子学说 D.发现氧气
B.
例14(96s)随着卤素原子半径的增大,下列递变规律正确的是 A.单质的熔沸点逐渐降低 B.卤素离子的还原性逐渐增强 C.气态氢化物稳定性逐渐增强 D.单质氧化性逐渐增强
B.
例15(96s)下列各组分子中都属于含极性键的非极性分子的是 A.CO2. H2S B.C2H4.CH4 C. Cl2. C2H2 D.NH3 . HCl
B.
