盐类的水解及应用[上学期]
文档属性
| 名称 | 盐类的水解及应用[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 18.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-12-04 10:55:00 | ||
图片预览








文档简介
课件21张PPT。第三节盐类的水解及应用考纲要求:
1、盐类水解离子方程式的书写;
2、盐溶液酸碱性的比较
3、影响盐类水解平衡移动的因素
4、离子浓度大小的比较
5、盐类水解的应用用一、盐的水解的实质: 盐中弱(弱酸阴离子或弱碱阳离子)离子与水电离出的H+或OH-离子结合生成难电离(弱电解质)的分子或离子,破坏水的电离平衡。二、盐类水解的条件:⑴盐必须溶于水; ⑵盐中必须有弱酸阴离子或弱碱阳离子。三、盐类水解规律:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强呈中性。四、盐类水解的基本特征:①盐类水解程度一般微弱; ②盐类水解是中和反应逆反应为吸热反应;五.影响盐类水解的因素⑴温度:
⑵浓度:
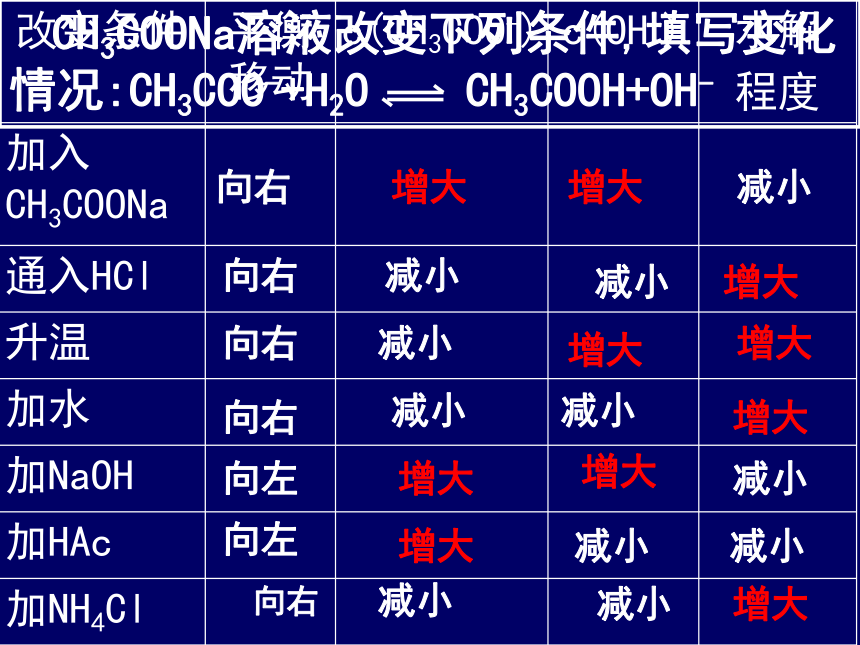
盐本身的性质——越弱越水解1.内因:2.外因: 盐的水解反应是吸热反应,升 高温度水解程度增大,溶液的性质(酸性或碱性)越强. 盐的浓度越小,一般水解程度越大,溶液的性质(酸性或碱性)越弱 ⑶溶液的酸、碱性: 盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。 盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O CH3COOH+OH-向右增大增大减小向右减小减小增大向右减小增大增大向右减小减小增大向左向左增大增大增大减小减小减小向右减小减小增大六、盐类水解方程式的书写规律 1、盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二水解程度大。
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。 4、对于发生双水解的盐类,因水解彻底,故用“=”,同时有沉淀和气体产生。
5、多元弱酸的酸式根离子,水解和电离同步进行。下列水解离子方程式不正确的是( )1.NH4++H2O NH3.H2O+H+ 2.Fe3++3H2O Fe(OH)3+3H+ 3.SO32-+H2O HSO3-+OH-
HSO3-+ H2O H2SO3+OH-4.HCO3--+H2O H2CO3+OH-5.CO32-+2H2O H2CO3 + 2OH-
6.An++nH2O A(OH)n + nH+
7.Bn-+H2O HB(n—1)- +OH-8.HCO3-+H2O H3O++CO32-5,8 七、盐类水解的应用 1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需改虑盐的水解。 相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,PH值由大到小的顺序为:NaOH>NaClO>Na2CO3>NaHCO3>NaAc >Na2SO4>(NH4)2SO4>NaHSO4 2.比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。 0.1mol/L的下列各溶液,其中浓度由小到大的顺序为
①(NH4)2SO4②(NH4)2CO3③NH4HSO4 ④ NH4Cl⑤CH3COONH4
C(NH4+) :
①Na2S②(NH4)2S③NaHS④NH4HS⑤H2S
C(S2-):① >②> ③> ④> ⑤① >②> ③> ④> ⑤(1)同种离子在不同溶液中离子浓度大小的比较 (2)一种盐溶液中各种离子浓度大小的比较以0.1mol/lNa2S为例.Na2S水溶液中存在的分子有____________ 离子有________________________________ H2O H2SS2- Na+ HS- OH- H+①电荷守恒
②物料守恒:S元素守恒C(Na+)+C(H+)=2C(S2-)+C(HS-) +C(OH-)C(S2-)+C(HS-)+C(H2S)=0.1mol/l或
③质子守恒
④大小关系0.5C(Na+)=C(S2-)+C(HS-)+C(H2S)C(OH-)=C(H+)+C(HS-)+2C(H2S)C(Na+)>C(S2-)>C(OH-)>C(HS-)
>C(H+)3.判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发出双水解,则不能在溶液中大量共存。 下列各组离子在溶液中能否大量共存? 说明原因. 1.H+ CH3COO- K+ Cl- 2.S2- Al3+ Cl- Na+ 3.CO32- NO3- H+ K+ 4.Cl- Ca2+ NO3- CO32- 5.Fe2+ H+ Cl- NO3-4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑制盐的水解。 加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。 5.选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。 在蒸发皿中加热蒸于并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是 ( )
(A)氯化铝 (B)碳酸氢钠 (C)硫酸镁 (D)高锰酸钾 C 铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用。因草木灰(有效成分K2CO3)水解呈碱性。6.化肥的合理使用,有时需考虑盐的水解。7.溶液中,某些离子的除杂,需考虑盐
的水解。
1、盐类水解离子方程式的书写;
2、盐溶液酸碱性的比较
3、影响盐类水解平衡移动的因素
4、离子浓度大小的比较
5、盐类水解的应用用一、盐的水解的实质: 盐中弱(弱酸阴离子或弱碱阳离子)离子与水电离出的H+或OH-离子结合生成难电离(弱电解质)的分子或离子,破坏水的电离平衡。二、盐类水解的条件:⑴盐必须溶于水; ⑵盐中必须有弱酸阴离子或弱碱阳离子。三、盐类水解规律:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强呈中性。四、盐类水解的基本特征:①盐类水解程度一般微弱; ②盐类水解是中和反应逆反应为吸热反应;五.影响盐类水解的因素⑴温度:
⑵浓度:
盐本身的性质——越弱越水解1.内因:2.外因: 盐的水解反应是吸热反应,升 高温度水解程度增大,溶液的性质(酸性或碱性)越强. 盐的浓度越小,一般水解程度越大,溶液的性质(酸性或碱性)越弱 ⑶溶液的酸、碱性: 盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。 盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O CH3COOH+OH-向右增大增大减小向右减小减小增大向右减小增大增大向右减小减小增大向左向左增大增大增大减小减小减小向右减小减小增大六、盐类水解方程式的书写规律 1、盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二水解程度大。
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。 4、对于发生双水解的盐类,因水解彻底,故用“=”,同时有沉淀和气体产生。
5、多元弱酸的酸式根离子,水解和电离同步进行。下列水解离子方程式不正确的是( )1.NH4++H2O NH3.H2O+H+ 2.Fe3++3H2O Fe(OH)3+3H+ 3.SO32-+H2O HSO3-+OH-
HSO3-+ H2O H2SO3+OH-4.HCO3--+H2O H2CO3+OH-5.CO32-+2H2O H2CO3 + 2OH-
6.An++nH2O A(OH)n + nH+
7.Bn-+H2O HB(n—1)- +OH-8.HCO3-+H2O H3O++CO32-5,8 七、盐类水解的应用 1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需改虑盐的水解。 相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,PH值由大到小的顺序为:NaOH>NaClO>Na2CO3>NaHCO3>NaAc >Na2SO4>(NH4)2SO4>NaHSO4 2.比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。 0.1mol/L的下列各溶液,其中浓度由小到大的顺序为
①(NH4)2SO4②(NH4)2CO3③NH4HSO4 ④ NH4Cl⑤CH3COONH4
C(NH4+) :
①Na2S②(NH4)2S③NaHS④NH4HS⑤H2S
C(S2-):① >②> ③> ④> ⑤① >②> ③> ④> ⑤(1)同种离子在不同溶液中离子浓度大小的比较 (2)一种盐溶液中各种离子浓度大小的比较以0.1mol/lNa2S为例.Na2S水溶液中存在的分子有____________ 离子有________________________________ H2O H2SS2- Na+ HS- OH- H+①电荷守恒
②物料守恒:S元素守恒C(Na+)+C(H+)=2C(S2-)+C(HS-) +C(OH-)C(S2-)+C(HS-)+C(H2S)=0.1mol/l或
③质子守恒
④大小关系0.5C(Na+)=C(S2-)+C(HS-)+C(H2S)C(OH-)=C(H+)+C(HS-)+2C(H2S)C(Na+)>C(S2-)>C(OH-)>C(HS-)
>C(H+)3.判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发出双水解,则不能在溶液中大量共存。 下列各组离子在溶液中能否大量共存? 说明原因. 1.H+ CH3COO- K+ Cl- 2.S2- Al3+ Cl- Na+ 3.CO32- NO3- H+ K+ 4.Cl- Ca2+ NO3- CO32- 5.Fe2+ H+ Cl- NO3-4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑制盐的水解。 加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。 5.选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。 在蒸发皿中加热蒸于并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是 ( )
(A)氯化铝 (B)碳酸氢钠 (C)硫酸镁 (D)高锰酸钾 C 铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用。因草木灰(有效成分K2CO3)水解呈碱性。6.化肥的合理使用,有时需考虑盐的水解。7.溶液中,某些离子的除杂,需考虑盐
的水解。
