脂肪烃[上学期]
图片预览







文档简介
课件41张PPT。第二章第一节脂肪烃石油产品和用途示意图回顾主要的石油产品
常压分馏和减压分馏
石油的催化裂化和裂解
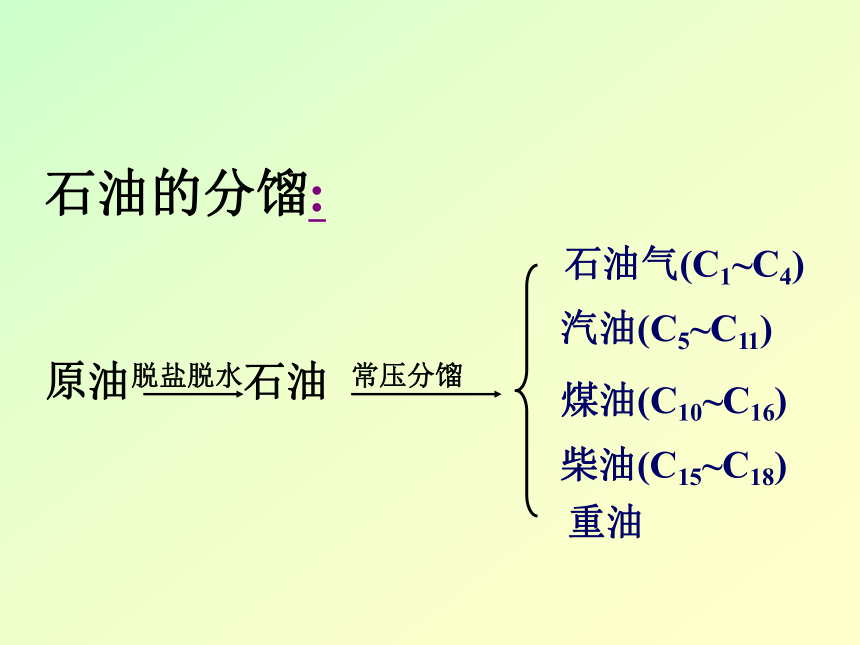
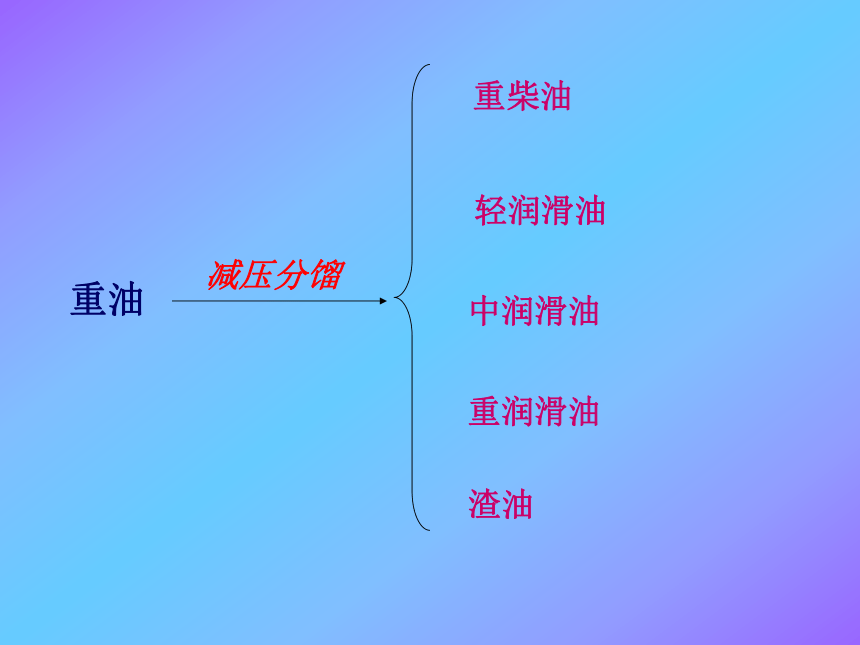
石油的分馏:原油脱盐脱水石油 常压分馏石油气(C1~C4)汽油(C5~C11)煤油(C10~C16)柴油(C15~C18)重油重油减压分馏重柴油轻润滑油中润滑油
重润滑油
渣油石油裂化:
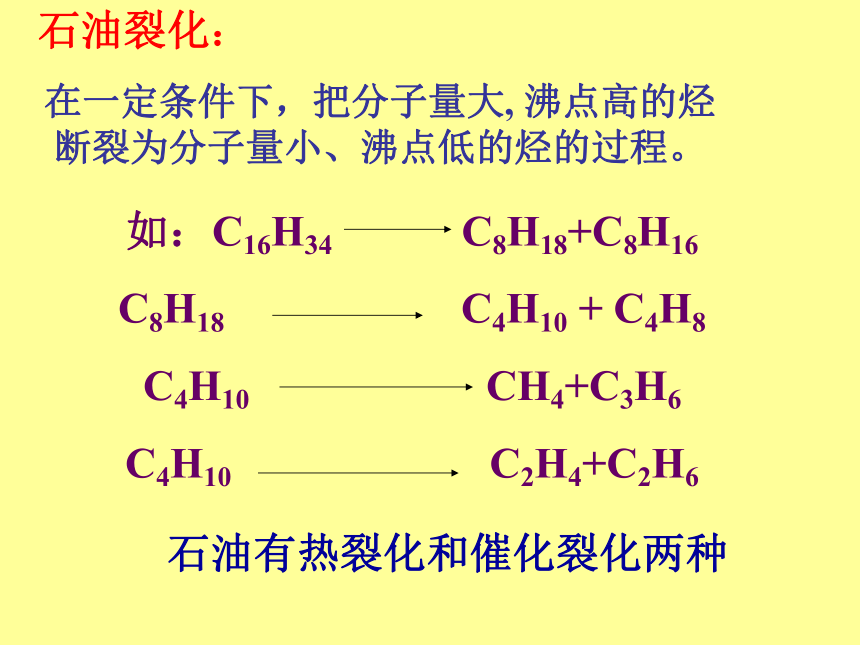
在一定条件下,把分子量大, 沸点高的烃断裂为分子量小、沸点低的烃的过程。如:C16H34 C8H18+C8H16
C8H18 C4H10 + C4H8
C4H10 CH4+C3H6
C4H10 C2H4+C2H6
石油有热裂化和催化裂化两种裂解石油的分馏产品定义:使具有长链分子的烃在700度以上高温时断裂成短链的烃的过程叫裂解目的:生产短链不饱和烃如工业“三烯”乙烯的产量作为衡量石油化工发展水平的标志用途:合成纤维,塑料,橡胶等脂肪烃的来源及应用石油:烷烃、环烷烃
天然气:甲烷(体积分数约占80%-90%)
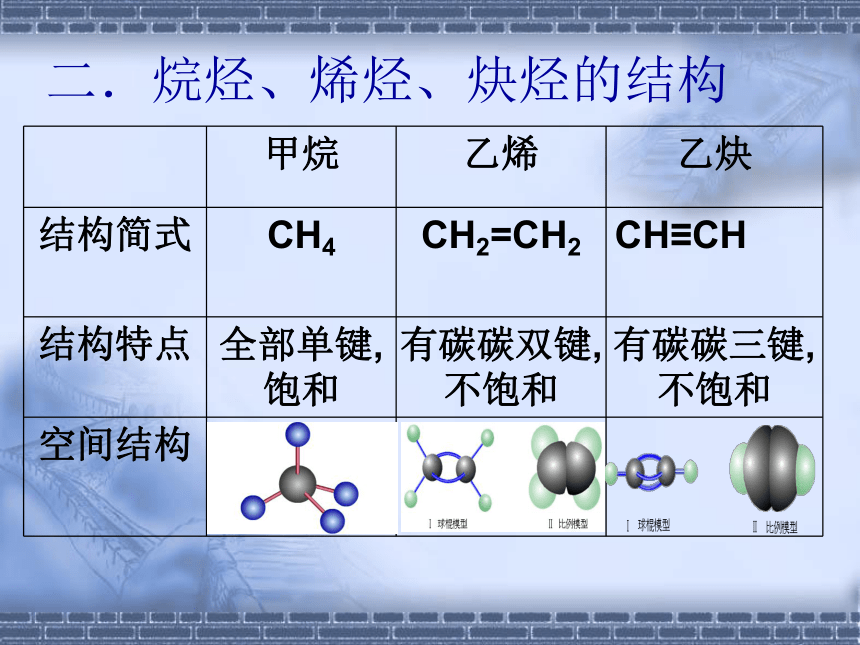
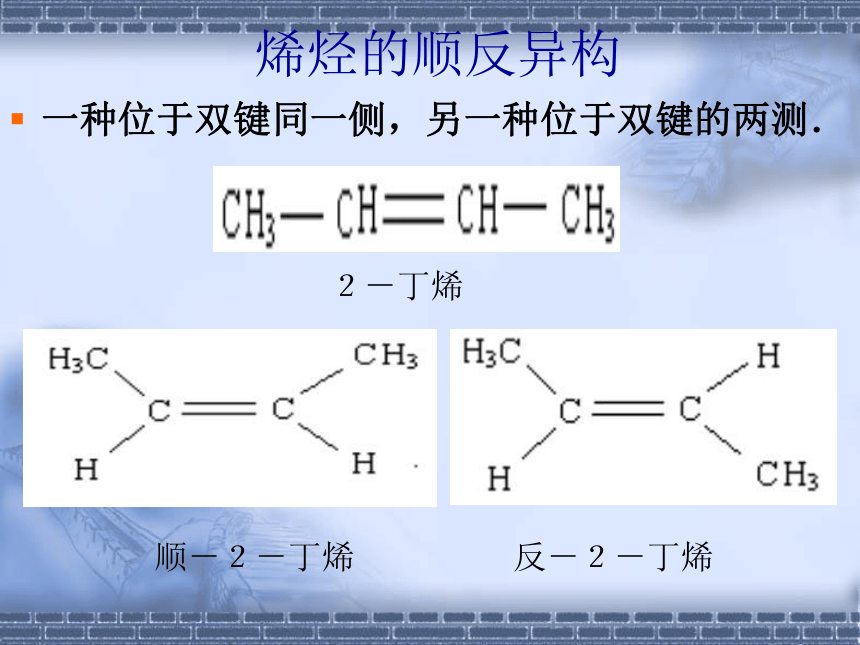
煤:芳香烃二.烷烃、烯烃、炔烃的结构情景创设『问题』在乙烯的球棍模型中,如果将乙烯分子中的两个不同碳上的一个氢原子用甲基取代,试看能得到几种不同结构的分子? 烯烃的顺反异构一种位于双键同一侧,另一种位于双键的两测.顺-2-丁烯反-2-丁烯2-丁烯练习1
下列哪些物质存在顺反异构?
(A)1,2-二氯丙烯
(B) 2-丁烯
(C) 丙烯
(D) 1-丁烯形成顺反异构的条件
1.具有碳碳双键
2.组成双键的每个碳原子必须连接两个不同的原子,原子团.
练习2. 下列分子中不存在顺反异构现象的是( )
A、CH3CH=CHCH3
B、CH2=CH(CH2)3CH3
C、CH3CH=CH(CH2)2CH3
D、 CH3CH2CH=CHCH2CH3
B练习3. 在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构,请问在炔烃分子中是否也存在顺反异构?
三.物理性质根据表2-1中烷烃的沸点和相对密度,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图.结论随着碳原子数的递增,沸点逐渐升高,相对密度逐渐增大,常温下的存在状态,也由气态逐渐过渡到液态,固态.
类推
烷烃
烯烃 均符合这个规律
炔烃练习
①丁烷②2-甲基丙烷③正戊烷④2-甲基丁烷⑤2,2-二甲基丙烷等物质的沸点的排列顺序正确的是( )
A.①>②>③>④>⑤
B.⑤>④>③>②>①
C.③>④>⑤>①>②
D.②>①>⑤>④>③ ①看碳的个数
②看取代基的数目(若碳数相同),支链越多,熔沸点越低C四.化学性质思考与交流
写出下列反应并指出反应类型,说说你的分类依据.
(1)乙烷与氯气生成一氯乙烷的反应
(2)乙烯与溴的反应
(3)乙烯与水的反应
(4)乙烯生成聚乙烯的反应物质结构 化学性质总结出有机反应的类型:
取代 加成
聚合 氧化烷烃、烯烃的化学性质
【练习】如想制备一氯乙烷,是采用乙烷与氯气的取代反应还是用乙烯与氯化氢的加成反应,为什么?【练习】模仿乙烯制备聚乙烯,写出丙烯制
备聚丙烯的反应方程式。
【设问】根据乙烷、乙烯、乙炔的分子结构特点,你能否预测乙炔可能具有什么化学性质?
【情景创设】请根据乙烷、乙烯所能发生的化学反应来设计试验验证你所设想的乙炔的化学性质。演示实验试验装置如图P32
1.原料:CaC2与H2O2.原理:
CaC2 + H2O C2H2 + Ca(OH)2
3.装置:广口瓶和分液漏斗4.收集方法(参考乙炔的物理性质推出)5.净化:用CuSO4 洗气或NaOH
2 演示实验后让学生讨论如下问题:
1.试验中采用块状CaC2和饱和食盐水,为什么?
2.试验中为什么要采用分液漏斗?
3.制备时常用一团疏松的棉花塞在出口处,为什么?
4.反应后为什么要洗气?
防止反应过于剧烈控制滴水速度防止产生的泡沫进入导气管引起堵塞电石中含有CaS、Ca3P2等杂质,制得乙炔气
体中会含有H2S、PH3等气体5. 反应用固—液不加热装置,为什么不采用制备CO2和H2的装置?制CO2和H2的装置制C2H2的装置此反应为放热反应,易使启普发生器炸裂.
水与CaC2反应过于剧烈,甚至水蒸气与CaC2也极
易反应.
生成的Ca(OH)2微溶于水可堵塞球形漏斗的颈.物理性质乙炔是没有气味无色的气体,比空气轻,微溶于水,易溶于有机溶剂.
实验探究1. 乙炔燃烧实验
气体要验纯,在空气中燃烧,火焰明亮并伴有黑烟(与乙烯比较,联系乙烯的黑烟分析原因)
2C2H2 + 5O2 4CO2 +2H2O2. 乙炔使酸性高锰酸钾褪色
发生了氧化反应
点燃实验探究3.乙炔的加成反应
利用乙烯和溴的反应来推测乙炔与溴的反应方程式『练习』
如何用乙炔制备聚氯乙烯?请写出反应方程式? 乙炔的应用
1.古代戏台的照明
2. 现代焊接金属的氧炔焰3.国外正在研制的软杀伤反坦克的方法1991年1月,海湾战争爆发.以美国为首的多国部队
将伊拉克军队赶出科威特以后,开始向伊拉克大举
进攻,地面部队向前推进,势如破竹.地面部队为
什么能如此顺利地迅速前进呢?一个重要的原因是
因为用坦克和装甲车作先锋在前开路,发挥了重要
作用.所用的坦克是较为先进的第三代主战坦克,
它们无论在火力、防护能力或机动性等方面均有
较大的提高,使反坦克的空心装药破甲弹、碎甲弹
的效能大大降低.如何对付这种新的坦克呢?这里
介绍一种国外正在研制的新颖而独特的软杀伤反坦
克的方法——乙炔反坦克.
乙炔是一种无色的可燃性气体,它和空气的混合物中含有3%~81%体积的乙炔时,点火时会引起爆炸,反应为:
2CH CH+5O2 4CO2+2H2O+2600 kJ
乙炔不仅能和空气形成爆炸混合物,而且在高压下,未混有空气的乙炔受到敲打或碰击时也容易爆炸.反应为:
CH CH 2C+H2+227 kJ
人们利用乙炔的这些特点,在坦克、装甲车前进的路上,用飞机、火炮等进行大面积喷撒和发射乙炔气体,使乙炔吸入坦克和装甲车辆的发动机内,充当引爆剂,引燃油料,引起爆炸.
目前,一种乙炔榴弹即将问世.这种榴弹内装有水和碳化钙,使用时通过两种物质的混合产生乙炔气体.CaC2+2H2O Ca(OH)2+C2H2↑
使用一枚0.5 kg左右的乙炔榴弹,足可使一辆坦克丧失战斗能力.
这种反坦克的武器,具有灵巧、简单、价廉等特点,因此深受西方国家的青睐,不久的将来,可能将作为反坦克实战武器出现.
1.下列分子构型是直线型的是( )
A.C2H6 B.C2H4
C.C2H2 D.CH4
C
2、据报道,1995年化学家合成了一种分子式
为C200H200的含多个碳碳三键(—C C—)的
链状烃,其分子中含碳碳三键最多可以是( )
A.49个 B.50个
C.51个 D.100个
B
3、0.1 mol两种气态烃组成的混合气体完全燃
烧,得到0.16 mol CO2和3.6 g水.下列说法正
确的是( )
A.混合气体中一定有甲烷
B.混合气体一定是甲烷和乙烷
C.混合气体中一定没有乙烷
D.混合气体中一定有乙炔
AC
4、ZnC2,Al4C3,Mg2C3,Li2C2都能与水反应生
成气态烃,试判断下列反应中产物正确的是( )
A.ZnC2水解生成乙烷
B.Al4C3水解生成丙炔
C.Mg2C3水解生成丙炔
D.Li2C2水解生成乙烯
C
某炔烃加氢后得到,此炔烃的结构简式
为 ,名称
是 。
常温常压下,下列4种气体各取1mol分别在足量的
氧气中燃烧,消耗氧气最多的是( )
A.甲烷 B.乙烯
C.乙炔 D.丙烷
D有烷烃和炔烃的混合气体200毫升,在催化剂存在
下,与氢气完全进行加成反应,消耗氢气100毫升。
(相同条件),则原混合气中烷烃与炔烃的物质的
量之比为( )
A.1∶3 B.3∶1
C.2∶1 D.1∶1
B
a毫升A、B、C三种气态烃的混合物跟足量氧气混
合点燃后,恢复到原常温常压状态,气体体积缩小
了2a毫升,那么A、B、C三种烃可能是( )
A.CH4、C2H6、C3H8
B.C2H4、C2H2、CH4
C.CH4、C2H4、C3H4
D.C2H6、C3H6、C4H6
B电石中的碳化钙和水能完全反应,使反应产生的气体排水,测量出水的体积,可计算出标准状况,乙炔的体积,从而测定电石中碳化钙的含量:
(1)若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器,导管的序号)是 接 接 接 接 接 。 631524(1)若实验中产生的气体在难闻的气味,且
测定结果偏大,这是因为电石中含
有 .
(2)若实验时称取的电石为1.60克,测量出排
出水的体积后,折算成标准状况乙炔的体积
为448毫升,此时碳化钙的质量分数
为 。
其它跟水反应生成气体的杂质 80%
常压分馏和减压分馏
石油的催化裂化和裂解
石油的分馏:原油脱盐脱水石油 常压分馏石油气(C1~C4)汽油(C5~C11)煤油(C10~C16)柴油(C15~C18)重油重油减压分馏重柴油轻润滑油中润滑油
重润滑油
渣油石油裂化:
在一定条件下,把分子量大, 沸点高的烃断裂为分子量小、沸点低的烃的过程。如:C16H34 C8H18+C8H16
C8H18 C4H10 + C4H8
C4H10 CH4+C3H6
C4H10 C2H4+C2H6
石油有热裂化和催化裂化两种裂解石油的分馏产品定义:使具有长链分子的烃在700度以上高温时断裂成短链的烃的过程叫裂解目的:生产短链不饱和烃如工业“三烯”乙烯的产量作为衡量石油化工发展水平的标志用途:合成纤维,塑料,橡胶等脂肪烃的来源及应用石油:烷烃、环烷烃
天然气:甲烷(体积分数约占80%-90%)
煤:芳香烃二.烷烃、烯烃、炔烃的结构情景创设『问题』在乙烯的球棍模型中,如果将乙烯分子中的两个不同碳上的一个氢原子用甲基取代,试看能得到几种不同结构的分子? 烯烃的顺反异构一种位于双键同一侧,另一种位于双键的两测.顺-2-丁烯反-2-丁烯2-丁烯练习1
下列哪些物质存在顺反异构?
(A)1,2-二氯丙烯
(B) 2-丁烯
(C) 丙烯
(D) 1-丁烯形成顺反异构的条件
1.具有碳碳双键
2.组成双键的每个碳原子必须连接两个不同的原子,原子团.
练习2. 下列分子中不存在顺反异构现象的是( )
A、CH3CH=CHCH3
B、CH2=CH(CH2)3CH3
C、CH3CH=CH(CH2)2CH3
D、 CH3CH2CH=CHCH2CH3
B练习3. 在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构,请问在炔烃分子中是否也存在顺反异构?
三.物理性质根据表2-1中烷烃的沸点和相对密度,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图.结论随着碳原子数的递增,沸点逐渐升高,相对密度逐渐增大,常温下的存在状态,也由气态逐渐过渡到液态,固态.
类推
烷烃
烯烃 均符合这个规律
炔烃练习
①丁烷②2-甲基丙烷③正戊烷④2-甲基丁烷⑤2,2-二甲基丙烷等物质的沸点的排列顺序正确的是( )
A.①>②>③>④>⑤
B.⑤>④>③>②>①
C.③>④>⑤>①>②
D.②>①>⑤>④>③ ①看碳的个数
②看取代基的数目(若碳数相同),支链越多,熔沸点越低C四.化学性质思考与交流
写出下列反应并指出反应类型,说说你的分类依据.
(1)乙烷与氯气生成一氯乙烷的反应
(2)乙烯与溴的反应
(3)乙烯与水的反应
(4)乙烯生成聚乙烯的反应物质结构 化学性质总结出有机反应的类型:
取代 加成
聚合 氧化烷烃、烯烃的化学性质
【练习】如想制备一氯乙烷,是采用乙烷与氯气的取代反应还是用乙烯与氯化氢的加成反应,为什么?【练习】模仿乙烯制备聚乙烯,写出丙烯制
备聚丙烯的反应方程式。
【设问】根据乙烷、乙烯、乙炔的分子结构特点,你能否预测乙炔可能具有什么化学性质?
【情景创设】请根据乙烷、乙烯所能发生的化学反应来设计试验验证你所设想的乙炔的化学性质。演示实验试验装置如图P32
1.原料:CaC2与H2O2.原理:
CaC2 + H2O C2H2 + Ca(OH)2
3.装置:广口瓶和分液漏斗4.收集方法(参考乙炔的物理性质推出)5.净化:用CuSO4 洗气或NaOH
2 演示实验后让学生讨论如下问题:
1.试验中采用块状CaC2和饱和食盐水,为什么?
2.试验中为什么要采用分液漏斗?
3.制备时常用一团疏松的棉花塞在出口处,为什么?
4.反应后为什么要洗气?
防止反应过于剧烈控制滴水速度防止产生的泡沫进入导气管引起堵塞电石中含有CaS、Ca3P2等杂质,制得乙炔气
体中会含有H2S、PH3等气体5. 反应用固—液不加热装置,为什么不采用制备CO2和H2的装置?制CO2和H2的装置制C2H2的装置此反应为放热反应,易使启普发生器炸裂.
水与CaC2反应过于剧烈,甚至水蒸气与CaC2也极
易反应.
生成的Ca(OH)2微溶于水可堵塞球形漏斗的颈.物理性质乙炔是没有气味无色的气体,比空气轻,微溶于水,易溶于有机溶剂.
实验探究1. 乙炔燃烧实验
气体要验纯,在空气中燃烧,火焰明亮并伴有黑烟(与乙烯比较,联系乙烯的黑烟分析原因)
2C2H2 + 5O2 4CO2 +2H2O2. 乙炔使酸性高锰酸钾褪色
发生了氧化反应
点燃实验探究3.乙炔的加成反应
利用乙烯和溴的反应来推测乙炔与溴的反应方程式『练习』
如何用乙炔制备聚氯乙烯?请写出反应方程式? 乙炔的应用
1.古代戏台的照明
2. 现代焊接金属的氧炔焰3.国外正在研制的软杀伤反坦克的方法1991年1月,海湾战争爆发.以美国为首的多国部队
将伊拉克军队赶出科威特以后,开始向伊拉克大举
进攻,地面部队向前推进,势如破竹.地面部队为
什么能如此顺利地迅速前进呢?一个重要的原因是
因为用坦克和装甲车作先锋在前开路,发挥了重要
作用.所用的坦克是较为先进的第三代主战坦克,
它们无论在火力、防护能力或机动性等方面均有
较大的提高,使反坦克的空心装药破甲弹、碎甲弹
的效能大大降低.如何对付这种新的坦克呢?这里
介绍一种国外正在研制的新颖而独特的软杀伤反坦
克的方法——乙炔反坦克.
乙炔是一种无色的可燃性气体,它和空气的混合物中含有3%~81%体积的乙炔时,点火时会引起爆炸,反应为:
2CH CH+5O2 4CO2+2H2O+2600 kJ
乙炔不仅能和空气形成爆炸混合物,而且在高压下,未混有空气的乙炔受到敲打或碰击时也容易爆炸.反应为:
CH CH 2C+H2+227 kJ
人们利用乙炔的这些特点,在坦克、装甲车前进的路上,用飞机、火炮等进行大面积喷撒和发射乙炔气体,使乙炔吸入坦克和装甲车辆的发动机内,充当引爆剂,引燃油料,引起爆炸.
目前,一种乙炔榴弹即将问世.这种榴弹内装有水和碳化钙,使用时通过两种物质的混合产生乙炔气体.CaC2+2H2O Ca(OH)2+C2H2↑
使用一枚0.5 kg左右的乙炔榴弹,足可使一辆坦克丧失战斗能力.
这种反坦克的武器,具有灵巧、简单、价廉等特点,因此深受西方国家的青睐,不久的将来,可能将作为反坦克实战武器出现.
1.下列分子构型是直线型的是( )
A.C2H6 B.C2H4
C.C2H2 D.CH4
C
2、据报道,1995年化学家合成了一种分子式
为C200H200的含多个碳碳三键(—C C—)的
链状烃,其分子中含碳碳三键最多可以是( )
A.49个 B.50个
C.51个 D.100个
B
3、0.1 mol两种气态烃组成的混合气体完全燃
烧,得到0.16 mol CO2和3.6 g水.下列说法正
确的是( )
A.混合气体中一定有甲烷
B.混合气体一定是甲烷和乙烷
C.混合气体中一定没有乙烷
D.混合气体中一定有乙炔
AC
4、ZnC2,Al4C3,Mg2C3,Li2C2都能与水反应生
成气态烃,试判断下列反应中产物正确的是( )
A.ZnC2水解生成乙烷
B.Al4C3水解生成丙炔
C.Mg2C3水解生成丙炔
D.Li2C2水解生成乙烯
C
某炔烃加氢后得到,此炔烃的结构简式
为 ,名称
是 。
常温常压下,下列4种气体各取1mol分别在足量的
氧气中燃烧,消耗氧气最多的是( )
A.甲烷 B.乙烯
C.乙炔 D.丙烷
D有烷烃和炔烃的混合气体200毫升,在催化剂存在
下,与氢气完全进行加成反应,消耗氢气100毫升。
(相同条件),则原混合气中烷烃与炔烃的物质的
量之比为( )
A.1∶3 B.3∶1
C.2∶1 D.1∶1
B
a毫升A、B、C三种气态烃的混合物跟足量氧气混
合点燃后,恢复到原常温常压状态,气体体积缩小
了2a毫升,那么A、B、C三种烃可能是( )
A.CH4、C2H6、C3H8
B.C2H4、C2H2、CH4
C.CH4、C2H4、C3H4
D.C2H6、C3H6、C4H6
B电石中的碳化钙和水能完全反应,使反应产生的气体排水,测量出水的体积,可计算出标准状况,乙炔的体积,从而测定电石中碳化钙的含量:
(1)若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器,导管的序号)是 接 接 接 接 接 。 631524(1)若实验中产生的气体在难闻的气味,且
测定结果偏大,这是因为电石中含
有 .
(2)若实验时称取的电石为1.60克,测量出排
出水的体积后,折算成标准状况乙炔的体积
为448毫升,此时碳化钙的质量分数
为 。
其它跟水反应生成气体的杂质 80%
