离子键 离子晶体[上学期]
图片预览





文档简介
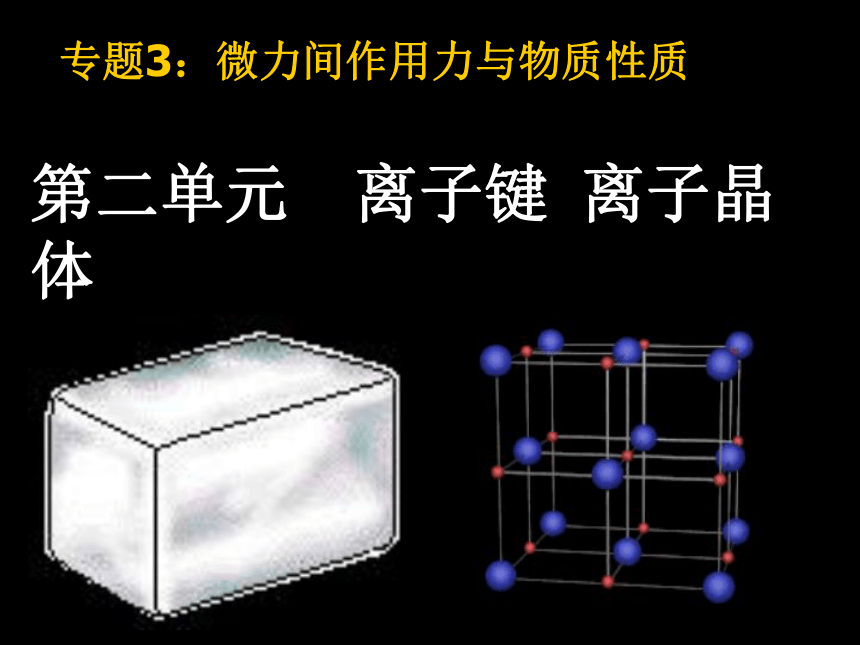
课件18张PPT。第二单元 离子键 离子晶体专题3:微力间作用力与物质性质一、离子键的形成电子
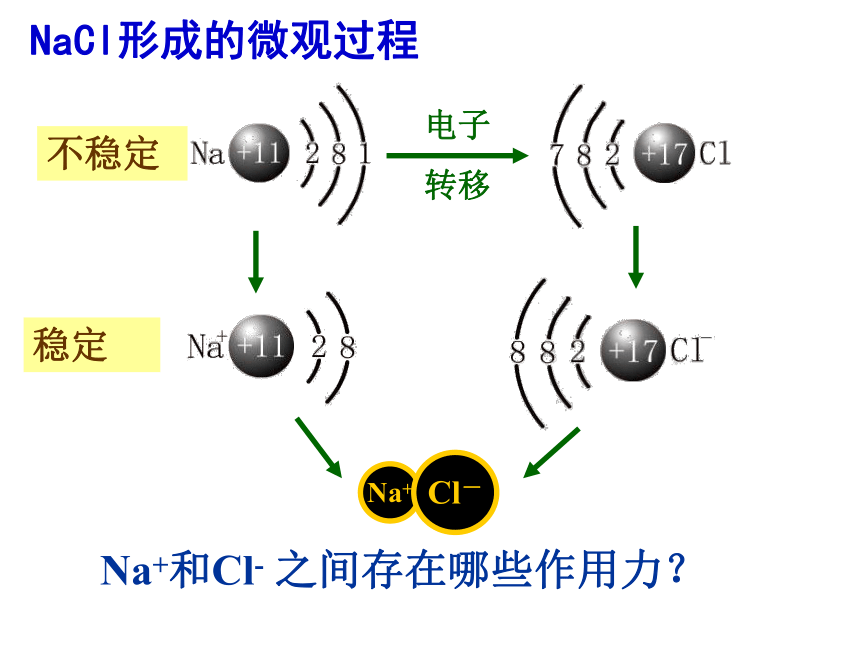
转移NaCl形成的微观过程Na+和Cl- 之间存在哪些作用力?一、离子键定义:使阴、阳离子结合成化合物的静电作用易形成阳离子的元素
易形成阴离子的元素成键粒子:阴、阳离子成键元素(一般情况):成键性质:静电作用(吸引与排斥)活泼金属元素(IA、IIA)活泼非金属元素(VIA、VIIA)含有离子键的化合物一定是离子化合物注意区分: 用电子式表示物质
用电子式表示物质形成过程强碱、大多数盐、典型金属氧化物等含有离子键的物质离子键没有方向性和饱和性!重晶石 BaSO4明矾 KAl(SO4)2莹石 CaF2胆矾 CuSO4·5H2O方解石 CaCO3石膏 CaSO4·2H2O食盐 NaCl 离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl不表示分子式。
熔沸点较高,硬度较大,难挥发难压缩
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。Na ClCs Cl二、离子晶体 晶格能:拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。
晶格能越大,表明离子晶体中的离子键越牢固,离子晶体的熔点越高、硬度越大。离子晶体中的离子配位数阴、阳离子半径比与配位数的关系三种典型立方晶体结构简单立方体心立方面心立方氯化钠的晶体结构 回离子晶体氯化铯的晶体结构 回离子晶体氯化钠晶体中每个氯离子周围有8个铯离子,每个铯离子周围有8个氯离子
转移NaCl形成的微观过程Na+和Cl- 之间存在哪些作用力?一、离子键定义:使阴、阳离子结合成化合物的静电作用易形成阳离子的元素
易形成阴离子的元素成键粒子:阴、阳离子成键元素(一般情况):成键性质:静电作用(吸引与排斥)活泼金属元素(IA、IIA)活泼非金属元素(VIA、VIIA)含有离子键的化合物一定是离子化合物注意区分: 用电子式表示物质
用电子式表示物质形成过程强碱、大多数盐、典型金属氧化物等含有离子键的物质离子键没有方向性和饱和性!重晶石 BaSO4明矾 KAl(SO4)2莹石 CaF2胆矾 CuSO4·5H2O方解石 CaCO3石膏 CaSO4·2H2O食盐 NaCl 离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl不表示分子式。
熔沸点较高,硬度较大,难挥发难压缩
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。Na ClCs Cl二、离子晶体 晶格能:拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。
晶格能越大,表明离子晶体中的离子键越牢固,离子晶体的熔点越高、硬度越大。离子晶体中的离子配位数阴、阳离子半径比与配位数的关系三种典型立方晶体结构简单立方体心立方面心立方氯化钠的晶体结构 回离子晶体氯化铯的晶体结构 回离子晶体氯化钠晶体中每个氯离子周围有8个铯离子,每个铯离子周围有8个氯离子
