分子晶体和原子晶体[下学期]
文档属性
| 名称 | 分子晶体和原子晶体[下学期] |
|
|
| 格式 | rar | ||
| 文件大小 | 947.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-03-16 00:00:00 | ||
图片预览









文档简介
课件39张PPT。第二节 分子晶体和原子晶体微粒为分子:
分子间作用力(范德华力或氢键) ;
微粒为原子:
极性共价键或非极性共价键;
微粒为离子:
离子键;
微粒为金属原子:
金属键。微粒间作用力复习一、分子晶体1、概念:
分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。
2、组成粒子:
3、粒子间的作用力:分子分子间作用力(1)所有非金属氢化物: H2O, H2S, NH3, CH4, HX
(2)部分非金属单质: X2, N2, O2, H2, S8, P4, C60
(3)部分非金属氧化物: CO2, SO2, N2O4, P4O6, P4O10
(4)几乎所有的酸: H2SO4, HNO3, H3PO4
(5)大多数有机物: 乙醇,冰醋酸,蔗糖4、典型的分子晶体5、分子晶体的特征(1)性质特征:
(2)结构特征:分子晶体有哪些物理特性,为什么?思考与交流 由于分子间作用力很弱,所以分子晶体一般具有:
① 低熔点、低沸点、高挥发性(升华);
② 硬度很小;
③ 一般都是绝缘体,熔融状态也不导电;
④ 溶解性?(1)物理特性5、分子晶体的特征——“相似相溶”规律〖思考1〗是不是在分子晶体中分子间只存在范德华力?
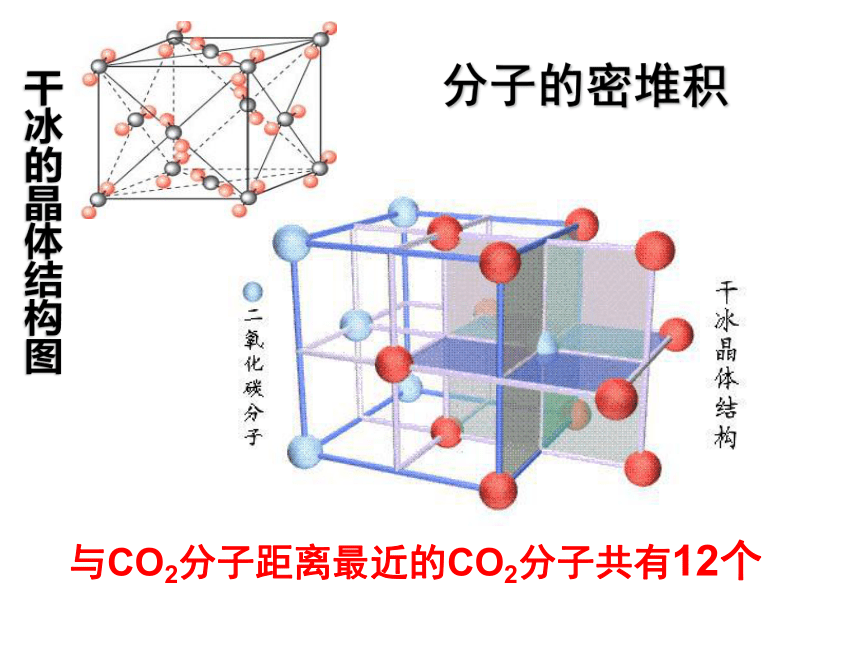
不对,分子间氢键也是一种分子间作用力,如冰中就同时存着范德华力和氢键。如:HF 、冰、NH3(2)结构特征5、分子晶体的特征①只有范德华力,无分子间氢键:分子密堆积(每个分子周围有12个紧邻的分子)
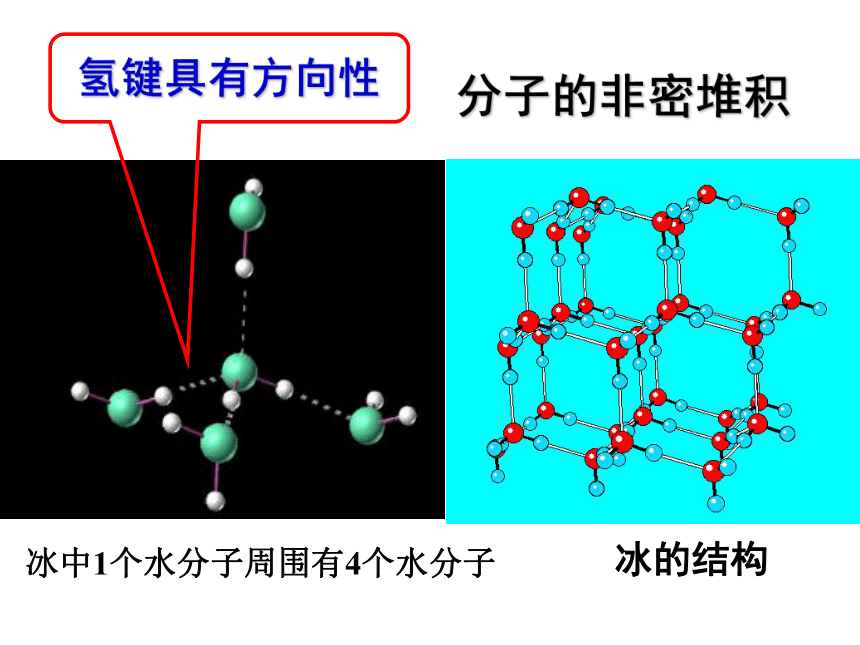
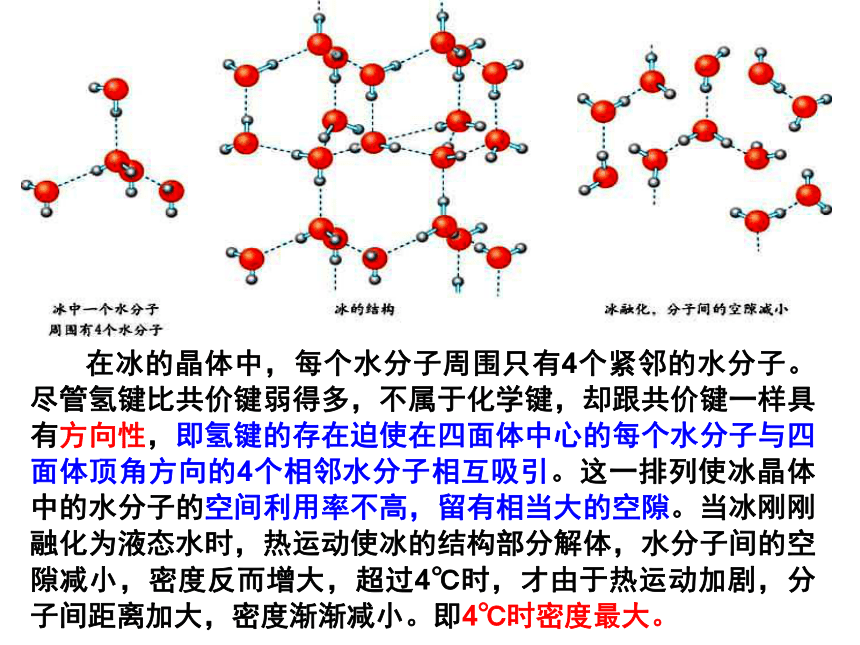
如:C60、干冰 、I2、O2②还有分子间氢键:不具有分子密堆积特征分子的密堆积(与每个分子距离最近的相同分子分子共有12个 )与CO2分子距离最近的CO2分子共有12个 分子的密堆积干冰的晶体结构图冰中1个水分子周围有4个水分子冰的结构氢键具有方向性分子的非密堆积 在冰的晶体中,每个水分子周围只有4个紧邻的水分子。尽管氢键比共价键弱得多,不属于化学键,却跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小。即4℃时密度最大。如:HF 、冰、NH3(2)结构特征5、分子晶体的特征①只有范德华力,无分子间氢键:分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、I2、O2②还有分子间氢键:不具有分子密堆积特征〖思考2〗为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点
比干冰高。
由于分子间作用力特别是氢键的方向性,导致晶体冰中有相当大的空隙,所以
相同状况下体积较大;
由于CO2分子的相对分子质量>H2O,
所以干冰的密度大。笼状化合物科学视野:
天然气水合物——一种潜在的能源【思考与交流】 CO2和SiO2的一些物理性质如下表所示,
通过比较试判断SiO2晶体是否属于分子晶体。1、概念:
2、组成粒子:
3、粒子间的作用力:金刚石二、原子晶体 相邻原子间以共价键相结合而形成空间立体网状结构的晶体。(共价晶体)原子共价键4、典型的原子晶体
(1)某些非金属单质:
金刚石(C)、晶体硅(Si)、
晶体硼(B)、晶体锗(Ge)等
(2)某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
氮化硅(Si3N4)晶体、氮化铝(AlN)晶体
(3)某些氧化物:
二氧化硅( SiO2)晶体、氧化铝晶体 对比分子晶体和原子晶体的数据,原子晶体有哪些物理特性? 在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的:
(1)熔点、沸点很高
(2)硬度很大
(3)一般不导电
(4)不溶于一般的溶剂5、原子晶体的物理特征 原子晶体具备以上物理性质的原因:
________________________________ ________________________________
原子晶体的化学式是否可以代表其
分子式____________
原因____________________________
________________________原子晶体中原子与原子靠共价键结合,键能很大,不易被破坏。否原子晶体是一个三维的网状结构,无小分子存在。109o28′金刚石的晶体结构示意图共价键典型的原子晶体:
1、金刚石(晶体硅结构与此类似)(1)结构:每个碳原子被相邻的4个碳原子包围,以共价键跟4个碳原子结合,形成四面体。这些四面体向空间发展,构成一个坚实的、彼此联结的空间网状晶体。每个 C—C键长相等,键角均为 。(2)晶体中最小环由____个C组成,且不共面。6(3)晶体中C原子数与C—C 键数之比为:109°28′6×1/4 : 6×1/2 = 1 : 2(4)石墨虽和金刚石都是由
碳原子形成的单质,但
石墨是一种混合型晶体:
层内存在共价键,
层间以范德华力结合,
兼具有原子晶体、分子晶体
的特征。 层内,每个碳原子与
其他3个碳原子形成C—C键,
构成 ,键角为 ,形成平面网状结构,因此,石墨的熔点很高;但在层与层之间以范德华力结合,容易滑动,因此石墨的硬度很小。正六边形120°180o109o28′SiO二氧化硅的晶体结构示意图共价键 在二氧化硅的晶体结构中,最小的环由几个原子构成?最小环由 个原子构成
( 个Si 个O ),
只是每个环占有的原子个数不同,
原子可能占据几个环,
所以原子个数最简比为? 1266Si
O6×1/4 = 1.56×1/2 = 3Si : O = 1.5 : 3 = 1 : 2原子晶体与分子晶体的比较1、对于组成结构相似的物质,相对分子质量
2、极性分子非极性分子
3、氢键作用分子原子分子间作用力
(范德华力、氢键)共价键低高键长
键能一般不导电一般不导电能不能小结:相邻原子间以共价键相结合而形成空间网状结构分子间以分子间作用力结合原子分子共价键分子间作用力很大较小很大较小不溶于任何溶剂部分溶于水不导电,个别为半导体固体和熔化状态都不导电,部分溶于水导电解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高
金刚石 > 碳化硅 > 晶体硅学与问1、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么? 一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。有金属光泽。六方晶系,成叶片状、鳞片状和致密块状。密度2.25g/cm3,化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。石墨可用作润滑剂,并用于制造坩锅、电极、铅笔芯等。 知识拓展-石墨石墨晶体结构知识拓展-石墨石墨1、石墨为什么很软?
2、石墨的熔沸点为什么很高(高于金刚石)?3、石墨属于哪类晶体?为什么?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。石墨各层均为平面网状结构,碳原子之间存在很强的共价键(大π键),故熔沸点很高。石墨为混合键型晶体。归纳1:两个晶体的熔沸点的比较
1、判断二者晶体类型:
一般情况下,原子晶体、离子晶体的熔沸点都高于分子晶体。
2、如果是同种晶体,比较晶体内各微粒之间相互作用力的大小。 归纳2:非金属单质是原子晶体还是分子晶体,可从以下角度进行分析判断:
(1)依据组成晶体的粒子和粒子间的作用判断
原子晶体的粒子是_________,质点间的作用是________________________;
分子晶体的粒子是_________,质点间的作用是________________________。
(2)记忆常见的、典型的原子晶体
a、单质:______________________________________
b、化合物:____________________________________原子共价键分子分子间作用力(某些含有氢键)金刚石、晶体硅、晶体硼SiO2、SiC、BN(3)依据晶体的熔点判断
原子晶体熔、沸点高,常在1000℃以上;
分子晶体熔、沸点低,常在数百度以下至很低的温度。
(4)依据导电性判断
分子晶体为非导体,但部分分子晶体溶于水后能导电;
原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断
原子晶体硬度大,分子晶体硬度小且较脆。例、如右图所示,在石墨晶体的层状结构中,每一个最小的碳环完全拥有碳原子数为___,每个C完全拥有C-C数为___其密度为___。石墨中C-C夹角为120☉, C-C键长为 1.42×10-10 m层间距
3.35× 10-10 m23小结:金刚石、石墨的比较每个环中正四面体空间网状六边形平面层状共价键共价键与范德华力6个原子不同面6个原子同面436*1/2=36*1/2=36*1/4=3/26*1/3=2
分子间作用力(范德华力或氢键) ;
微粒为原子:
极性共价键或非极性共价键;
微粒为离子:
离子键;
微粒为金属原子:
金属键。微粒间作用力复习一、分子晶体1、概念:
分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。
2、组成粒子:
3、粒子间的作用力:分子分子间作用力(1)所有非金属氢化物: H2O, H2S, NH3, CH4, HX
(2)部分非金属单质: X2, N2, O2, H2, S8, P4, C60
(3)部分非金属氧化物: CO2, SO2, N2O4, P4O6, P4O10
(4)几乎所有的酸: H2SO4, HNO3, H3PO4
(5)大多数有机物: 乙醇,冰醋酸,蔗糖4、典型的分子晶体5、分子晶体的特征(1)性质特征:
(2)结构特征:分子晶体有哪些物理特性,为什么?思考与交流 由于分子间作用力很弱,所以分子晶体一般具有:
① 低熔点、低沸点、高挥发性(升华);
② 硬度很小;
③ 一般都是绝缘体,熔融状态也不导电;
④ 溶解性?(1)物理特性5、分子晶体的特征——“相似相溶”规律〖思考1〗是不是在分子晶体中分子间只存在范德华力?
不对,分子间氢键也是一种分子间作用力,如冰中就同时存着范德华力和氢键。如:HF 、冰、NH3(2)结构特征5、分子晶体的特征①只有范德华力,无分子间氢键:分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、I2、O2②还有分子间氢键:不具有分子密堆积特征分子的密堆积(与每个分子距离最近的相同分子分子共有12个 )与CO2分子距离最近的CO2分子共有12个 分子的密堆积干冰的晶体结构图冰中1个水分子周围有4个水分子冰的结构氢键具有方向性分子的非密堆积 在冰的晶体中,每个水分子周围只有4个紧邻的水分子。尽管氢键比共价键弱得多,不属于化学键,却跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小。即4℃时密度最大。如:HF 、冰、NH3(2)结构特征5、分子晶体的特征①只有范德华力,无分子间氢键:分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、I2、O2②还有分子间氢键:不具有分子密堆积特征〖思考2〗为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点
比干冰高。
由于分子间作用力特别是氢键的方向性,导致晶体冰中有相当大的空隙,所以
相同状况下体积较大;
由于CO2分子的相对分子质量>H2O,
所以干冰的密度大。笼状化合物科学视野:
天然气水合物——一种潜在的能源【思考与交流】 CO2和SiO2的一些物理性质如下表所示,
通过比较试判断SiO2晶体是否属于分子晶体。1、概念:
2、组成粒子:
3、粒子间的作用力:金刚石二、原子晶体 相邻原子间以共价键相结合而形成空间立体网状结构的晶体。(共价晶体)原子共价键4、典型的原子晶体
(1)某些非金属单质:
金刚石(C)、晶体硅(Si)、
晶体硼(B)、晶体锗(Ge)等
(2)某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
氮化硅(Si3N4)晶体、氮化铝(AlN)晶体
(3)某些氧化物:
二氧化硅( SiO2)晶体、氧化铝晶体 对比分子晶体和原子晶体的数据,原子晶体有哪些物理特性? 在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的:
(1)熔点、沸点很高
(2)硬度很大
(3)一般不导电
(4)不溶于一般的溶剂5、原子晶体的物理特征 原子晶体具备以上物理性质的原因:
________________________________ ________________________________
原子晶体的化学式是否可以代表其
分子式____________
原因____________________________
________________________原子晶体中原子与原子靠共价键结合,键能很大,不易被破坏。否原子晶体是一个三维的网状结构,无小分子存在。109o28′金刚石的晶体结构示意图共价键典型的原子晶体:
1、金刚石(晶体硅结构与此类似)(1)结构:每个碳原子被相邻的4个碳原子包围,以共价键跟4个碳原子结合,形成四面体。这些四面体向空间发展,构成一个坚实的、彼此联结的空间网状晶体。每个 C—C键长相等,键角均为 。(2)晶体中最小环由____个C组成,且不共面。6(3)晶体中C原子数与C—C 键数之比为:109°28′6×1/4 : 6×1/2 = 1 : 2(4)石墨虽和金刚石都是由
碳原子形成的单质,但
石墨是一种混合型晶体:
层内存在共价键,
层间以范德华力结合,
兼具有原子晶体、分子晶体
的特征。 层内,每个碳原子与
其他3个碳原子形成C—C键,
构成 ,键角为 ,形成平面网状结构,因此,石墨的熔点很高;但在层与层之间以范德华力结合,容易滑动,因此石墨的硬度很小。正六边形120°180o109o28′SiO二氧化硅的晶体结构示意图共价键 在二氧化硅的晶体结构中,最小的环由几个原子构成?最小环由 个原子构成
( 个Si 个O ),
只是每个环占有的原子个数不同,
原子可能占据几个环,
所以原子个数最简比为? 1266Si
O6×1/4 = 1.56×1/2 = 3Si : O = 1.5 : 3 = 1 : 2原子晶体与分子晶体的比较1、对于组成结构相似的物质,相对分子质量
2、极性分子非极性分子
3、氢键作用分子原子分子间作用力
(范德华力、氢键)共价键低高键长
键能一般不导电一般不导电能不能小结:相邻原子间以共价键相结合而形成空间网状结构分子间以分子间作用力结合原子分子共价键分子间作用力很大较小很大较小不溶于任何溶剂部分溶于水不导电,个别为半导体固体和熔化状态都不导电,部分溶于水导电解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高
金刚石 > 碳化硅 > 晶体硅学与问1、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么? 一种结晶形碳,有天然出产的矿物。铁黑色至深钢灰色。质软具滑腻感,可沾污手指成灰黑色。有金属光泽。六方晶系,成叶片状、鳞片状和致密块状。密度2.25g/cm3,化学性质不活泼。具有耐腐蚀性,在空气或氧气中强热可以燃烧生成二氧化碳。石墨可用作润滑剂,并用于制造坩锅、电极、铅笔芯等。 知识拓展-石墨石墨晶体结构知识拓展-石墨石墨1、石墨为什么很软?
2、石墨的熔沸点为什么很高(高于金刚石)?3、石墨属于哪类晶体?为什么?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。石墨各层均为平面网状结构,碳原子之间存在很强的共价键(大π键),故熔沸点很高。石墨为混合键型晶体。归纳1:两个晶体的熔沸点的比较
1、判断二者晶体类型:
一般情况下,原子晶体、离子晶体的熔沸点都高于分子晶体。
2、如果是同种晶体,比较晶体内各微粒之间相互作用力的大小。 归纳2:非金属单质是原子晶体还是分子晶体,可从以下角度进行分析判断:
(1)依据组成晶体的粒子和粒子间的作用判断
原子晶体的粒子是_________,质点间的作用是________________________;
分子晶体的粒子是_________,质点间的作用是________________________。
(2)记忆常见的、典型的原子晶体
a、单质:______________________________________
b、化合物:____________________________________原子共价键分子分子间作用力(某些含有氢键)金刚石、晶体硅、晶体硼SiO2、SiC、BN(3)依据晶体的熔点判断
原子晶体熔、沸点高,常在1000℃以上;
分子晶体熔、沸点低,常在数百度以下至很低的温度。
(4)依据导电性判断
分子晶体为非导体,但部分分子晶体溶于水后能导电;
原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断
原子晶体硬度大,分子晶体硬度小且较脆。例、如右图所示,在石墨晶体的层状结构中,每一个最小的碳环完全拥有碳原子数为___,每个C完全拥有C-C数为___其密度为___。石墨中C-C夹角为120☉, C-C键长为 1.42×10-10 m层间距
3.35× 10-10 m23小结:金刚石、石墨的比较每个环中正四面体空间网状六边形平面层状共价键共价键与范德华力6个原子不同面6个原子同面436*1/2=36*1/2=36*1/4=3/26*1/3=2
