分子间作用力与晶体类型[上学期]
文档属性
| 名称 | 分子间作用力与晶体类型[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 144.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-10 11:14:00 | ||
图片预览








文档简介
课件21张PPT。晶体类型与分子间作用力第三课时2019年2月27日星期三分子间作用力(范德华力)分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
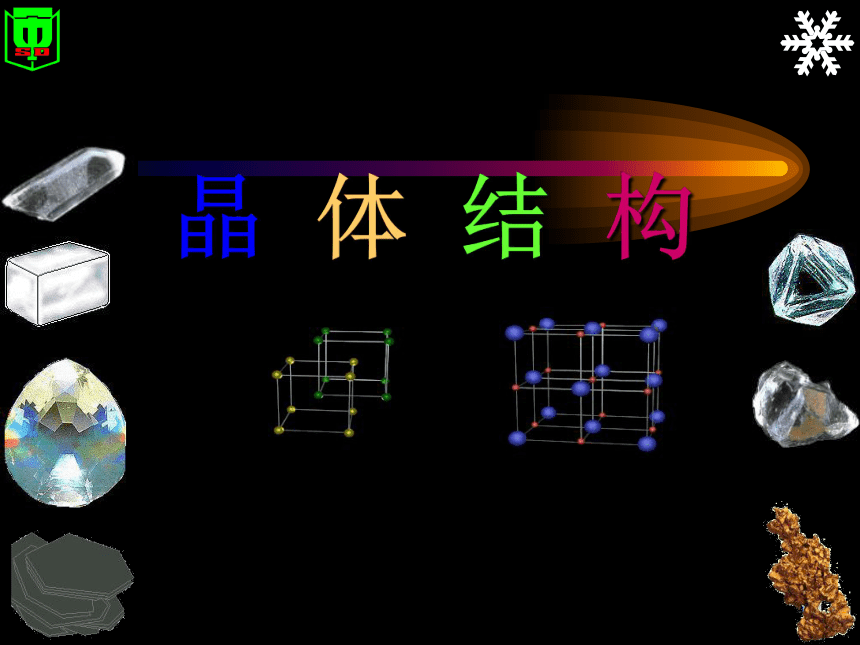
强度:化学键的键能为120~800kJ/mol,而分子间作用力只有几到几十kJ/mol。 分子晶体 原子晶体 离子晶体晶 体 结 构晶体的概念什么叫晶体?
通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒(分子、原子或离子)按一定的规则排列。
构成晶体的基本微粒和作用力阴阳离子
分子
原子阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,形成 分子晶体。
原子间以共价键结合,形成原子晶体。离子晶体什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl 和CsCl不是表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。 分子晶体 原子晶体幻灯片 15Na Cl请你想想 为什么NaCl的熔沸点比CsCl高? Na+半径比Cs+ 小 Na+与Cl- 的相互作用比Cs+与Cl- 的相互作用强 Na+ 与Cs+ 均带一个单位正电荷, 阴离子均为氯离子。 NaCl晶体中的离子键较强, NaCl晶体的熔沸点较高。结论:对于组成和结构相似的物质,阴阳离子半径之和较小,离子键较强,熔沸点较高.分子晶体什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO、SO2)等。 原子晶体 离子晶体 分子间作用力对物质的熔点、沸点何影响? 分子间作用力越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔沸点越高。请解释,卤素单质熔沸点变化规律。 氟、氯、溴、碘的单质均是分子晶体,双原子分子,每个分子都是通过一个单键结合而成,随着分子量的增大,分子间作用力增大,故熔沸点递升。结论:分子组成和结构相似时,分子量越大,分子间作用力越大。比较H2O、 H2S 、H2Se、 H2Te返回氢 键 1、氢键的形成条件:
2、氢键的表示方法:
3、氢键的形成过程: ★分子中有氢原子和得电子能力强的原子,如:N、O、F; ★在两原子间用 · · · 表示导学大课堂P344、氢键的特点:比化学键弱的多,比分子间作用力稍强。5、氢键的存在对物质熔沸点的影响: ★氢键的存在使物质的熔、沸点相对较高1、如果水分子之间没有氢键存在,地球上将会出现什么面貌?讨论:2、冰的密度为什么比液态水的小?2.分子间作用力3.决定晶体物理性质的因素是构成晶体微粒之间的结合力结合力越强,晶体的熔沸点越高,晶体的硬度越大。1.离子晶体、分子晶体小结作业导学大课堂NaCl的晶体结构示意图CsCl的晶体结构示意图返回氢键的形成过程氢键共价键返回范德华力共价键干冰的晶体结构示意图返回分子间作用力(范德华力)——分子与分子间的作用力(把分子 聚集在一起的作用力)。化学键 与分子间作用力的比较相邻原子(分子内部)分子之间大小主要影响物质的化学性质主要影响物质的物理性质(熔、沸点)分子间作用力比化学键弱得多
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
强度:化学键的键能为120~800kJ/mol,而分子间作用力只有几到几十kJ/mol。 分子晶体 原子晶体 离子晶体晶 体 结 构晶体的概念什么叫晶体?
通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒(分子、原子或离子)按一定的规则排列。
构成晶体的基本微粒和作用力阴阳离子
分子
原子阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,形成 分子晶体。
原子间以共价键结合,形成原子晶体。离子晶体什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl 和CsCl不是表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。 分子晶体 原子晶体幻灯片 15Na Cl请你想想 为什么NaCl的熔沸点比CsCl高? Na+半径比Cs+ 小 Na+与Cl- 的相互作用比Cs+与Cl- 的相互作用强 Na+ 与Cs+ 均带一个单位正电荷, 阴离子均为氯离子。 NaCl晶体中的离子键较强, NaCl晶体的熔沸点较高。结论:对于组成和结构相似的物质,阴阳离子半径之和较小,离子键较强,熔沸点较高.分子晶体什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO、SO2)等。 原子晶体 离子晶体 分子间作用力对物质的熔点、沸点何影响? 分子间作用力越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔沸点越高。请解释,卤素单质熔沸点变化规律。 氟、氯、溴、碘的单质均是分子晶体,双原子分子,每个分子都是通过一个单键结合而成,随着分子量的增大,分子间作用力增大,故熔沸点递升。结论:分子组成和结构相似时,分子量越大,分子间作用力越大。比较H2O、 H2S 、H2Se、 H2Te返回氢 键 1、氢键的形成条件:
2、氢键的表示方法:
3、氢键的形成过程: ★分子中有氢原子和得电子能力强的原子,如:N、O、F; ★在两原子间用 · · · 表示导学大课堂P344、氢键的特点:比化学键弱的多,比分子间作用力稍强。5、氢键的存在对物质熔沸点的影响: ★氢键的存在使物质的熔、沸点相对较高1、如果水分子之间没有氢键存在,地球上将会出现什么面貌?讨论:2、冰的密度为什么比液态水的小?2.分子间作用力3.决定晶体物理性质的因素是构成晶体微粒之间的结合力结合力越强,晶体的熔沸点越高,晶体的硬度越大。1.离子晶体、分子晶体小结作业导学大课堂NaCl的晶体结构示意图CsCl的晶体结构示意图返回氢键的形成过程氢键共价键返回范德华力共价键干冰的晶体结构示意图返回分子间作用力(范德华力)——分子与分子间的作用力(把分子 聚集在一起的作用力)。化学键 与分子间作用力的比较相邻原子(分子内部)分子之间大小主要影响物质的化学性质主要影响物质的物理性质(熔、沸点)分子间作用力比化学键弱得多
