晶体类型[下学期]
图片预览









文档简介
课件38张PPT。晶 体 结 构晶体的概念什么叫晶体?
决定晶体物理性质的因素是什么?通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒(分子、原子或离子)按一定的规则排列。
构成晶体微粒之间的结合力。
结合力越强,晶体的熔沸点越高,晶体的硬度越大。构成晶体的基本微粒和作用力阴阳离子
分子
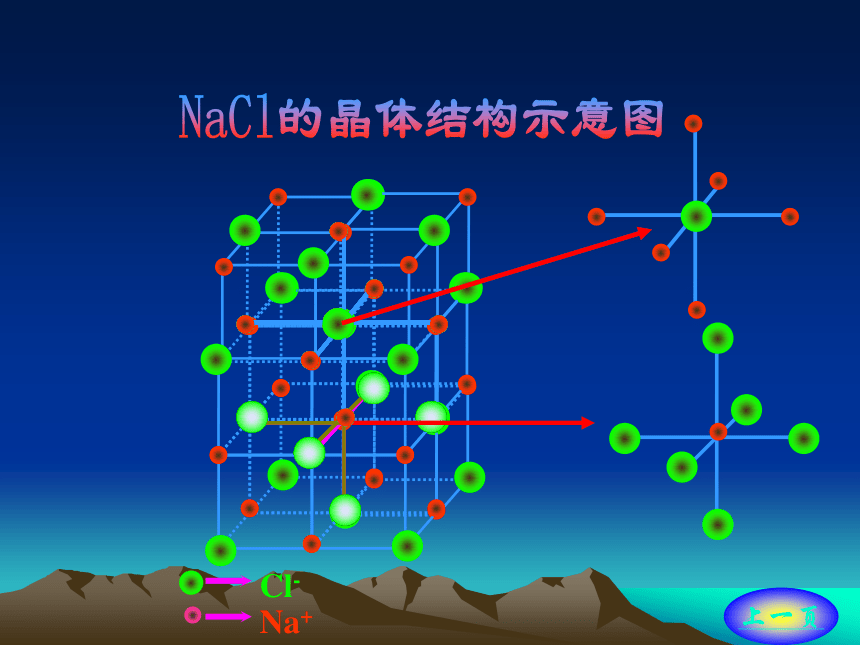
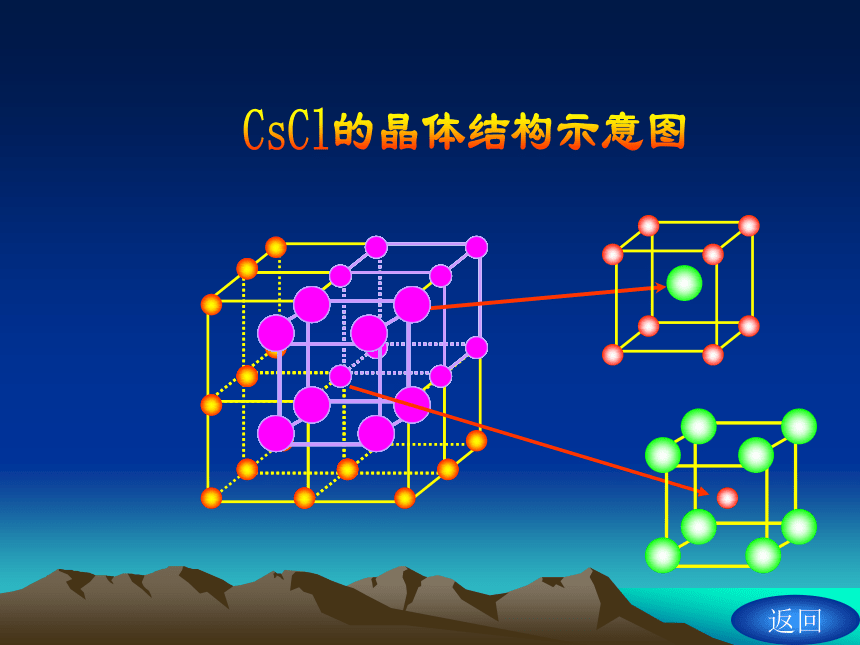
原子阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,形成 分子晶体。
原子间以共价键结合,形成原子晶体。离子晶体什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl 和CsCl不是表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。Na ClCs Cl熔 点硬 度 分子晶体 原子晶体NaCl的晶体结构示意图上一页CsCl的晶体结构示意图返回请你想想 为什么NaCl的熔沸点比CsCl高? Na+半径比Cs+ 小 Na+与Cl- 的相互作用比Cs+与Cl- 的相互作用强 Na+ 与Cs+ 均带一个单位正电荷, 阴离子均为氯离子。 NaCl晶体中的离子键较强, NaCl晶体的熔沸点较高。课 堂 巩 固1.下列说法正确的是( )
A.离子晶体在固态时不能导电是因为其中没有离子.
B.离子晶体中也可能含有共价键.
C.离子晶体中一个阳离子只能与一个阴离子形成离子键.
D.离子晶体中阴离子与阳离子数总是相等的.
E.离子晶体中离子键越强,其熔沸点越高,硬度越大.
F.离子晶体中肯定含有金属阳离子。分子晶体什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO、SO2)等。干冰1 图 原子晶体 离子晶体分子间作用力(范德华力)分子间存在作用力的事实:
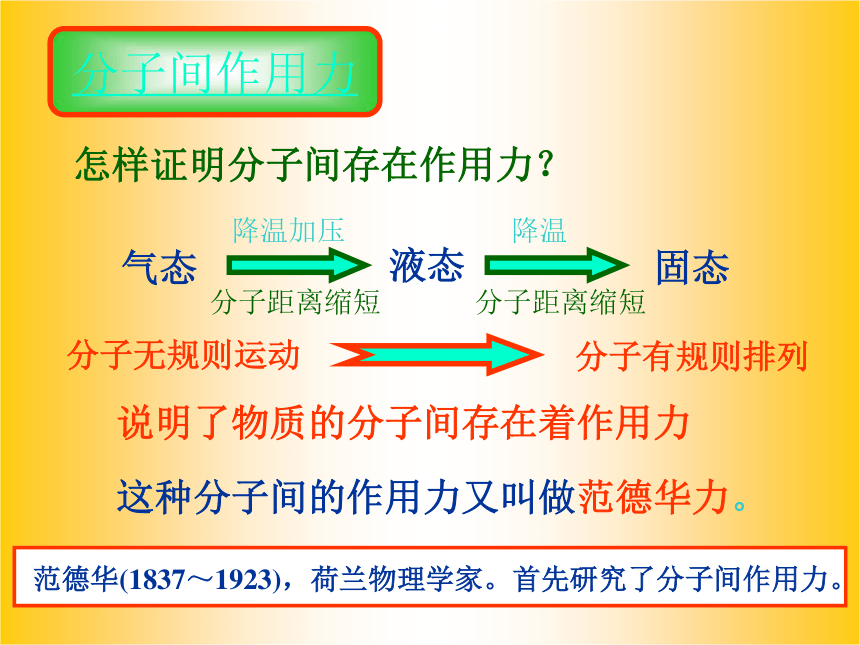
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
强度:化学键的键能为120~800kJ/mol,而分子间作用力只有几到几十kJ/mol。 分子晶体 原子晶体 离子晶体 分子间作用力 怎样证明分子间存在作用力?说明了物质的分子间存在着作用力这种分子间的作用力又叫做范德华力。 范德华(1837~1923),荷兰物理学家。首先研究了分子间作用力。气态液态固态降温加压降温分子距离缩短分子距离缩短分子无规则运动分子有规则排列分子与分子
间的作用力相邻原子间
的相互作用弱(几到几十
kJ/mol)强( 120~
800 kJ/mol)HCl分子中,H-Cl 键能为 431kJ/mol , HCl 分子间的作用力为 21kJ/mol 。 分子间作用力对物质的熔点、沸点有
何影响? 分子间作用力越大,克服分子间引力
使物质熔化和气化就需要更多的能量,熔
沸点越高。 分子组成和结构相似时,分子量越大,分
子间作用力越大。请解释,卤素单质熔沸点变
化规律。 氟、氯、溴、碘的单质均是分子晶体,
双原子分子,每个分子都是通过一个单键结
合而成,随着分子量的增大,分子间作用力
增大,故熔沸点递升。分子返回点击后还有两个图氢键的形成过程氢键共价键返回2、如果水分子之间没有氢键存在,地球上将会出现?什么面貌?讨论:1、冰的密度为什么比液态水的小?原子晶体什么叫原子晶体?
原子晶体的特点?
哪些物质属于原子晶体?
原子间通过共价键结合成的具有空间网状结构的晶体。
熔沸点很高,硬度很大,难溶于一般溶剂。
金刚石、单晶硅、碳化硅、二氧化硅等。 金刚石熔 点硬 度 离子晶体 分子晶体石 墨原 子 晶 体 如金刚石是以碳碳单键结合而成的正四面
体的空间网状结构。键角:109°28′键长 :1.55×10-10m熔点: 3550℃ 沸点:4827℃180o109o28′Sio二氧化硅的晶体结构示意图下一页共价键109o28′金刚石的晶体结构示意图返回共价键石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。 知识归纳—混合型晶体 石墨结构本节知识归纳晶体类型
离子晶体
分子晶体
原子晶体离子键
范德华力
共价键离子
分子
原子较高
较低
很高NaCl、CsCl
干冰
金刚石 晶体判断 课堂训练 开拓思考微粒结合力熔沸点典型实例 结束课程一、三种晶体的比较二、晶体类型的判断本节总结:离子分子原子离子键范德华力共价键较 高较 低很 高较 大较 小很大NaCl
CaO干冰
碘 金刚石
二氧化硅 晶体类型的判断从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体) 开拓思考 结束课程 课堂训练课堂练习题下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠 结束课程 开拓思考 晶体判断开拓思考题仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些? 结束课程 课堂训练 晶体判断氯化钠的晶体结构 晶格扩展 回离子晶体氯化钠的晶格扩展 回离子晶体在NaCl晶体中,每个Na+同时吸引6个Cl-,
每个Cl- 同时吸引6个Na+。氯化铯的晶体结构 回离子晶体在CsCl晶体中,每个Cs+同时吸引8个Cl-,
每个Cl- 同时吸引8个Cs+。
三种典型立方晶体结构简单立方体心立方面心立方结束 返回原处范德华力共价键干冰的晶体结构示意图返回干冰晶体结构示意结束 回分子晶体由此可见,每个二氧化碳分子周围有12个二氧化碳分子。金刚石的晶体结构 回原子晶体 旋转模型金刚石晶体结构模型结束 回原子晶体石墨的晶体结构 返回石墨晶体的硬度金刚石食 盐石 墨结束 返回原处兴宁一中高一化学备课组
决定晶体物理性质的因素是什么?通过结晶过程形成的具有规则几何外形的固体叫晶体。
晶体中的微粒(分子、原子或离子)按一定的规则排列。
构成晶体微粒之间的结合力。
结合力越强,晶体的熔沸点越高,晶体的硬度越大。构成晶体的基本微粒和作用力阴阳离子
分子
原子阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,形成 分子晶体。
原子间以共价键结合,形成原子晶体。离子晶体什么叫离子晶体?
离子晶体的特点?
哪些物质属于离子晶体?
离子间通过离子键结合而成的晶体。
无单个分子存在;NaCl 和CsCl不是表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。Na ClCs Cl熔 点硬 度 分子晶体 原子晶体NaCl的晶体结构示意图上一页CsCl的晶体结构示意图返回请你想想 为什么NaCl的熔沸点比CsCl高? Na+半径比Cs+ 小 Na+与Cl- 的相互作用比Cs+与Cl- 的相互作用强 Na+ 与Cs+ 均带一个单位正电荷, 阴离子均为氯离子。 NaCl晶体中的离子键较强, NaCl晶体的熔沸点较高。课 堂 巩 固1.下列说法正确的是( )
A.离子晶体在固态时不能导电是因为其中没有离子.
B.离子晶体中也可能含有共价键.
C.离子晶体中一个阳离子只能与一个阴离子形成离子键.
D.离子晶体中阴离子与阳离子数总是相等的.
E.离子晶体中离子键越强,其熔沸点越高,硬度越大.
F.离子晶体中肯定含有金属阳离子。分子晶体什么叫分子晶体?
分子晶体的特点?
哪些物质可以形成分子晶体?
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小,易升华。
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO、SO2)等。干冰1 图 原子晶体 离子晶体分子间作用力(范德华力)分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。
分子间作用力与化学键的区别:
化学键存在于原子之间(即分子之内),而分子间作用力显然是在“分子之间”。
强度:化学键的键能为120~800kJ/mol,而分子间作用力只有几到几十kJ/mol。 分子晶体 原子晶体 离子晶体 分子间作用力 怎样证明分子间存在作用力?说明了物质的分子间存在着作用力这种分子间的作用力又叫做范德华力。 范德华(1837~1923),荷兰物理学家。首先研究了分子间作用力。气态液态固态降温加压降温分子距离缩短分子距离缩短分子无规则运动分子有规则排列分子与分子
间的作用力相邻原子间
的相互作用弱(几到几十
kJ/mol)强( 120~
800 kJ/mol)HCl分子中,H-Cl 键能为 431kJ/mol , HCl 分子间的作用力为 21kJ/mol 。 分子间作用力对物质的熔点、沸点有
何影响? 分子间作用力越大,克服分子间引力
使物质熔化和气化就需要更多的能量,熔
沸点越高。 分子组成和结构相似时,分子量越大,分
子间作用力越大。请解释,卤素单质熔沸点变
化规律。 氟、氯、溴、碘的单质均是分子晶体,
双原子分子,每个分子都是通过一个单键结
合而成,随着分子量的增大,分子间作用力
增大,故熔沸点递升。分子返回点击后还有两个图氢键的形成过程氢键共价键返回2、如果水分子之间没有氢键存在,地球上将会出现?什么面貌?讨论:1、冰的密度为什么比液态水的小?原子晶体什么叫原子晶体?
原子晶体的特点?
哪些物质属于原子晶体?
原子间通过共价键结合成的具有空间网状结构的晶体。
熔沸点很高,硬度很大,难溶于一般溶剂。
金刚石、单晶硅、碳化硅、二氧化硅等。 金刚石熔 点硬 度 离子晶体 分子晶体石 墨原 子 晶 体 如金刚石是以碳碳单键结合而成的正四面
体的空间网状结构。键角:109°28′键长 :1.55×10-10m熔点: 3550℃ 沸点:4827℃180o109o28′Sio二氧化硅的晶体结构示意图下一页共价键109o28′金刚石的晶体结构示意图返回共价键石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。 知识归纳—混合型晶体 石墨结构本节知识归纳晶体类型
离子晶体
分子晶体
原子晶体离子键
范德华力
共价键离子
分子
原子较高
较低
很高NaCl、CsCl
干冰
金刚石 晶体判断 课堂训练 开拓思考微粒结合力熔沸点典型实例 结束课程一、三种晶体的比较二、晶体类型的判断本节总结:离子分子原子离子键范德华力共价键较 高较 低很 高较 大较 小很大NaCl
CaO干冰
碘 金刚石
二氧化硅 晶体类型的判断从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体) 开拓思考 结束课程 课堂训练课堂练习题下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠 结束课程 开拓思考 晶体判断开拓思考题仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些? 结束课程 课堂训练 晶体判断氯化钠的晶体结构 晶格扩展 回离子晶体氯化钠的晶格扩展 回离子晶体在NaCl晶体中,每个Na+同时吸引6个Cl-,
每个Cl- 同时吸引6个Na+。氯化铯的晶体结构 回离子晶体在CsCl晶体中,每个Cs+同时吸引8个Cl-,
每个Cl- 同时吸引8个Cs+。
三种典型立方晶体结构简单立方体心立方面心立方结束 返回原处范德华力共价键干冰的晶体结构示意图返回干冰晶体结构示意结束 回分子晶体由此可见,每个二氧化碳分子周围有12个二氧化碳分子。金刚石的晶体结构 回原子晶体 旋转模型金刚石晶体结构模型结束 回原子晶体石墨的晶体结构 返回石墨晶体的硬度金刚石食 盐石 墨结束 返回原处兴宁一中高一化学备课组
