市公开课-晶体的类型和性质[下学期]
文档属性
| 名称 | 市公开课-晶体的类型和性质[下学期] |
|
|
| 格式 | rar | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-06-10 00:00:00 | ||
图片预览







文档简介
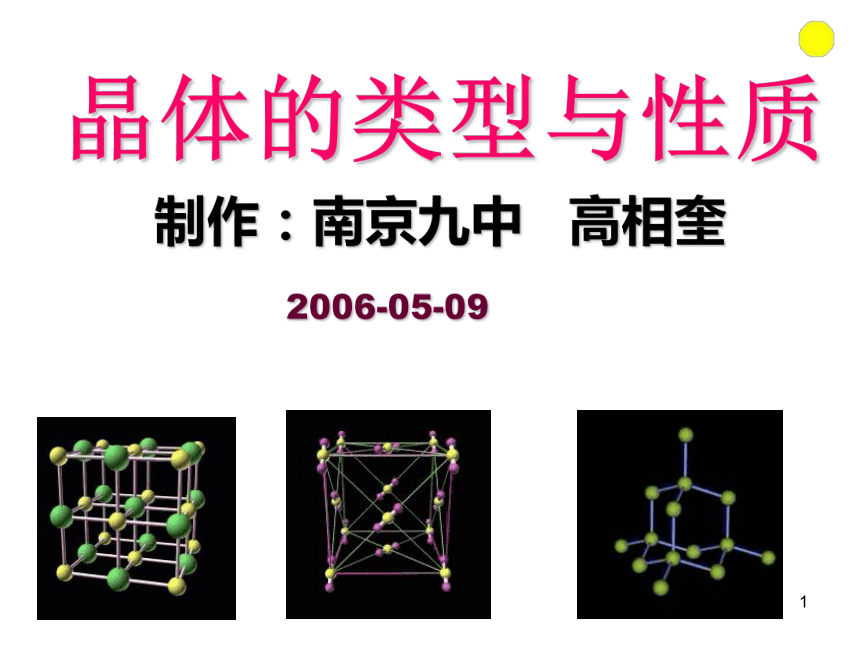
课件30张PPT。301晶体的类型与性质制作:南京九中 高相奎
2006-05-09302雪花303明矾304金刚石305 经过结晶过程而形成的具有规则的几何外形的固体叫晶体。2、晶体的特征:1、晶体的定义(1)具有固定的熔点;
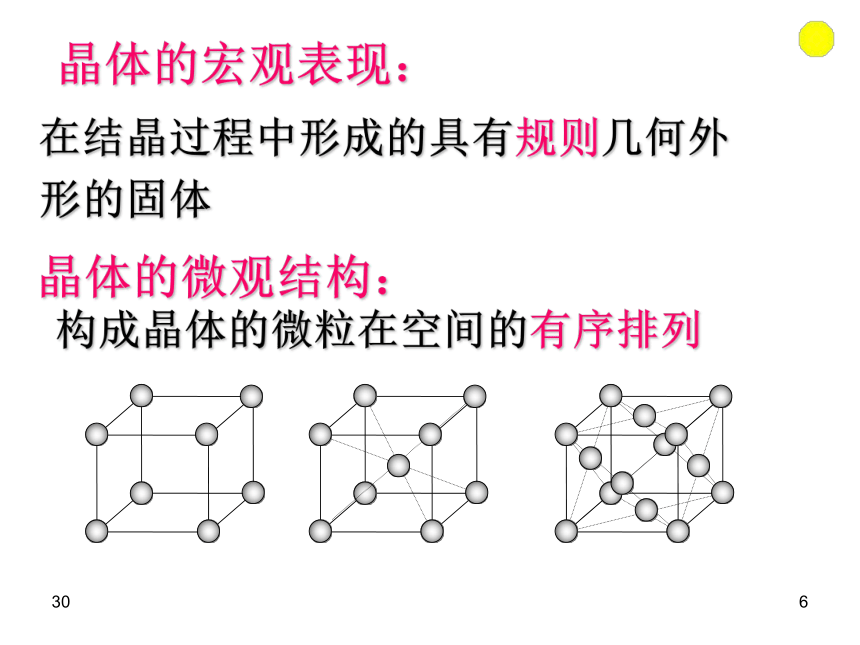
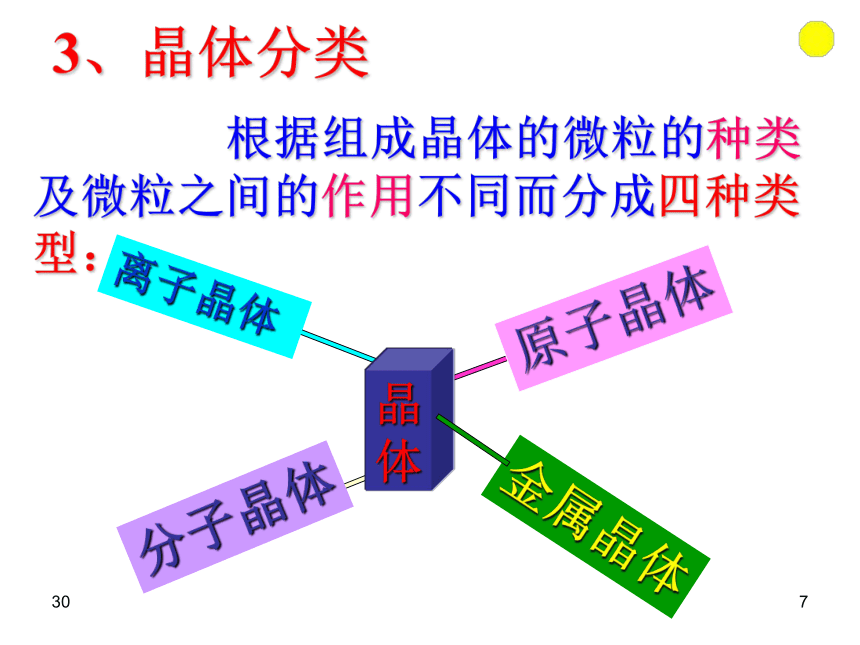
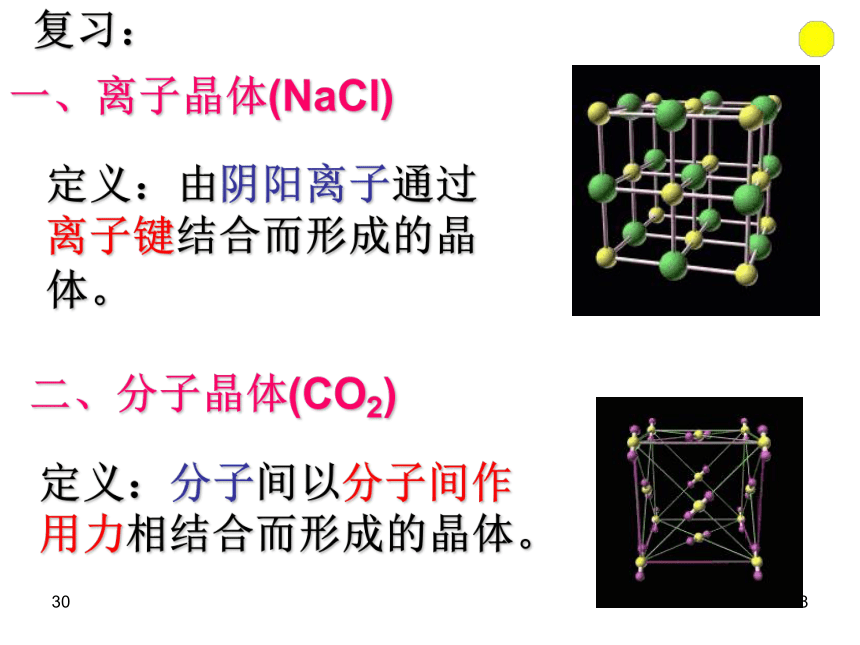
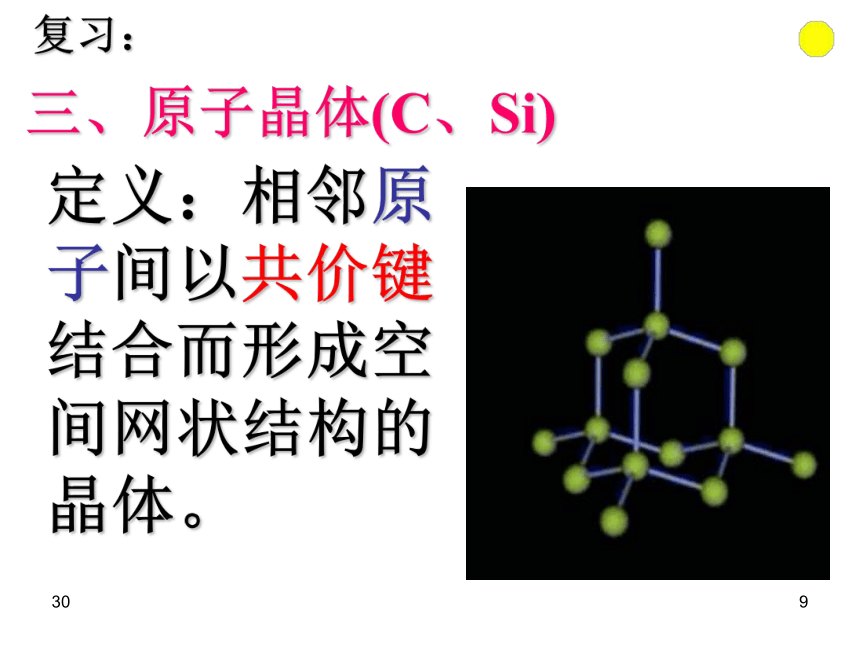
(2)具有规则的几何形状。306在结晶过程中形成的具有规则几何外形的固体 晶体的宏观表现: 晶体的微观结构:构成晶体的微粒在空间的有序排列3073、晶体分类 根据组成晶体的微粒的种类及微粒之间的作用不同而分成四种类型:晶体308定义:由阴阳离子通过离子键结合而形成的晶体。 一、离子晶体(NaCl)复习:二、分子晶体(CO2)定义:分子间以分子间作用力相结合而形成的晶体。309定义:相邻原子间以共价键结合而形成空间网状结构的晶体。三、原子晶体(C、Si)复习:3010思考题:
1、NaCl是否代表食盐的分子式?
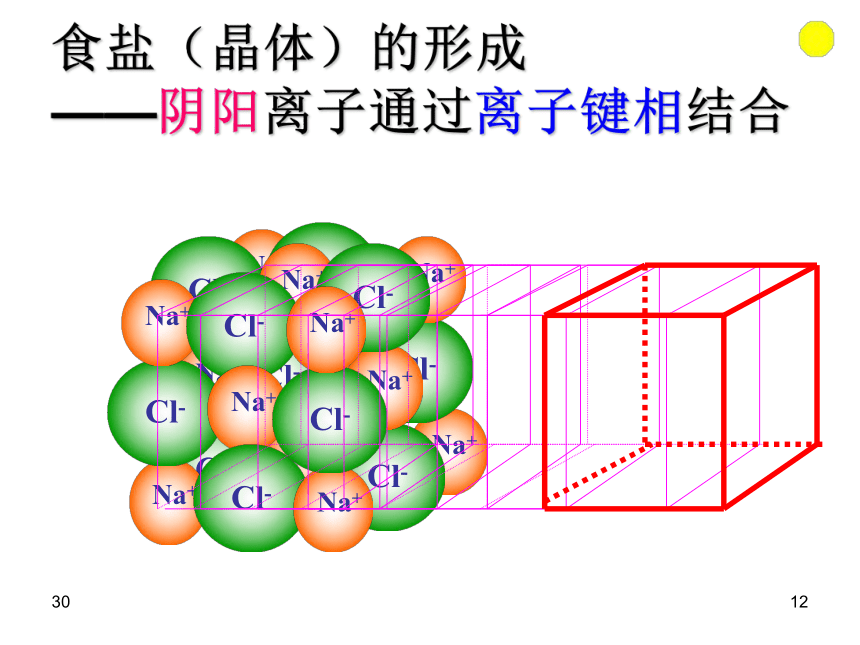
2、碳和硅是同族元素,而CO2和SiO2的物理性质却差距很大是为什么?3011晶体的微观结构3012食盐(晶体)的形成 ——阴阳离子通过离子键相结合30131、NaCl晶体结构示意图:(1)钠离子和氯离子在晶胞中的位置:钠离子:体心和棱中点;氯离子:面心和顶点,
或者反之。晶胞是在晶体中具有代表性的最小重复单元30141、NaCl晶体结构示意图:(2)与Na+等距离且最近的Cl- 、Na+各有几个?与Na+等距离且最近的Cl- 有:6个, 6:6与Na+等距离且最近的Na+ 有:12个3015结论:
1个氯离子同时受6个钠离子共同吸引;1个钠离子同时受6个氯离子共同吸引 。它们构成正八面体1、NaCl晶体结构示意图:(3)、在氯化钠晶体中,每个Na+周围与之最接近且距离相等的Cl-共有6个;这6个Cl-在空间构成的几何构型为 。正八面体3016NaCl晶体结构示意图:(4)每个晶胞含氯离子、钠离子的个数?3017有1/8属于该立方体有1/4属于该立方体有1/2属于该立方体完全属于该立方体晶胞中微粒个数的确定3018氯化钠晶胞中的氯骨架有多少个氯离子?Cl-=(8/8+6/2)=4个3019氯化钠中晶胞中的钠骨架一个氯化钠晶胞中有多少个钠离子?Na+=(12/4+1)=4个3020NaCl晶体结构示意图:(4)每个晶胞含钠离子、氯离子的个数?氯离子: 钠离子:
3021AB练习1:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)化学式:AB3022练习2:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)AB化学式:A2B30232、干冰晶体-分子晶体(1)二氧化碳分子在晶胞的位置:
二氧化碳分子位于:体心和棱中点(面心和顶点)
(2)每个晶胞含二氧化碳分子的个数
(3)与每个二氧化碳分子等距离且最近的二氧化碳分子有几个?
12个
二氧化碳分子的个数: 4 个 30243、金刚石(硅)每个碳原子周围有4个碳原子,形成正四面体构型1、金刚石晶体中每个碳原子和几个碳原子相连?形成的什么样的空间构型?2、晶体中有最小的环是什么样的环?最小的环是六元环,但不共平面30253026练习3、石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为 ( )
A、8 B、12 C、24 D、60A30274.2003年3月,学国家发现首例带结晶水的晶体在 5K 下呈现超导性。报报道,该晶体中含有最简式为 CoO2 的层状结构,结构如右图(小球表示Co原子,大球表示O原子)。下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是
D3028练习5、 晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由 个硼原子组成,其中B-B的键角为 ,共含有 个B-B键。1260O3030296、SF6是一种无色气体,具有很强的稳定性,可用于灭火。
SF6的分子结构为正八面体,如果F有两种同位素,则SF6分子
种类有 种。103030同学们再见!
2006-05-09302雪花303明矾304金刚石305 经过结晶过程而形成的具有规则的几何外形的固体叫晶体。2、晶体的特征:1、晶体的定义(1)具有固定的熔点;
(2)具有规则的几何形状。306在结晶过程中形成的具有规则几何外形的固体 晶体的宏观表现: 晶体的微观结构:构成晶体的微粒在空间的有序排列3073、晶体分类 根据组成晶体的微粒的种类及微粒之间的作用不同而分成四种类型:晶体308定义:由阴阳离子通过离子键结合而形成的晶体。 一、离子晶体(NaCl)复习:二、分子晶体(CO2)定义:分子间以分子间作用力相结合而形成的晶体。309定义:相邻原子间以共价键结合而形成空间网状结构的晶体。三、原子晶体(C、Si)复习:3010思考题:
1、NaCl是否代表食盐的分子式?
2、碳和硅是同族元素,而CO2和SiO2的物理性质却差距很大是为什么?3011晶体的微观结构3012食盐(晶体)的形成 ——阴阳离子通过离子键相结合30131、NaCl晶体结构示意图:(1)钠离子和氯离子在晶胞中的位置:钠离子:体心和棱中点;氯离子:面心和顶点,
或者反之。晶胞是在晶体中具有代表性的最小重复单元30141、NaCl晶体结构示意图:(2)与Na+等距离且最近的Cl- 、Na+各有几个?与Na+等距离且最近的Cl- 有:6个, 6:6与Na+等距离且最近的Na+ 有:12个3015结论:
1个氯离子同时受6个钠离子共同吸引;1个钠离子同时受6个氯离子共同吸引 。它们构成正八面体1、NaCl晶体结构示意图:(3)、在氯化钠晶体中,每个Na+周围与之最接近且距离相等的Cl-共有6个;这6个Cl-在空间构成的几何构型为 。正八面体3016NaCl晶体结构示意图:(4)每个晶胞含氯离子、钠离子的个数?3017有1/8属于该立方体有1/4属于该立方体有1/2属于该立方体完全属于该立方体晶胞中微粒个数的确定3018氯化钠晶胞中的氯骨架有多少个氯离子?Cl-=(8/8+6/2)=4个3019氯化钠中晶胞中的钠骨架一个氯化钠晶胞中有多少个钠离子?Na+=(12/4+1)=4个3020NaCl晶体结构示意图:(4)每个晶胞含钠离子、氯离子的个数?氯离子: 钠离子:
3021AB练习1:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)化学式:AB3022练习2:根据离子晶体的晶胞结构,判断下列离子晶体的化学式:(A表示阳离子)AB化学式:A2B30232、干冰晶体-分子晶体(1)二氧化碳分子在晶胞的位置:
二氧化碳分子位于:体心和棱中点(面心和顶点)
(2)每个晶胞含二氧化碳分子的个数
(3)与每个二氧化碳分子等距离且最近的二氧化碳分子有几个?
12个
二氧化碳分子的个数: 4 个 30243、金刚石(硅)每个碳原子周围有4个碳原子,形成正四面体构型1、金刚石晶体中每个碳原子和几个碳原子相连?形成的什么样的空间构型?2、晶体中有最小的环是什么样的环?最小的环是六元环,但不共平面30253026练习3、石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为 ( )
A、8 B、12 C、24 D、60A30274.2003年3月,学国家发现首例带结晶水的晶体在 5K 下呈现超导性。报报道,该晶体中含有最简式为 CoO2 的层状结构,结构如右图(小球表示Co原子,大球表示O原子)。下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是
D3028练习5、 晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由 个硼原子组成,其中B-B的键角为 ,共含有 个B-B键。1260O3030296、SF6是一种无色气体,具有很强的稳定性,可用于灭火。
SF6的分子结构为正八面体,如果F有两种同位素,则SF6分子
种类有 种。103030同学们再见!
