沪科版高中化学一年级第二学期6《揭示化学反应速率和平衡之谜》测试题(解析版)
文档属性
| 名称 | 沪科版高中化学一年级第二学期6《揭示化学反应速率和平衡之谜》测试题(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 263.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-04 22:35:19 | ||
图片预览




文档简介
《揭示化学反应速率和平衡之谜》测试题
一、单选题(每小题只有一个正确答案)
1.反应C(s)十H2O(g) CO(g)十H2(g) 在一密闭容器中进行,下列条件的改变能使反应速率减小的是( )
A.减少C的量 B.容积不变,增加水蒸气的量
C.升温? D.压强不变,充入Ne
2.在相同条件下,等质量的下列金属与足量1mol/L盐酸反应时,速率最快的是( )
A. 镁 B. 铝 C. 钠 D. 铁
3.某容器中加入N2和H2,在一定条件下,N2+3H22NH3,达到平衡时N2、H2、NH3的浓度分别是3 mol ? L-l、4 mol ? L-1、4 mol ? L-1,则反应幵始时H2的浓度是( )
A. 5 mol ? L-1 B. 10 mol ? L-1 C. 8 mol ? L-1 D. 6.7 mol ? L-1
4.在下列等温恒容中建立起平衡体系3NO2(g)+ H2O(l) 2HNO3(aq) + NO(g)中加入O2 ,则化学平衡( )
A. 向右移动 B. 向左移动 C. 不移动 D. 无法判断
5.下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数从而使有效碰撞次数增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 催化剂不影响活化能但能增大单位体积内活化分子百分数,从而增大反应速率
D. 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
6.对于在密闭容器中进行的反应:N2+O22NO,下列不能加快该反应的反应速率的条件是( )
A.缩小体积 B.充入更多的NO
C.体积增大到原来的2倍 D.升高温度
7.下列说法正确的是 ( )
①增加水的量或温度,可以加快镁跟水的反应速率。②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。③对于反应CaCO3(s) CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率。④对反应3H2(g) + N2(g) 2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快。⑤对于反应3H2(g) + N2(g) 2NH3(g),使用催化剂,正逆反应速率同等程度加快
A. ①② B. ①②③ C. ②⑤ D. ⑤
8.臭氧(O3)是一种很好的消毒剂,具有高效、洁净等优点。O3 可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生如下反应:
反应 I:O3O2 + [O] △H > 0 平衡常数为 K1;
反应 II:O3 + [O] 2O2 △H < 0 平衡常数为 K2; 总反应:2O3 3O2△H < 0平衡常数为 K。
下列叙述正确的是( )
A. K = K1 + K2 B. 压强增大,K2 减小
C. 适当升高温度,可提高消毒效率 D. 降低温度,K 减小
9.100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g) N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
10.在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是( )
t /min 2 4 7 9
n(Y)/mol 0.12 0.11 0.10 0.10
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(L?min)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
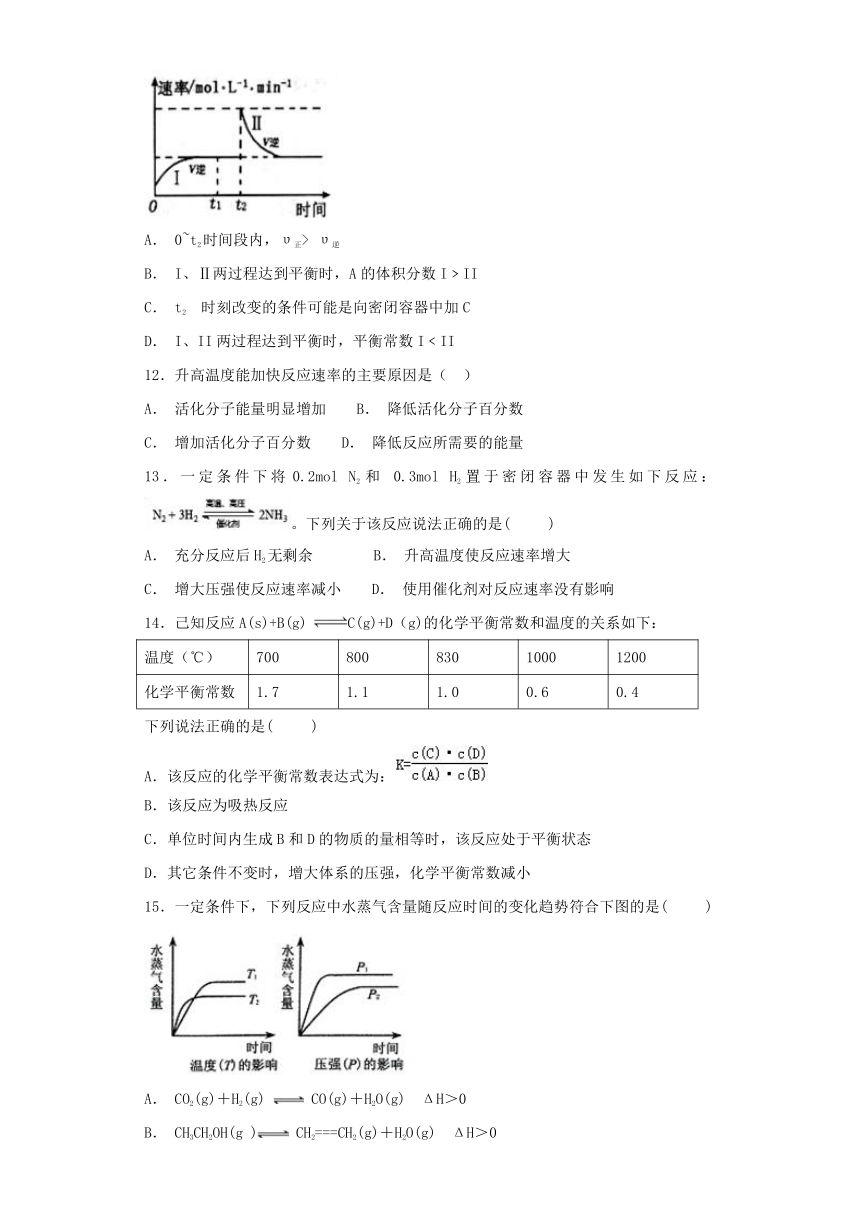
11.在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g) △H<0。t1 时刻达到平衡后,在t2 时刻改变某一条件,其反应过程如图所示。下列说法正确的是( )
A. 0~t2时间段内,υ正> υ逆
B. I、Ⅱ两过程达到平衡时,A的体积分数I﹥II
C. t2?时刻改变的条件可能是向密闭容器中加C
D. I、II两过程达到平衡时,平衡常数I﹤II
12.升高温度能加快反应速率的主要原因是( )
A. 活化分子能量明显增加 B. 降低活化分子百分数
C. 增加活化分子百分数 D. 降低反应所需要的能量
13.一定条件下将0.2mol N2和 0.3mol H2置于密闭容器中发生如下反应:。下列关于该反应说法正确的是( )
A. 充分反应后H2无剩余 B. 升高温度使反应速率增大
C. 增大压强使反应速率减小 D. 使用催化剂对反应速率没有影响
14.己知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如下:
温度(℃) 700 800 830 1000 1200
化学平衡常数 1.7 1.1 1.0 0.6 0.4
下列说法正确的是( )
A.该反应的化学平衡常数表达式为:
B.该反应为吸热反应
C.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
D.其它条件不变时,增大体系的压强,化学平衡常数减小
15.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A. CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g ) CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g) ΔH<0
二、填空题
16.在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
锌的质量/g 锌的形状 温度/℃ 完全溶于溶液的时间/s
A 2 薄片 5 400
B 2 薄片 15 200
C 2 薄片 25 100
D 2 薄片 35 t1
E 2 细小颗粒 15 t2
F 2 粉末 15 t3
G 2 薄片(含少量杂质Cu) 35 t4
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
17.25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
t2~t3 t4~t5 t5~t6 t7~t8
K1 K2 K3 K4
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。
18.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)反应开始到10s,用Z表示的反应速率___________________
(2)反应开始到10s时,Y的转化率为__________________
(3)反应的化学方程式为:____________________
19.在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)===2HI(g)。
(1)保持容器容积不变,向其中充入1 mol H2,反应速率________(填“加快”“减慢”或“不变”,下同)。
(2)保持容器容积不变,向其中充入1 mol N2(g)(N2不参加反应),反应速率________。
(3)保持容器内气体压强不变,向其中充入1 mol N2(g)(N2不参加反应),反应速率________。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率________。
20.2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________,4 min末CO的浓度为_____________ mol?L-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________。
三、实验题
21.(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g)2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
22.I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol/L 0.040 0.080 0.080 0.160 0.120
c(S2O82-)/mol/L 0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是____________________________________________________________。
(2)显色时间t1为________。
(3)通过分析比较上述数据,得到的结论是___________________________________________________。
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率____________。
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为________。
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为________。
四、推断题
23.“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
24.在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g) + 3H2 (g)2NH3 (g) ΔH <0。
(1)达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
(2)达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
(3)达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
(4)达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
(5)保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
(6)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
五、计算题
25.把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),2 min末生成0.4 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min) ,试计算(写出计算过程)
(1)前2 min内,用X表示的平均反应速率。
(2)2 min末时Y的转化率。
(3)化学方程式中Z的化学计量数n。
26.在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH< 0
已知CO的浓度变化如图所示,第4 minCO的浓度不再改变。
(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min);该反应的平衡常数表达式为:K= ;可计算得该反应的平衡常数结果为:K= 。
(2)为了增大CO的转化率,可以采取的措施有 。
A.增大反应物中CO的浓度
B.降低反应温度
C.将密闭容器体积压缩至一半
D.加入适宜的催化剂
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 mol/L?
试卷第2页,总9页
参考答案
1.D
【解析】
2.C
【解析】金属性越强,与酸反应时速率越快,四种金属的活泼性强弱顺序是Na>Mg>Al>Fe,所以在相同条件下,等质量的四种金属与足量1mol/L盐酸反应时,速率最快的是钠,答案选C。
3.B
【解析】
平衡时氨气是4mol/L,根据方程式可知消耗氢气是6mol/L,平衡时氢气是4mol/L,所以反应幵始时H2的浓度是10mol/L,答案选B。
4.A
【解析】在下列等温恒容中建立起平衡体系3NO2(g)+H2O(l)2HNO3(aq)+NO(g)中加入O2,2NO+O22NO2,上述平衡体系中生成物NO浓度减小,反应物NO2浓度增大,则化学平衡向右移动,故选A。
5.D
【解析】A、增大反应物浓度,可增大单位体积内活化分子数,不是活化分子百分数,A错误;B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),实际就是在增大气体浓度,所以增加的是单位体积内活化分子数,仍然不会增大活化分子的百分数,B错误;C、催化剂会改变反应活化能,从而改变活化分子百分数,所以C错误;D、升高温度会使分子的平均能量升高,从而使达到活化分子的比例增加,即增加了活化分子百分数,D正确。
点睛:从碰撞理论来说,增加反应速率就是要增加单位时间的有效碰撞的次数。而发生有效碰撞要求必须是活化分子。所以增大活化分子百分数是加快反应速率的有效方法。能够影响活化分子百分数的方法,实际只有温度和催化剂。升高温度,会提高分子的平均能量,从而使达到活化分子标准的分子数增加;而加入催化剂是改变了活化能,也就是改变了活化分子的标准,从而改变了活化分子百分数。
6.C
【解析】体积增大到原来的2倍,浓度减小为原来的,化学反应速率减小。
7.D
【解析】①改变纯液体的量,对反应速率无影响,则增加水的量,反应速率不变,但升高温度,可以加快镁跟水的反应速率,选项①错误;②浓硫酸具有强氧化性,与Zn反应不生成氢气,而稀硫酸中浓度大,生成氢气的反应速率快,选项②错误;③碳酸钙是固体,其质量的增加,不能影响反应速率,选项③错误;④固定体积,若充入氦气,反应体系中各物质的浓度不变,反应速率不变,选项④错误;⑤使用催化剂,同等程度加快正逆反应速率,选项⑤正确。答案选D。
8.C
【解析】
【详解】
A.总反应2O33O2平衡常数,反应I O3O2+[O]平衡常数 ,反应II O3 + [O]2O2平衡常数,由此可知K=K1?K2,A项错误;
B.平衡常数只与温度有关,与压强无关,B项错误;
C.反应I是吸热反应,反应II是放热反应,根据勒夏特列原理,升高温度,反应I向正反应方向移动,反应II向逆反应方向移动,都有利于生成游离氧原子[O],消毒效率提高,C项正确;
D.因为2O33O2正反应是放热反应,降低温度平衡向正反应方向移动,K值增大,D项错误;答案选C。
9.A
【解析】
A. 平衡时,Ⅰ、Ⅱ形成等效平衡,Ⅰ、Ⅱ中反应物的转化率α(N2O4)+α(NO2)=1,故A正确;B. 平衡后,再向Ⅱ容器内通入一定量的NO2,相当于加压,平衡右移,又达到平衡时,NO2的体积分数减小,故B错误;C. 如加压平衡右移,Ⅱ容器NO2的平衡转化率增大,该反应的平衡常数不变,故C错误;D. Q(Ⅰ)不一定等于Q(Ⅱ),故D错误。故选A。
点睛:解答本题的难点是选项A。在相同条件下,在元素守恒的前提下,从正反应和逆反应开始建立的平衡是等效平衡。两个过程是互逆的,α(N2O4)+α(NO2)=1。
10.B
【解析】由题中信息可知,反应在第7分钟处于化学平衡状态,平衡时Y的变化量为0.06mol,则根据方程式可知
X(g) + Y(g)2Z(g)
起始浓度(mol/L) 0.016 0.016 0
转化浓度(mol/L) 0.006 0.006 0.012
平衡浓度(mol/L) 0.01 0.01 0.012
A.反应前2min内Y减少了0.04mol,则生成Z是0.08mol,浓度是0.008mol/L,所以平均速率v(Z)=0.008mol/L÷2min=4.0×10-3mol/(L·min),A错误;B. 该反应为放热反应,其他条件不变,降低温度,化学平衡向正反应方向移动,反应达到新平衡前v(逆)<v(正),B正确;C. 该温度下此反应的平衡常数K=,C错误;D. 该反应前后气体的分子数不变,所以改变压强后,平衡不移动。其他条件不变,再充入0.2molZ,相当于对原平衡加压,所以平衡时X的体积分数不变,D错误。答案选B。
11.C
【解析】试题分析:A、0~t2时,反应正向进行,v(正)>v(逆),t1~t2时,反应达到平衡,v(正)=v(逆),故错误,不选A;B、t2时刻改变条件后达到平衡时,逆反应速率不变,说明和原平衡等效,A的体积分数Ⅰ=Ⅱ,错误,不选B;C、向密度容器中加C ,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,说明和原平衡相同,符合图形,正确,选C;D、t2时刻改变条件后达到平衡时逆反应速率不变,说明和原平衡等效,所以Ⅰ、Ⅱ两过程达到平衡时,平衡常数相等,错误,故不选D。
考点: 化学平衡的建立
12.C
【解析】升高温度,将更多的分子转化为活化分子,活化分子百分数增大,有效碰撞次数增多,则反应速率增大,只有C正确,故选C。
13.B
【解析】A、这是一个可逆反应,任何物质都不可能完全没有,故A错误;B、升高温度可加快反应速率,所以B正确;C、增大压强,使体积缩小,浓度增大,所以反应速率加快,故C错误;D、使用催化剂可加快反应速率,但平衡不移动,故D错误。本题正确答案为B。
14.C
【解析】
试题分析:A、A为固体,表达式错误;B、温度升高,K减小,平衡逆向移动,故逆反应为吸热,正反应放热,错误;C、生成B为逆方向,生成D为正方向,正确;D、增大压强,平衡逆向移动,化学平衡常数不变,错误。
考点:考查化学反应速率与化学平衡相关知识,涉及平衡常数表达式,平衡移动、平衡状态的判断等相关知识。
15.D
【解析】
温度越高,反应越快,到达平衡的时间就越少,因此T2>T1;同理压强越大,反应越快,到达平衡的时间就越少,因此P1>P2;
A、该反应是吸热的可逆反应,升高温度平衡正向移动,则T2时水蒸气含量应该比T1时大,与图象不符,故A错误;
B、该反应是一个体积增大和吸热的可逆反应,升高温度平衡向正反应方向移动,水蒸气的含量增大;增大压强,平衡向逆反应方向移动,水蒸气的含量减小,不符合图象,故B错误;
C、该反应是一个体积增大和放热的可逆反应,增大压强平衡逆向移动,水蒸气的含量减少,与图像不符,故C错误;
D、该反应是一个体积减小和放热的可逆反应,因此升高温度平衡向逆反应方向移动,水蒸气的含量降低;而增大压强平衡向正反应方向移动,水蒸气的含增大量,与图像相符,故D正确。
此题答案选D。
【名师点睛】灵活运用影响化学平衡的因素是解题关键,根据图(1)到达平衡时所用时间的长短判断温度T1和T2的相对大小,升高温度,化学平衡向吸热方向移动,再结合水蒸气的含量变化情况判断该反应的正反应是放热还是吸热;根据图(2) 到达平衡时所用时间的长短判断压强P1和P2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小。
16.(1)50 (2)温度每升高10℃,反应速率加快到原来的2倍(3)> G组中可形成Cu—Zn原电池,反应速率加快> F组中锌为粉末状,表面积较大,反应速率加快 (4)mF>mB>mE(每空1分)
【解析】
17.(1)A(g)+2B(g) 2C(g)(不写物质的状态也可) 0.05 mol·L-1·min-1
(2)增大压强(或缩小容器体积)
(3)K1>K2=K3=K4 t2~t3
【解析】(1)由图1中曲线变化情况可知:A和B是反应物,C是生成物,再由物质的量的变化值可得化学计量数之比。(2)已知反应达平衡后,降低温度,A的转化率将增大,说明正反应是放热反应。在5~7 min内,K值不变,说明平衡移动不是由温度变化引起的,因此此处改变的条件只能是增大压强。(3)根据速率—时间图像分析,t3时改变的条件是升温,t5时改变的条件是使用催化剂,t6时改变的条件是减压,因此有K1>K2=K3=K4。由于t3、t6时条件的改变均导致化学平衡逆向移动,因此A的转化率最大的一段时间是t2~t3。
18. 0.079 mol/(L?s) 79% X+Y2Z
【解析】(1)反应开始到10s,用Z表示的反应速率为:v==0.079mol/(L?s),故答案为:0.079mol/(L?s);
(2)反应开始到10s时,Y的转化率为×100%=79%,故答案为:79%;
(3)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,经过10s后,物质的物质的量不再发生变化,达到平衡状态,则反应的化学方程式为X+Y2Z,故答案为:X+Y2Z。
19. 加快 不变 减慢 不变
【解析】(1)在容器容积不变时,充入1 mol H2即c(H2)增大,化学反应速率加快;(2)保持容器容积不变,充入N2(不参加反应的气体),各成分浓度未变,则反应速率不变;(3)保持容器压强不变,充入N2,体积增大,各成分浓度减小,则反应速率减慢;(4)保持容器内气体压强不变,保持充入H2(g)、I2(g)各1 mol,体积增大,压强未变,浓度也不变,则速率不变。
点睛:关于压强对反应速率的影响需要注意以下三点:(1)参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。(2)对有气体参加的反应,压强改变?气体物质浓度改变?化学反应速率改变,即压强改变的实质是通过改变浓度引起的,如2SO2(g)+O2(g)2SO3(g)增大压强,SO2、O2、SO3的浓度均增大,正、逆反应速率均增大。(3)有气体参加的反应体系中充入“惰性气体”(不参与反应)时,对化学反应速率的影响:①恒容:充入“惰性气体”→总压增大→物质浓度不变(活化分子浓度不变)→反应速率不变。②恒压:充入“惰性气体”→体积增大→物质浓度减小(活化分子浓度减小)→反应速率减慢。
20. C D 0.05 mol?L-1·min-1 0.8 400 K,1 MPa
【解析】本题主要考查影响化学平衡的因素及其反应速率的计算。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD。
A.使用催化剂不改变平衡状态,不影响反应物的转化率,故A不符合题意;B.升高反应体系的温度,平衡左移,NO的转化率降低,故B不符合题意;C.该反应放热,降低反应体系的温度,平衡右移,NO的转化率提高,故C符合题意;D.该反应气体物质的量减小,加压平衡右移,NO的转化率提高,故C符合题意。故选CD。
(2)NO从反应开始到平衡时的平均反应速率v(NO)=0.20/4 mol?L-1·min-1=0.05 mol?L-1·min-1,4 min末CO的浓度(1-0.2)mol?L-1=0.8 mol?L-1。
(3)工业上催化装置比较适合的温度和压强是400 K,1 MPa。
21.①K= ②不变 增大 ③ 0.01mol/(L·min)
(2)① 降温 ②AC
【解析】
试题分析:(1)反应平衡常数K值只与温度有关,与反应物浓度无关。其他条件相同时,
增大反应物浓度反应速率增大。计算平均反应速率,以反应物B为例:V(B)=1.5mol/15min
×10L (2)在t2时反应速率骤降,温度降低,分子运动速率减慢,反应速度也减慢。
影响反应速率的因素有温度、浓度、压强、催化剂,在t4时反应速率升高,对于有气体
参与的化学反应,其他条件不变时(除体积),增大压强,即体积减小,反应物浓度增大,
速率增加。正催化剂能使反应速率增加。选项D、E升高温度与增大A浓度虽然能使反应速
率增加,但会是平衡移动,故不符合。
考点:反应速率、反应平衡及计算;影响反应速率的因素;
点评:综合考查学生对反应速率章节内容的掌握:
①反应平衡常数K值只与温度有关,与反应物浓度无关。②影响反应速率的因素有温度、浓
度、压强、催化剂;③对于有气体参与的化学反应,其他条件不变时(除体积),增大压强,
即体积减小,反应物浓度增大,速率增加。
22.研究反应物I-与S2O82-的浓度对反应速率的影响 29.3 化学反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比) SO2或O2 0.88 mol·L-1·s-1 5.0 mol·L-1
【解析】
【详解】
I.(1)根据“题给反应的反应速率可以用加入的I3-使淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大”,实验设计了在相同温度下,不同的反应物浓度测定相应的反应时间,目的是探究反应物I-与S2O82-的浓度对反应速率的影响;综上所述,本题答案是:研究反应物I-与S2O82-的浓度对反应速率的影响 。
(2)通过分析各组数据知,反应物起始浓度的乘积与时间成反比,由①、⑤列比例式,可以解得t1:(0.040 mol?L-1×0.040mol?L-1):(0.120 mol?L-1×0.040mol?L-1)=t1:88.0s,解得t1=88/3=29.3s ;综上所述,本题答案是:29.3。
(3)通过第(1)、(2)小题的分析可知,结合表格中数据变化规律,我们已经知道了反应物的浓度乘积与时间成反比,而浓度的变化量与时间的比值为速率,显色时间越短,反应速率越快,所以根据本题的实验数据最终得到的结论为:反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比);综上所述,本题答案是:化学反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
II(1)只有气体或者溶液才有浓度的变化,固体或者纯液体的浓度是定值,故应选用SO2或O2来表示该反应的化学反应速率,因此,本题正确答案是: SO2或O2。
(2)v(SO2):v(O2)=8:11,故v(O2)=11/8×0.64=0.88 mol·L-1·s-1;综上所述,本题答案是:0.88 mol·L-1·s-1。
(3)?c(SO2)=0.4×4=1.6mol/L,?c(O2)=11/8?c(SO2)=11/8×1.6=2.2 mol·L-1,故c(O2)=2.8+2.2=5.0 mol·L-1;综上所述,本题答案是:5.0 mol·L-1。
23.过滤N2+3H22NH3CaSO4+CO2+2NH3+H2O===CaCO3↓+(NH4)2SO4用湿润的红色石蕊试纸检验,若试纸变蓝,则说明含有NH3(或用玻璃棒蘸取浓盐酸检验,若产生白烟,则含有NH3)(其他合理答案均可)CaOCO2(若有NH3,均可)
【解析】
【分析】
煤和水蒸气反应生成氢气,利用空气中氮气和氢气在高温高压催化剂作用下反应生成氨气镁燃烧生成的二氧化碳、生成的氨气和硫酸钙仪器进入沉淀池中发生反应生成碳酸钙沉淀和产品,碳酸钙煅烧得到副产品氧化钙,生成的二氧化碳进入沉淀池循环使用。(1)操作②为分离固体与溶液;(2)工业合成氨是高温高压催化剂条件下反应生成氨气;(3)“产品”为(NH4)2SO4,反应物为CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,据此写出反应方程式;(4)通常用湿润的红色石蕊试纸检验NH3;(5)煅烧碳酸钙后可生成二氧化碳和氧化钙,氧化钙为副产品,二氧化碳可循环利用。
【详解】
(1)将沉淀池中的混合物经过滤可得到产品和沉淀,则操作②为过滤;
(2)工业合成氨的化学方程式为:N2+3H2 2NH3;
(3)“产品”是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,其中离子方程中CaSO4悬浊液要写分子式,沉淀池中生成硫酸铵的化学方程式为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;
(4)利用湿润的红色石蕊试纸检验NH3,操作方法为:用湿润的红色石蕊试纸检验,若试纸变蓝,则说明含有NH3或用玻璃棒蘸取浓盐酸检验,若产生白烟,则含有NH3;
(5)CaCO3煅烧可生成CO2和CaO,其中CO2可循环使用,CaO为副产品。
【点睛】
本题考查了物质制备方案的设计,题目难度中等,明确制备流程及发生反应原理为解答关键,注意掌握化学实验基本操作方法,试题侧重考查学生的分析能力及化学实验能力。
24. 正向 不 逆向 正向 变小 不变 1:3 1:3
【解析】(1). 达到平衡时, 充入N2并保持体积不变,则c(N2)增大,平衡将正向移动,故答案是:正向。
(2). 达到平衡时,充入氩气(Ar)并保持体积不变,总压增大,分压不变,则平衡不移动,故答案是:不。
(3). 达到平衡时,充入氩气(Ar),并保持压强不变,平衡将逆向移动,故答案为:逆向。
(4). 达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强,则平衡正向移动,故答案是:正向。
(5).因该反应是放热反应,所以保持体积不变,升高温度时,平衡将逆向移动,混合气体的总物质的量增加,但总质量不变,根据M= 可知,混合气体的平均相对分子质量将变小;因容器体积不变,混合气体的总质量也不变,根据ρ= 可知,混合气体的密度不变,故答案是:变小;不变。
(6).设反应中N2消耗xmol,容器的体积是1L,根据三段式法,有:
N2 (g) + 3H2 (g)2NH3 (g)
起始量(mol/L) 1 3 0
转化量(mol/L) x 3x 2x
平衡量(mol/L) 1-x 3-3x 2x
所以平衡时N2和H2的浓度比是 = 1:3,N2和H2的转化率比是 = 1:3,故答案是:1:3;1:3。
25.(1) v(X)= 0.15 mol·L-1·min-1;(2)40%;(3)n = 2
【解析】生成的Z为:0.1mol/(L·min)×(2L×2min)=0.4mol
利用三段式法计算:
3X(g)+Y(g)=nZ(g)+2W(g)
起始:1mol 0.5mol 0 0
转化:0.6mol 0.2mol 0.4mol 0.4mol
平衡:0.4mol 0.3mol 0.4mol 0.4mol
(1)由反应速率之比等于化学计量数之比可知:v(X)=3/2v(W)= =0.15 mol·L-1·min-1;,答:前2min内X的平均反应速率为0.15 mol·L-1·min-1;;
(2)平衡时Y的物质的量为0.3mol,则2 min末时Y的转化率α(Y)=0.2mol/0.5mol=0.4,答:2min末时Y的转化率为40%。
(3)v(W)=0.4mol/(2L×2min)
=0.1mol/(L·min),v(Z)=0.4mol/(2L×2min)=0.1mol/(L·min),由反应速率之比等于化学计量数之比可知:n:2=0.1mol/(L·min):0.1mol/(L·min),n=2,
答:化学反应方程式中n的值为2。
点睛:本题考查化学平衡的计算,题目难度不大,注意利用三段式法计算,解题关键:(1)根据v=△c/△t计算平均反应速率;(3)根据反应速率之比等于化学计量数之比计算。
26.(1)0.03 2.25 (2)B (3)0.90
【解析】
试题分析:(1)从0~4 min,v(CO)=(0.20mol·L-1-0.08 mol·L-1)÷4 min=0.03 mol/(L·min); (2)增大反应物中CO的浓度,增大了H2O的转化率,但CO本身的转化率降低;降低反应温度,平衡右移,CO的转化率增大;将密闭容器体积压缩至一半,增大压强,平衡不移动,CO的转化率不变;加入适宜的催化剂,反应速率加快,平衡不移动,CO的转化率不变。(3)设水蒸气的起始浓度至少为x mol/L。当CO的转化率达到90%,则CO的转化浓度为0.18 mol/L,平衡时,CO(g)、H2O(g) 、CO2(g)和H2(g)的浓度分别为0.02 mol/L、(x-0.18)mol/L、0.18 mol/L、0.18 mol/L,代入平衡常数,可求出x=0.90。
考点:化学反应速率及化学平衡常数
点评:化学反应速率和化学平衡常数是高考必考知识点,考生在备考过程中应注意积累掌握典型的题型。
一、单选题(每小题只有一个正确答案)
1.反应C(s)十H2O(g) CO(g)十H2(g) 在一密闭容器中进行,下列条件的改变能使反应速率减小的是( )
A.减少C的量 B.容积不变,增加水蒸气的量
C.升温? D.压强不变,充入Ne
2.在相同条件下,等质量的下列金属与足量1mol/L盐酸反应时,速率最快的是( )
A. 镁 B. 铝 C. 钠 D. 铁
3.某容器中加入N2和H2,在一定条件下,N2+3H22NH3,达到平衡时N2、H2、NH3的浓度分别是3 mol ? L-l、4 mol ? L-1、4 mol ? L-1,则反应幵始时H2的浓度是( )
A. 5 mol ? L-1 B. 10 mol ? L-1 C. 8 mol ? L-1 D. 6.7 mol ? L-1
4.在下列等温恒容中建立起平衡体系3NO2(g)+ H2O(l) 2HNO3(aq) + NO(g)中加入O2 ,则化学平衡( )
A. 向右移动 B. 向左移动 C. 不移动 D. 无法判断
5.下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数从而使有效碰撞次数增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 催化剂不影响活化能但能增大单位体积内活化分子百分数,从而增大反应速率
D. 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
6.对于在密闭容器中进行的反应:N2+O22NO,下列不能加快该反应的反应速率的条件是( )
A.缩小体积 B.充入更多的NO
C.体积增大到原来的2倍 D.升高温度
7.下列说法正确的是 ( )
①增加水的量或温度,可以加快镁跟水的反应速率。②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。③对于反应CaCO3(s) CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率。④对反应3H2(g) + N2(g) 2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快。⑤对于反应3H2(g) + N2(g) 2NH3(g),使用催化剂,正逆反应速率同等程度加快
A. ①② B. ①②③ C. ②⑤ D. ⑤
8.臭氧(O3)是一种很好的消毒剂,具有高效、洁净等优点。O3 可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生如下反应:
反应 I:O3O2 + [O] △H > 0 平衡常数为 K1;
反应 II:O3 + [O] 2O2 △H < 0 平衡常数为 K2; 总反应:2O3 3O2△H < 0平衡常数为 K。
下列叙述正确的是( )
A. K = K1 + K2 B. 压强增大,K2 减小
C. 适当升高温度,可提高消毒效率 D. 降低温度,K 减小
9.100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g) N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
10.在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是( )
t /min 2 4 7 9
n(Y)/mol 0.12 0.11 0.10 0.10
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(L?min)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
11.在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g) △H<0。t1 时刻达到平衡后,在t2 时刻改变某一条件,其反应过程如图所示。下列说法正确的是( )
A. 0~t2时间段内,υ正> υ逆
B. I、Ⅱ两过程达到平衡时,A的体积分数I﹥II
C. t2?时刻改变的条件可能是向密闭容器中加C
D. I、II两过程达到平衡时,平衡常数I﹤II
12.升高温度能加快反应速率的主要原因是( )
A. 活化分子能量明显增加 B. 降低活化分子百分数
C. 增加活化分子百分数 D. 降低反应所需要的能量
13.一定条件下将0.2mol N2和 0.3mol H2置于密闭容器中发生如下反应:。下列关于该反应说法正确的是( )
A. 充分反应后H2无剩余 B. 升高温度使反应速率增大
C. 增大压强使反应速率减小 D. 使用催化剂对反应速率没有影响
14.己知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如下:
温度(℃) 700 800 830 1000 1200
化学平衡常数 1.7 1.1 1.0 0.6 0.4
下列说法正确的是( )
A.该反应的化学平衡常数表达式为:
B.该反应为吸热反应
C.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
D.其它条件不变时,增大体系的压强,化学平衡常数减小
15.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A. CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g ) CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g) ΔH<0
二、填空题
16.在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
锌的质量/g 锌的形状 温度/℃ 完全溶于溶液的时间/s
A 2 薄片 5 400
B 2 薄片 15 200
C 2 薄片 25 100
D 2 薄片 35 t1
E 2 细小颗粒 15 t2
F 2 粉末 15 t3
G 2 薄片(含少量杂质Cu) 35 t4
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
17.25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
t2~t3 t4~t5 t5~t6 t7~t8
K1 K2 K3 K4
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。
18.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)反应开始到10s,用Z表示的反应速率___________________
(2)反应开始到10s时,Y的转化率为__________________
(3)反应的化学方程式为:____________________
19.在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)===2HI(g)。
(1)保持容器容积不变,向其中充入1 mol H2,反应速率________(填“加快”“减慢”或“不变”,下同)。
(2)保持容器容积不变,向其中充入1 mol N2(g)(N2不参加反应),反应速率________。
(3)保持容器内气体压强不变,向其中充入1 mol N2(g)(N2不参加反应),反应速率________。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率________。
20.2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________,4 min末CO的浓度为_____________ mol?L-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________。
三、实验题
21.(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g)2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
22.I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol/L 0.040 0.080 0.080 0.160 0.120
c(S2O82-)/mol/L 0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是____________________________________________________________。
(2)显色时间t1为________。
(3)通过分析比较上述数据,得到的结论是___________________________________________________。
II根据反应4FeS2+11O2===2Fe2O3+8SO2,试回答下列问题。
(1)通常选用哪些物质来表示该反应的化学反应速率____________。
(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为________。
(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为________。
四、推断题
23.“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
24.在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g) + 3H2 (g)2NH3 (g) ΔH <0。
(1)达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
(2)达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
(3)达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
(4)达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
(5)保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
(6)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
五、计算题
25.把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),2 min末生成0.4 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min) ,试计算(写出计算过程)
(1)前2 min内,用X表示的平均反应速率。
(2)2 min末时Y的转化率。
(3)化学方程式中Z的化学计量数n。
26.在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH< 0
已知CO的浓度变化如图所示,第4 minCO的浓度不再改变。
(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min);该反应的平衡常数表达式为:K= ;可计算得该反应的平衡常数结果为:K= 。
(2)为了增大CO的转化率,可以采取的措施有 。
A.增大反应物中CO的浓度
B.降低反应温度
C.将密闭容器体积压缩至一半
D.加入适宜的催化剂
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 mol/L?
试卷第2页,总9页
参考答案
1.D
【解析】
2.C
【解析】金属性越强,与酸反应时速率越快,四种金属的活泼性强弱顺序是Na>Mg>Al>Fe,所以在相同条件下,等质量的四种金属与足量1mol/L盐酸反应时,速率最快的是钠,答案选C。
3.B
【解析】
平衡时氨气是4mol/L,根据方程式可知消耗氢气是6mol/L,平衡时氢气是4mol/L,所以反应幵始时H2的浓度是10mol/L,答案选B。
4.A
【解析】在下列等温恒容中建立起平衡体系3NO2(g)+H2O(l)2HNO3(aq)+NO(g)中加入O2,2NO+O22NO2,上述平衡体系中生成物NO浓度减小,反应物NO2浓度增大,则化学平衡向右移动,故选A。
5.D
【解析】A、增大反应物浓度,可增大单位体积内活化分子数,不是活化分子百分数,A错误;B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),实际就是在增大气体浓度,所以增加的是单位体积内活化分子数,仍然不会增大活化分子的百分数,B错误;C、催化剂会改变反应活化能,从而改变活化分子百分数,所以C错误;D、升高温度会使分子的平均能量升高,从而使达到活化分子的比例增加,即增加了活化分子百分数,D正确。
点睛:从碰撞理论来说,增加反应速率就是要增加单位时间的有效碰撞的次数。而发生有效碰撞要求必须是活化分子。所以增大活化分子百分数是加快反应速率的有效方法。能够影响活化分子百分数的方法,实际只有温度和催化剂。升高温度,会提高分子的平均能量,从而使达到活化分子标准的分子数增加;而加入催化剂是改变了活化能,也就是改变了活化分子的标准,从而改变了活化分子百分数。
6.C
【解析】体积增大到原来的2倍,浓度减小为原来的,化学反应速率减小。
7.D
【解析】①改变纯液体的量,对反应速率无影响,则增加水的量,反应速率不变,但升高温度,可以加快镁跟水的反应速率,选项①错误;②浓硫酸具有强氧化性,与Zn反应不生成氢气,而稀硫酸中浓度大,生成氢气的反应速率快,选项②错误;③碳酸钙是固体,其质量的增加,不能影响反应速率,选项③错误;④固定体积,若充入氦气,反应体系中各物质的浓度不变,反应速率不变,选项④错误;⑤使用催化剂,同等程度加快正逆反应速率,选项⑤正确。答案选D。
8.C
【解析】
【详解】
A.总反应2O33O2平衡常数,反应I O3O2+[O]平衡常数 ,反应II O3 + [O]2O2平衡常数,由此可知K=K1?K2,A项错误;
B.平衡常数只与温度有关,与压强无关,B项错误;
C.反应I是吸热反应,反应II是放热反应,根据勒夏特列原理,升高温度,反应I向正反应方向移动,反应II向逆反应方向移动,都有利于生成游离氧原子[O],消毒效率提高,C项正确;
D.因为2O33O2正反应是放热反应,降低温度平衡向正反应方向移动,K值增大,D项错误;答案选C。
9.A
【解析】
A. 平衡时,Ⅰ、Ⅱ形成等效平衡,Ⅰ、Ⅱ中反应物的转化率α(N2O4)+α(NO2)=1,故A正确;B. 平衡后,再向Ⅱ容器内通入一定量的NO2,相当于加压,平衡右移,又达到平衡时,NO2的体积分数减小,故B错误;C. 如加压平衡右移,Ⅱ容器NO2的平衡转化率增大,该反应的平衡常数不变,故C错误;D. Q(Ⅰ)不一定等于Q(Ⅱ),故D错误。故选A。
点睛:解答本题的难点是选项A。在相同条件下,在元素守恒的前提下,从正反应和逆反应开始建立的平衡是等效平衡。两个过程是互逆的,α(N2O4)+α(NO2)=1。
10.B
【解析】由题中信息可知,反应在第7分钟处于化学平衡状态,平衡时Y的变化量为0.06mol,则根据方程式可知
X(g) + Y(g)2Z(g)
起始浓度(mol/L) 0.016 0.016 0
转化浓度(mol/L) 0.006 0.006 0.012
平衡浓度(mol/L) 0.01 0.01 0.012
A.反应前2min内Y减少了0.04mol,则生成Z是0.08mol,浓度是0.008mol/L,所以平均速率v(Z)=0.008mol/L÷2min=4.0×10-3mol/(L·min),A错误;B. 该反应为放热反应,其他条件不变,降低温度,化学平衡向正反应方向移动,反应达到新平衡前v(逆)<v(正),B正确;C. 该温度下此反应的平衡常数K=,C错误;D. 该反应前后气体的分子数不变,所以改变压强后,平衡不移动。其他条件不变,再充入0.2molZ,相当于对原平衡加压,所以平衡时X的体积分数不变,D错误。答案选B。
11.C
【解析】试题分析:A、0~t2时,反应正向进行,v(正)>v(逆),t1~t2时,反应达到平衡,v(正)=v(逆),故错误,不选A;B、t2时刻改变条件后达到平衡时,逆反应速率不变,说明和原平衡等效,A的体积分数Ⅰ=Ⅱ,错误,不选B;C、向密度容器中加C ,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,说明和原平衡相同,符合图形,正确,选C;D、t2时刻改变条件后达到平衡时逆反应速率不变,说明和原平衡等效,所以Ⅰ、Ⅱ两过程达到平衡时,平衡常数相等,错误,故不选D。
考点: 化学平衡的建立
12.C
【解析】升高温度,将更多的分子转化为活化分子,活化分子百分数增大,有效碰撞次数增多,则反应速率增大,只有C正确,故选C。
13.B
【解析】A、这是一个可逆反应,任何物质都不可能完全没有,故A错误;B、升高温度可加快反应速率,所以B正确;C、增大压强,使体积缩小,浓度增大,所以反应速率加快,故C错误;D、使用催化剂可加快反应速率,但平衡不移动,故D错误。本题正确答案为B。
14.C
【解析】
试题分析:A、A为固体,表达式错误;B、温度升高,K减小,平衡逆向移动,故逆反应为吸热,正反应放热,错误;C、生成B为逆方向,生成D为正方向,正确;D、增大压强,平衡逆向移动,化学平衡常数不变,错误。
考点:考查化学反应速率与化学平衡相关知识,涉及平衡常数表达式,平衡移动、平衡状态的判断等相关知识。
15.D
【解析】
温度越高,反应越快,到达平衡的时间就越少,因此T2>T1;同理压强越大,反应越快,到达平衡的时间就越少,因此P1>P2;
A、该反应是吸热的可逆反应,升高温度平衡正向移动,则T2时水蒸气含量应该比T1时大,与图象不符,故A错误;
B、该反应是一个体积增大和吸热的可逆反应,升高温度平衡向正反应方向移动,水蒸气的含量增大;增大压强,平衡向逆反应方向移动,水蒸气的含量减小,不符合图象,故B错误;
C、该反应是一个体积增大和放热的可逆反应,增大压强平衡逆向移动,水蒸气的含量减少,与图像不符,故C错误;
D、该反应是一个体积减小和放热的可逆反应,因此升高温度平衡向逆反应方向移动,水蒸气的含量降低;而增大压强平衡向正反应方向移动,水蒸气的含增大量,与图像相符,故D正确。
此题答案选D。
【名师点睛】灵活运用影响化学平衡的因素是解题关键,根据图(1)到达平衡时所用时间的长短判断温度T1和T2的相对大小,升高温度,化学平衡向吸热方向移动,再结合水蒸气的含量变化情况判断该反应的正反应是放热还是吸热;根据图(2) 到达平衡时所用时间的长短判断压强P1和P2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小。
16.(1)50 (2)温度每升高10℃,反应速率加快到原来的2倍(3)> G组中可形成Cu—Zn原电池,反应速率加快> F组中锌为粉末状,表面积较大,反应速率加快 (4)mF>mB>mE(每空1分)
【解析】
17.(1)A(g)+2B(g) 2C(g)(不写物质的状态也可) 0.05 mol·L-1·min-1
(2)增大压强(或缩小容器体积)
(3)K1>K2=K3=K4 t2~t3
【解析】(1)由图1中曲线变化情况可知:A和B是反应物,C是生成物,再由物质的量的变化值可得化学计量数之比。(2)已知反应达平衡后,降低温度,A的转化率将增大,说明正反应是放热反应。在5~7 min内,K值不变,说明平衡移动不是由温度变化引起的,因此此处改变的条件只能是增大压强。(3)根据速率—时间图像分析,t3时改变的条件是升温,t5时改变的条件是使用催化剂,t6时改变的条件是减压,因此有K1>K2=K3=K4。由于t3、t6时条件的改变均导致化学平衡逆向移动,因此A的转化率最大的一段时间是t2~t3。
18. 0.079 mol/(L?s) 79% X+Y2Z
【解析】(1)反应开始到10s,用Z表示的反应速率为:v==0.079mol/(L?s),故答案为:0.079mol/(L?s);
(2)反应开始到10s时,Y的转化率为×100%=79%,故答案为:79%;
(3)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,经过10s后,物质的物质的量不再发生变化,达到平衡状态,则反应的化学方程式为X+Y2Z,故答案为:X+Y2Z。
19. 加快 不变 减慢 不变
【解析】(1)在容器容积不变时,充入1 mol H2即c(H2)增大,化学反应速率加快;(2)保持容器容积不变,充入N2(不参加反应的气体),各成分浓度未变,则反应速率不变;(3)保持容器压强不变,充入N2,体积增大,各成分浓度减小,则反应速率减慢;(4)保持容器内气体压强不变,保持充入H2(g)、I2(g)各1 mol,体积增大,压强未变,浓度也不变,则速率不变。
点睛:关于压强对反应速率的影响需要注意以下三点:(1)参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。(2)对有气体参加的反应,压强改变?气体物质浓度改变?化学反应速率改变,即压强改变的实质是通过改变浓度引起的,如2SO2(g)+O2(g)2SO3(g)增大压强,SO2、O2、SO3的浓度均增大,正、逆反应速率均增大。(3)有气体参加的反应体系中充入“惰性气体”(不参与反应)时,对化学反应速率的影响:①恒容:充入“惰性气体”→总压增大→物质浓度不变(活化分子浓度不变)→反应速率不变。②恒压:充入“惰性气体”→体积增大→物质浓度减小(活化分子浓度减小)→反应速率减慢。
20. C D 0.05 mol?L-1·min-1 0.8 400 K,1 MPa
【解析】本题主要考查影响化学平衡的因素及其反应速率的计算。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD。
A.使用催化剂不改变平衡状态,不影响反应物的转化率,故A不符合题意;B.升高反应体系的温度,平衡左移,NO的转化率降低,故B不符合题意;C.该反应放热,降低反应体系的温度,平衡右移,NO的转化率提高,故C符合题意;D.该反应气体物质的量减小,加压平衡右移,NO的转化率提高,故C符合题意。故选CD。
(2)NO从反应开始到平衡时的平均反应速率v(NO)=0.20/4 mol?L-1·min-1=0.05 mol?L-1·min-1,4 min末CO的浓度(1-0.2)mol?L-1=0.8 mol?L-1。
(3)工业上催化装置比较适合的温度和压强是400 K,1 MPa。
21.①K= ②不变 增大 ③ 0.01mol/(L·min)
(2)① 降温 ②AC
【解析】
试题分析:(1)反应平衡常数K值只与温度有关,与反应物浓度无关。其他条件相同时,
增大反应物浓度反应速率增大。计算平均反应速率,以反应物B为例:V(B)=1.5mol/15min
×10L (2)在t2时反应速率骤降,温度降低,分子运动速率减慢,反应速度也减慢。
影响反应速率的因素有温度、浓度、压强、催化剂,在t4时反应速率升高,对于有气体
参与的化学反应,其他条件不变时(除体积),增大压强,即体积减小,反应物浓度增大,
速率增加。正催化剂能使反应速率增加。选项D、E升高温度与增大A浓度虽然能使反应速
率增加,但会是平衡移动,故不符合。
考点:反应速率、反应平衡及计算;影响反应速率的因素;
点评:综合考查学生对反应速率章节内容的掌握:
①反应平衡常数K值只与温度有关,与反应物浓度无关。②影响反应速率的因素有温度、浓
度、压强、催化剂;③对于有气体参与的化学反应,其他条件不变时(除体积),增大压强,
即体积减小,反应物浓度增大,速率增加。
22.研究反应物I-与S2O82-的浓度对反应速率的影响 29.3 化学反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比) SO2或O2 0.88 mol·L-1·s-1 5.0 mol·L-1
【解析】
【详解】
I.(1)根据“题给反应的反应速率可以用加入的I3-使淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大”,实验设计了在相同温度下,不同的反应物浓度测定相应的反应时间,目的是探究反应物I-与S2O82-的浓度对反应速率的影响;综上所述,本题答案是:研究反应物I-与S2O82-的浓度对反应速率的影响 。
(2)通过分析各组数据知,反应物起始浓度的乘积与时间成反比,由①、⑤列比例式,可以解得t1:(0.040 mol?L-1×0.040mol?L-1):(0.120 mol?L-1×0.040mol?L-1)=t1:88.0s,解得t1=88/3=29.3s ;综上所述,本题答案是:29.3。
(3)通过第(1)、(2)小题的分析可知,结合表格中数据变化规律,我们已经知道了反应物的浓度乘积与时间成反比,而浓度的变化量与时间的比值为速率,显色时间越短,反应速率越快,所以根据本题的实验数据最终得到的结论为:反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比);综上所述,本题答案是:化学反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
II(1)只有气体或者溶液才有浓度的变化,固体或者纯液体的浓度是定值,故应选用SO2或O2来表示该反应的化学反应速率,因此,本题正确答案是: SO2或O2。
(2)v(SO2):v(O2)=8:11,故v(O2)=11/8×0.64=0.88 mol·L-1·s-1;综上所述,本题答案是:0.88 mol·L-1·s-1。
(3)?c(SO2)=0.4×4=1.6mol/L,?c(O2)=11/8?c(SO2)=11/8×1.6=2.2 mol·L-1,故c(O2)=2.8+2.2=5.0 mol·L-1;综上所述,本题答案是:5.0 mol·L-1。
23.过滤N2+3H22NH3CaSO4+CO2+2NH3+H2O===CaCO3↓+(NH4)2SO4用湿润的红色石蕊试纸检验,若试纸变蓝,则说明含有NH3(或用玻璃棒蘸取浓盐酸检验,若产生白烟,则含有NH3)(其他合理答案均可)CaOCO2(若有NH3,均可)
【解析】
【分析】
煤和水蒸气反应生成氢气,利用空气中氮气和氢气在高温高压催化剂作用下反应生成氨气镁燃烧生成的二氧化碳、生成的氨气和硫酸钙仪器进入沉淀池中发生反应生成碳酸钙沉淀和产品,碳酸钙煅烧得到副产品氧化钙,生成的二氧化碳进入沉淀池循环使用。(1)操作②为分离固体与溶液;(2)工业合成氨是高温高压催化剂条件下反应生成氨气;(3)“产品”为(NH4)2SO4,反应物为CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,据此写出反应方程式;(4)通常用湿润的红色石蕊试纸检验NH3;(5)煅烧碳酸钙后可生成二氧化碳和氧化钙,氧化钙为副产品,二氧化碳可循环利用。
【详解】
(1)将沉淀池中的混合物经过滤可得到产品和沉淀,则操作②为过滤;
(2)工业合成氨的化学方程式为:N2+3H2 2NH3;
(3)“产品”是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,其中离子方程中CaSO4悬浊液要写分子式,沉淀池中生成硫酸铵的化学方程式为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;
(4)利用湿润的红色石蕊试纸检验NH3,操作方法为:用湿润的红色石蕊试纸检验,若试纸变蓝,则说明含有NH3或用玻璃棒蘸取浓盐酸检验,若产生白烟,则含有NH3;
(5)CaCO3煅烧可生成CO2和CaO,其中CO2可循环使用,CaO为副产品。
【点睛】
本题考查了物质制备方案的设计,题目难度中等,明确制备流程及发生反应原理为解答关键,注意掌握化学实验基本操作方法,试题侧重考查学生的分析能力及化学实验能力。
24. 正向 不 逆向 正向 变小 不变 1:3 1:3
【解析】(1). 达到平衡时, 充入N2并保持体积不变,则c(N2)增大,平衡将正向移动,故答案是:正向。
(2). 达到平衡时,充入氩气(Ar)并保持体积不变,总压增大,分压不变,则平衡不移动,故答案是:不。
(3). 达到平衡时,充入氩气(Ar),并保持压强不变,平衡将逆向移动,故答案为:逆向。
(4). 达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强,则平衡正向移动,故答案是:正向。
(5).因该反应是放热反应,所以保持体积不变,升高温度时,平衡将逆向移动,混合气体的总物质的量增加,但总质量不变,根据M= 可知,混合气体的平均相对分子质量将变小;因容器体积不变,混合气体的总质量也不变,根据ρ= 可知,混合气体的密度不变,故答案是:变小;不变。
(6).设反应中N2消耗xmol,容器的体积是1L,根据三段式法,有:
N2 (g) + 3H2 (g)2NH3 (g)
起始量(mol/L) 1 3 0
转化量(mol/L) x 3x 2x
平衡量(mol/L) 1-x 3-3x 2x
所以平衡时N2和H2的浓度比是 = 1:3,N2和H2的转化率比是 = 1:3,故答案是:1:3;1:3。
25.(1) v(X)= 0.15 mol·L-1·min-1;(2)40%;(3)n = 2
【解析】生成的Z为:0.1mol/(L·min)×(2L×2min)=0.4mol
利用三段式法计算:
3X(g)+Y(g)=nZ(g)+2W(g)
起始:1mol 0.5mol 0 0
转化:0.6mol 0.2mol 0.4mol 0.4mol
平衡:0.4mol 0.3mol 0.4mol 0.4mol
(1)由反应速率之比等于化学计量数之比可知:v(X)=3/2v(W)= =0.15 mol·L-1·min-1;,答:前2min内X的平均反应速率为0.15 mol·L-1·min-1;;
(2)平衡时Y的物质的量为0.3mol,则2 min末时Y的转化率α(Y)=0.2mol/0.5mol=0.4,答:2min末时Y的转化率为40%。
(3)v(W)=0.4mol/(2L×2min)
=0.1mol/(L·min),v(Z)=0.4mol/(2L×2min)=0.1mol/(L·min),由反应速率之比等于化学计量数之比可知:n:2=0.1mol/(L·min):0.1mol/(L·min),n=2,
答:化学反应方程式中n的值为2。
点睛:本题考查化学平衡的计算,题目难度不大,注意利用三段式法计算,解题关键:(1)根据v=△c/△t计算平均反应速率;(3)根据反应速率之比等于化学计量数之比计算。
26.(1)0.03 2.25 (2)B (3)0.90
【解析】
试题分析:(1)从0~4 min,v(CO)=(0.20mol·L-1-0.08 mol·L-1)÷4 min=0.03 mol/(L·min); (2)增大反应物中CO的浓度,增大了H2O的转化率,但CO本身的转化率降低;降低反应温度,平衡右移,CO的转化率增大;将密闭容器体积压缩至一半,增大压强,平衡不移动,CO的转化率不变;加入适宜的催化剂,反应速率加快,平衡不移动,CO的转化率不变。(3)设水蒸气的起始浓度至少为x mol/L。当CO的转化率达到90%,则CO的转化浓度为0.18 mol/L,平衡时,CO(g)、H2O(g) 、CO2(g)和H2(g)的浓度分别为0.02 mol/L、(x-0.18)mol/L、0.18 mol/L、0.18 mol/L,代入平衡常数,可求出x=0.90。
考点:化学反应速率及化学平衡常数
点评:化学反应速率和化学平衡常数是高考必考知识点,考生在备考过程中应注意积累掌握典型的题型。
