第一轮复习第八单元教学案[下学期]
文档属性
| 名称 | 第一轮复习第八单元教学案[下学期] | 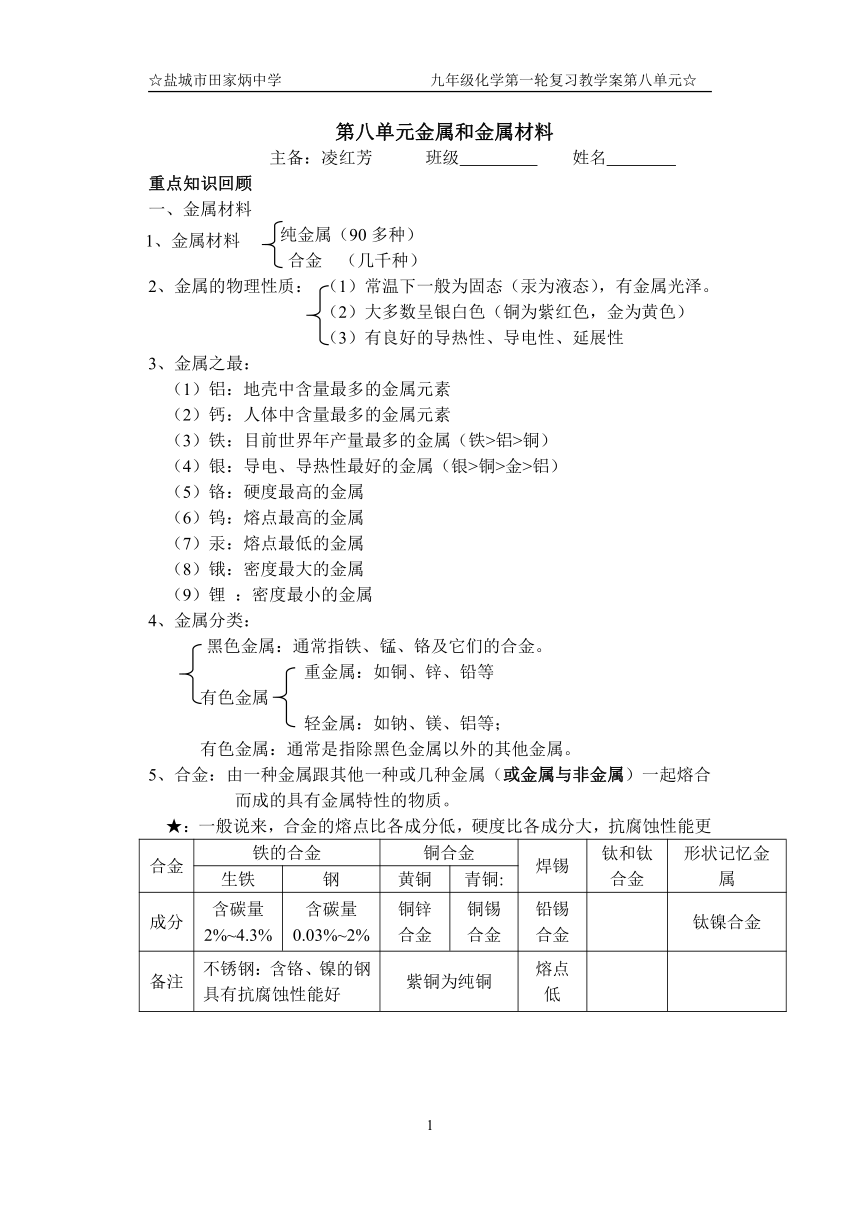 | |
| 格式 | rar | ||
| 文件大小 | 300.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-22 12:19:00 | ||
图片预览





文档简介
☆盐城市田家炳中学 九年级化学第一轮复习教学案第八单元☆
第八单元金属和金属材料
主备:凌红芳 班级 姓名
重点知识回顾
一、金属材料
纯金属(90多种)
合金 (几千种)
2、金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)
(3)有良好的导热性、导电性、延展性
3、金属之最:
(1)铝:地壳中含量最多的金属元素
(2)钙:人体中含量最多的金属元素
(3)铁:目前世界年产量最多的金属(铁>铝>铜)
(4)银:导电、导热性最好的金属(银>铜>金>铝)
(5)铬:硬度最高的金属
(6)钨:熔点最高的金属
(7)汞:熔点最低的金属
(8)锇:密度最大的金属
(9)锂 :密度最小的金属
4、金属分类:
黑色金属:通常指铁、锰、铬及它们的合金。
重金属:如铜、锌、铅等
有色金属
轻金属:如钠、镁、铝等;
有色金属:通常是指除黑色金属以外的其他金属。
5、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
合金 铁的合金 铜合金 焊锡 钛和钛合金 形状记忆金属
生铁 钢 黄铜 青铜:
成分 含碳量2%~4.3% 含碳量0.03%~2% 铜锌合金 铜锡合金 铅锡合金 钛镍合金
备注 不锈钢:含铬、镍的钢具有抗腐蚀性能好 紫铜为纯铜 熔点低
★:一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更
注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
(1)熔点高、密度小
优点 (2)可塑性好、易于加工、机械性能好
(3)抗腐蚀性能好
二、金属的化学性质
1、大多数金属可与氧气的反应
2、金属 + 酸 → 盐 + H2↑
3、金属 + 盐 → 另一金属 + 另一盐(条件:“前换后,盐可溶”)
Fe + CuSO4 == Cu + FeSO4 (“湿法冶金”原理)
三、常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性就越强
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na、Ba)
四、金属资源的保护和利用
1、铁的冶炼
(1)原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
3CO + Fe2O3高温2Fe + 3CO2
(2)原料:铁矿石、焦炭、石灰石、空气
常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 )
2、铁的锈蚀
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3)
(铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、 电镀、烤蓝等
③制成不锈钢
铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。因而铁锈应及时除去。而铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
3、金属资源的保护和利用:
保护金属资源的途径:
①防止金属腐蚀
②回收利用废旧金属
③合理开采矿物
④寻找金属的代用品
意义:节约金属资源,减少环境污染
课前热身
1.金属中,熔点最高的金属,硬度最高的金属,目前世界年产量最高的金属依次是( )
A.Cr W A1 B.W Cr A1 C.Cr W Fe D.W Cr Fe
2.根据金属活动性顺序判断,下列各给内的两种物质,相互之间不能发生化学反应的是 ( )
A.镁和稀硫酸 B.银和稀盐酸
C.锌和硫酸铜溶液 D.铝和硝酸银溶液
3.下列物质中,能除去铁制品表面铁锈的是( )
A.稀硫酸 B.氢氧化钠溶液 C.食盐水 D.碳酸钠溶液
4.下列叙述不正确的是 ( )
A.黄铜和铜相比,强度和硬度都要高一些
B.一般在水龙头表面镀铬以防生锈
C.银的导电性比铜好,应该提倡使用银制导线
D.钛合金与人体具有很好的相容性,可用来制造人造骨
5.新买来的铝锅、铝壶用来烧水时,凡是水浸到的地方都会变黑,是因为水中溶有( )
A.钾盐 B.钠盐 C.钙盐 D.铁盐
6.将铁片放人足量稀硫酸中,看到的现象:a.有气泡产生;b.有红色的物质生成;c.溶液变为浅绿色;d.溶液变成蓝色;e.铁片逐渐变小最后消失。其中正确的是 ( )
A.abc B.ace C.bce D.adc
7.在稀盐酸中,加入下列固体物质,溶液的pH几乎不变的是 ( )
A.锌粒 B.氢氧化钠 C.铁锈 D.硝酸银
8.金属是人类生产生活都离不开的重要材料。根据下图所示人类大规模开发、利用几种金属的大致年代和有关的化学知识,有同学认为对金属大规模开发、利用的先后顺序的影响因此有:①地壳中金属元素的含量 ②金属的导电性 ③金属的活动性 ④金属冶炼的难易程度 ⑤金属的延展性,其中正确的是 ( )
A.①③⑤ B.①②④ C.③④ D.②⑤
9.某单质X能从某溶液中置换出单质Y,由此推断下列说法中正确的是 ( )
A.X一定是排在金属活动顺序表中的氢以前的金属
B.X是金属时,Y可能是金属,也可能是非金属
C.X是金属时,Y一定是金属
D.X、Y都是金属时,Y一定比X活泼
10.在5.6g混有少量铜粉的铁粉中加入足量稀硫酸,产生氢气的质量为( )
A.大于0.2g B.等于0.2g C.小于0.2g D.无法确定
11.向只溶解有硝酸银和硝酸铜墙铁壁的溶液中加入一定量的铁粉,充分反应后溶液中仍有金属固体,过滤后往滤渣中加入盐酸,有无色气体放出,则滤液中一定存在的溶质是( )
A.硝酸亚铁、硝酸铜 B.硝酸亚铁、硝酸银
C.硝酸亚铁、硝酸铜、硝酸银 D.硝酸亚铁
12.某工厂排放的酸性废水中含有较多的CuSO4,这种废水对农作物和人畜有害。为了降低废水的酸性并且回收铜,通常需要在此废水中加入适量的 ( )
A.熟石灰 B.铁和生石灰 C.银和石灰石 D.氢氧化钠
13.为研究锰、铜、镍(Ni)的金属活动性,进行如下实验:将镍丝分别插入MnSO4溶液和CuSO4溶液中,前者镍丝表面无变化,后者镍丝表面有红色固体析出。由此可得出,锰、铜、镍三种金属活动性由强到弱的顺序为( )
A.Cu Mn Ni B.Mn Ni Cu
C.Ni Cu Mn D.Ni Mn Cu
14.向一定量的硫酸锌与稀硫酸的混合溶液中加入锌粒直至过量,如右图所示的图象,若以加入的锌粒质量为横坐标,则纵坐标是指( )
A.生成气体的质量 B.溶液的质量
C.溶液中硫酸的质量 D.溶液中水的质量
15.下列物质中,铁元素的质量分数最高的是 ( )
A.FeSO4 B.FeCO3 C.Fe3O4 D.生铁
16.自行车的主要材料钢铁易生锈。请为右图中标示的自行车部件各设计一种不同的、合理的防锈方法。
⑴三角架:
⑵辐条:
⑶链条:
17.⑴下表是两种常见金属的部分性质:
金属名称 颜色 密度 熔点 导电性 硬度 化学特性
铝 银白色 2.79g/cm3 660℃ 良好 较软 常温下能与空气中的氧气作用,在金属表面形成致密氧化膜
铁 银白色 7.86g/cm3 1535℃ 良好 一般 在潮湿的空气中容易产生铁锈
①根据表中金属铝的性质,试推断金属铝可能的一种用途是_____________________;
②铝比铁金属活动性强,但铝制品耐用而铁制品却容易锈蚀,其原因是___________________;
⑵黄金(Au)是一种贵金属,素有“真金不怕火炼”之说,这说明了金的化学性质在自然条件下非常________(填“稳定”或“活泼”);成语“点石成金”本意为将石头变成黄金,你同意这种说法吗?请运用相关的化学知识加以解释:________________________________。
18.铁匠师傅往往用反复敲打发红的铁器的方法来降低铁中的含碳量,你知道含碳量是如何降低的吗 用化学方程式表示____________________。
19.小强同学设计了如右图所示的实验,你想一想:
⑴该实验探究的问题是
__________________________。
⑵实验过程中,发生反应化学方程式是
_________________________。
⑶通过该实验可得出的结论是
____________________________。
20.为了探究影响金属与酸反应剧烈程度的因素,进行了以下实验:
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与5%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸反应和10%盐酸反应 10%盐酸产生气体快
由此得出影响金属与酸反应剧烈程度的困素有:
因素一:_______________________________;
因素二:_______________________________;
因素三:_______________________________。
21.钛(Ti)因为有许多神奇的性能而越来越引起人们的关注,常温下钛的化学性质很稳定, 与酸不反应。红热时,却可以与许多物质反应,钛是航空、宇航、军工、电力等方面必须的原料。地壳中含钛矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石,炭粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性的气体,此反应的化学方程式________________________________
第二步:在氩气的氛围中,用过量的镁在加热的条件与TiCl4反应制得金属钛。
⑴此反应的化学方程式为__________________________________。
⑵上述产物中常会有的杂质是________。简述除去此杂质的主要步骤____________,并写出反应的化学方程式____________________________。
22.将一根干燥的铁丝弯成如右图所示的形状,并将其两端分别插入盛有水的烧杯甲中和盛有油的烧杯乙中,放置数天后,观察铁丝A、B、C三处表面发生的变化是否相同 (若不相同,请具体说明)
__________________
23..某钢铁厂用含杂质19%的赤铁矿冶炼生铁,求8000kg这种矿石可炼出含铁96%的生铁多少千克?
拓展训练
1.在互联网上用Coogle搜索“中央电视台每周质量报告”时,可搜索到被曝光的事件中一定涉及到化学变化的是 ( )
A.用毛发水、酱色、水、盐等兑制成“假酱油”
B.用工业石蜡等涂抹在瓜子表面给瓜子“美容”
C.用硫磺燃烧法熏蒸粉丝
D.用淀粉、蔗糖、奶香精等掺和成“假奶粉”
2.生活中废弃的铝质易拉罐、破铁锅、废铜线等可归为一类加以回收,它们属于 ( )
A.有机物 B.金属或合金 C.氧化物 D.非金属
3.学习化学我们要经常做实验。下列实验操作正确的是 ( )
A B C D
4.图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中不正确的是
A.根据金属活动性顺序表,判断金属能否置换出稀硫酸中的氢
B.根据密度数据表判断液体物质挥发性的大小
C.根据溶解度曲线图,判断从溶液中获得晶体的方法
D.根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行
5.小明想除去卫生间瓷砖上的铁锈痕迹,在用清水洗涤之前,他从家中选择了一种最合适的物质对铁锈进行处理,这种物质是 ( )
A.汽油 B.食盐水 C.白醋 D.米酒
6.为测定a、b、c三种金属的活动性强弱,某同学将金属a、b、c分别放入稀硫酸中,b溶解并产生气泡,a、c不反应;另将a放入c的硝酸盐溶液中,a表面析出c。据此分析,三种金属的活动性由强到弱的顺序为
A.b、a、c B.c、b、a C.b、c、a D. a、b、c
7.为测定铁、铜和银的金属活动性顺序,下列不能达到目的的试剂组是
A、Ag,Fe,CuSO4溶液 B、Ag,FeSO4溶液,CuSO4溶液
C、Fe,Cu,AgNO3溶液 D、Cu, FeSO4溶液,AgNO3溶液
8.下列所示物品中,不是利用合成有机高分子材料制成的是( )
9.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量最高的金属元素是 。
(2)金属具有的物理性质有: 。
(3)日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能。
由上表推断,与组成合金的纯金属相比,合金的优点一般有(填序号)
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性更好
(4)人们每年要从金属矿物资源中提取数以亿吨计的金属。根据所学化学知识,按要求写出两个生成金属的化学方程式:
① (置换反应)
② (分解反应)
10.⑴考古发掘出的铜器表面往往有一层厚厚的铜绿[主要成分Cu2(OH)2CO3],试用化学方程式解释铜绿形成的原因。
⑵为什么高档电器的铜质插孔、插头表面要镀上价格比铜昂贵碉导电性又不如铜的金?
⑶不法商贩常在金中掺入铜打制“纯金”饰品出售。如何识别这种假冒“纯金”戒指。
操作步骤
现象
分析
⑷许多资源都是不可再生的,每个公民都应树立保护资源的观念。下列做法不利于保护金属资源的是 (填选项字母)
A.采取各种有效防锈方法避免金属锈蚀
B.用塑料代替钢和其他合金制造管道
C.私挖、滥采矿物
D.回收利用铝制饮料罐
11.已知A、B、C、D、E、F为常见物质,其中A、B含有相同的元素,B、E为氧化物,C、D、F都为单质。它们相互转化的关系如右图所示(图中反应条件略去)。
(1)X在反应①中起 作用。
(2)写出有关物质的化学式:
A 、C 。
(3)若F不溶于稀硫酸,写出反应③的化学方程式 ,
该反应的基本类型是__________。与D具有相同化学性质,并能与E发生反应,且反应基本类型与③相同的物质有 。
12.铜陵被誉为我国的“铜都”。右图是铜陵铜工艺品中著名的四喜娃娃,小明找到了分别用纯铜、青铜(Cu、Sn合金)两种材料制作的四喜娃娃及用于实验的纯铜片和青铜片。
(1)怎样用化学方法区分这两种四喜娃娃
区分纯铜和青铜的实验方法是:_______________________________。
(2)四喜娃娃为什么生锈了
通过查阅资料得知,金属铜长时间放置在空气中,能够和空气中氧气等物质发生化学反应,生成铜绿[Cu2(OH)C03]。请你根据铜绿的组成推断,铜变成铜绿时,空气中的02、_______、_________________参加了反应。(填化学式)
(3)哪种四喜娃娃更容易生锈
小明发现从不同地点收集到的两个四喜娃娃中,青铜娃娃身上的锈斑比纯铜的多,他据此得出结论:青铜比纯铜更容易生锈。
他的这种推理方法是否科学 ____________。
请说出理由:_________________________。
(4)青铜四喜娃娃的铜绿中为什么会有褐色的锈斑
由于有的青铜中含杂质较多,尤其是含铁,故在铜绿间还会有斑驳的、呈褐色的氧化铁。现有一些这种含褐色的锈斑粉末,请你设计实验证明锈斑粉末中含有铁元素。
13.在焊接两根铁轨时,为确保施工质量,工程技术人员常用到一种叫做“引火铁”的反应活性材料。实验室的制备过程如下:⑴在高温条件下用普通铁粉和水蒸气反应,得到粉末状的四氧化三铁;⑵将四氧化三铁粉末在高温条件下经过与上述过程相反的反应生成“引火铁”粉末。请分别用以下两套装置,制取四氧化三铁和“引火铁”。实验中必须使用普通铁粉和稀硫酸,其他试剂和用品自选。(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)
填写下列空白:
(1)实验过程中第(1)、(2)两个相反步骤的反应方程式是:
①____________________________________ ②____________________________________
(2)在实验装置中,烧瓶B的作用是____________________。
(3)实验时试管A中加入的固体是_________,试管D处可收集到的气体是______。
(4)实验时分液漏斗E中应加入的试剂是___________,在F中加入的固体是_________,在U型管G中常加入固体氢氧化钠,其作用是__________________________。
(5)实验过程中,两套装置里所有需要加热的仪器是______(填字母)。
1、金属材料
①
D
③
②
A
X
B
C
X
E
F
B
PAGE
2
第八单元金属和金属材料
主备:凌红芳 班级 姓名
重点知识回顾
一、金属材料
纯金属(90多种)
合金 (几千种)
2、金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)
(3)有良好的导热性、导电性、延展性
3、金属之最:
(1)铝:地壳中含量最多的金属元素
(2)钙:人体中含量最多的金属元素
(3)铁:目前世界年产量最多的金属(铁>铝>铜)
(4)银:导电、导热性最好的金属(银>铜>金>铝)
(5)铬:硬度最高的金属
(6)钨:熔点最高的金属
(7)汞:熔点最低的金属
(8)锇:密度最大的金属
(9)锂 :密度最小的金属
4、金属分类:
黑色金属:通常指铁、锰、铬及它们的合金。
重金属:如铜、锌、铅等
有色金属
轻金属:如钠、镁、铝等;
有色金属:通常是指除黑色金属以外的其他金属。
5、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
合金 铁的合金 铜合金 焊锡 钛和钛合金 形状记忆金属
生铁 钢 黄铜 青铜:
成分 含碳量2%~4.3% 含碳量0.03%~2% 铜锌合金 铜锡合金 铅锡合金 钛镍合金
备注 不锈钢:含铬、镍的钢具有抗腐蚀性能好 紫铜为纯铜 熔点低
★:一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更
注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
(1)熔点高、密度小
优点 (2)可塑性好、易于加工、机械性能好
(3)抗腐蚀性能好
二、金属的化学性质
1、大多数金属可与氧气的反应
2、金属 + 酸 → 盐 + H2↑
3、金属 + 盐 → 另一金属 + 另一盐(条件:“前换后,盐可溶”)
Fe + CuSO4 == Cu + FeSO4 (“湿法冶金”原理)
三、常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性就越强
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na、Ba)
四、金属资源的保护和利用
1、铁的冶炼
(1)原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
3CO + Fe2O3高温2Fe + 3CO2
(2)原料:铁矿石、焦炭、石灰石、空气
常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 )
2、铁的锈蚀
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3)
(铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、 电镀、烤蓝等
③制成不锈钢
铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。因而铁锈应及时除去。而铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
3、金属资源的保护和利用:
保护金属资源的途径:
①防止金属腐蚀
②回收利用废旧金属
③合理开采矿物
④寻找金属的代用品
意义:节约金属资源,减少环境污染
课前热身
1.金属中,熔点最高的金属,硬度最高的金属,目前世界年产量最高的金属依次是( )
A.Cr W A1 B.W Cr A1 C.Cr W Fe D.W Cr Fe
2.根据金属活动性顺序判断,下列各给内的两种物质,相互之间不能发生化学反应的是 ( )
A.镁和稀硫酸 B.银和稀盐酸
C.锌和硫酸铜溶液 D.铝和硝酸银溶液
3.下列物质中,能除去铁制品表面铁锈的是( )
A.稀硫酸 B.氢氧化钠溶液 C.食盐水 D.碳酸钠溶液
4.下列叙述不正确的是 ( )
A.黄铜和铜相比,强度和硬度都要高一些
B.一般在水龙头表面镀铬以防生锈
C.银的导电性比铜好,应该提倡使用银制导线
D.钛合金与人体具有很好的相容性,可用来制造人造骨
5.新买来的铝锅、铝壶用来烧水时,凡是水浸到的地方都会变黑,是因为水中溶有( )
A.钾盐 B.钠盐 C.钙盐 D.铁盐
6.将铁片放人足量稀硫酸中,看到的现象:a.有气泡产生;b.有红色的物质生成;c.溶液变为浅绿色;d.溶液变成蓝色;e.铁片逐渐变小最后消失。其中正确的是 ( )
A.abc B.ace C.bce D.adc
7.在稀盐酸中,加入下列固体物质,溶液的pH几乎不变的是 ( )
A.锌粒 B.氢氧化钠 C.铁锈 D.硝酸银
8.金属是人类生产生活都离不开的重要材料。根据下图所示人类大规模开发、利用几种金属的大致年代和有关的化学知识,有同学认为对金属大规模开发、利用的先后顺序的影响因此有:①地壳中金属元素的含量 ②金属的导电性 ③金属的活动性 ④金属冶炼的难易程度 ⑤金属的延展性,其中正确的是 ( )
A.①③⑤ B.①②④ C.③④ D.②⑤
9.某单质X能从某溶液中置换出单质Y,由此推断下列说法中正确的是 ( )
A.X一定是排在金属活动顺序表中的氢以前的金属
B.X是金属时,Y可能是金属,也可能是非金属
C.X是金属时,Y一定是金属
D.X、Y都是金属时,Y一定比X活泼
10.在5.6g混有少量铜粉的铁粉中加入足量稀硫酸,产生氢气的质量为( )
A.大于0.2g B.等于0.2g C.小于0.2g D.无法确定
11.向只溶解有硝酸银和硝酸铜墙铁壁的溶液中加入一定量的铁粉,充分反应后溶液中仍有金属固体,过滤后往滤渣中加入盐酸,有无色气体放出,则滤液中一定存在的溶质是( )
A.硝酸亚铁、硝酸铜 B.硝酸亚铁、硝酸银
C.硝酸亚铁、硝酸铜、硝酸银 D.硝酸亚铁
12.某工厂排放的酸性废水中含有较多的CuSO4,这种废水对农作物和人畜有害。为了降低废水的酸性并且回收铜,通常需要在此废水中加入适量的 ( )
A.熟石灰 B.铁和生石灰 C.银和石灰石 D.氢氧化钠
13.为研究锰、铜、镍(Ni)的金属活动性,进行如下实验:将镍丝分别插入MnSO4溶液和CuSO4溶液中,前者镍丝表面无变化,后者镍丝表面有红色固体析出。由此可得出,锰、铜、镍三种金属活动性由强到弱的顺序为( )
A.Cu Mn Ni B.Mn Ni Cu
C.Ni Cu Mn D.Ni Mn Cu
14.向一定量的硫酸锌与稀硫酸的混合溶液中加入锌粒直至过量,如右图所示的图象,若以加入的锌粒质量为横坐标,则纵坐标是指( )
A.生成气体的质量 B.溶液的质量
C.溶液中硫酸的质量 D.溶液中水的质量
15.下列物质中,铁元素的质量分数最高的是 ( )
A.FeSO4 B.FeCO3 C.Fe3O4 D.生铁
16.自行车的主要材料钢铁易生锈。请为右图中标示的自行车部件各设计一种不同的、合理的防锈方法。
⑴三角架:
⑵辐条:
⑶链条:
17.⑴下表是两种常见金属的部分性质:
金属名称 颜色 密度 熔点 导电性 硬度 化学特性
铝 银白色 2.79g/cm3 660℃ 良好 较软 常温下能与空气中的氧气作用,在金属表面形成致密氧化膜
铁 银白色 7.86g/cm3 1535℃ 良好 一般 在潮湿的空气中容易产生铁锈
①根据表中金属铝的性质,试推断金属铝可能的一种用途是_____________________;
②铝比铁金属活动性强,但铝制品耐用而铁制品却容易锈蚀,其原因是___________________;
⑵黄金(Au)是一种贵金属,素有“真金不怕火炼”之说,这说明了金的化学性质在自然条件下非常________(填“稳定”或“活泼”);成语“点石成金”本意为将石头变成黄金,你同意这种说法吗?请运用相关的化学知识加以解释:________________________________。
18.铁匠师傅往往用反复敲打发红的铁器的方法来降低铁中的含碳量,你知道含碳量是如何降低的吗 用化学方程式表示____________________。
19.小强同学设计了如右图所示的实验,你想一想:
⑴该实验探究的问题是
__________________________。
⑵实验过程中,发生反应化学方程式是
_________________________。
⑶通过该实验可得出的结论是
____________________________。
20.为了探究影响金属与酸反应剧烈程度的因素,进行了以下实验:
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与5%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸反应和10%盐酸反应 10%盐酸产生气体快
由此得出影响金属与酸反应剧烈程度的困素有:
因素一:_______________________________;
因素二:_______________________________;
因素三:_______________________________。
21.钛(Ti)因为有许多神奇的性能而越来越引起人们的关注,常温下钛的化学性质很稳定, 与酸不反应。红热时,却可以与许多物质反应,钛是航空、宇航、军工、电力等方面必须的原料。地壳中含钛矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石,炭粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性的气体,此反应的化学方程式________________________________
第二步:在氩气的氛围中,用过量的镁在加热的条件与TiCl4反应制得金属钛。
⑴此反应的化学方程式为__________________________________。
⑵上述产物中常会有的杂质是________。简述除去此杂质的主要步骤____________,并写出反应的化学方程式____________________________。
22.将一根干燥的铁丝弯成如右图所示的形状,并将其两端分别插入盛有水的烧杯甲中和盛有油的烧杯乙中,放置数天后,观察铁丝A、B、C三处表面发生的变化是否相同 (若不相同,请具体说明)
__________________
23..某钢铁厂用含杂质19%的赤铁矿冶炼生铁,求8000kg这种矿石可炼出含铁96%的生铁多少千克?
拓展训练
1.在互联网上用Coogle搜索“中央电视台每周质量报告”时,可搜索到被曝光的事件中一定涉及到化学变化的是 ( )
A.用毛发水、酱色、水、盐等兑制成“假酱油”
B.用工业石蜡等涂抹在瓜子表面给瓜子“美容”
C.用硫磺燃烧法熏蒸粉丝
D.用淀粉、蔗糖、奶香精等掺和成“假奶粉”
2.生活中废弃的铝质易拉罐、破铁锅、废铜线等可归为一类加以回收,它们属于 ( )
A.有机物 B.金属或合金 C.氧化物 D.非金属
3.学习化学我们要经常做实验。下列实验操作正确的是 ( )
A B C D
4.图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中不正确的是
A.根据金属活动性顺序表,判断金属能否置换出稀硫酸中的氢
B.根据密度数据表判断液体物质挥发性的大小
C.根据溶解度曲线图,判断从溶液中获得晶体的方法
D.根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行
5.小明想除去卫生间瓷砖上的铁锈痕迹,在用清水洗涤之前,他从家中选择了一种最合适的物质对铁锈进行处理,这种物质是 ( )
A.汽油 B.食盐水 C.白醋 D.米酒
6.为测定a、b、c三种金属的活动性强弱,某同学将金属a、b、c分别放入稀硫酸中,b溶解并产生气泡,a、c不反应;另将a放入c的硝酸盐溶液中,a表面析出c。据此分析,三种金属的活动性由强到弱的顺序为
A.b、a、c B.c、b、a C.b、c、a D. a、b、c
7.为测定铁、铜和银的金属活动性顺序,下列不能达到目的的试剂组是
A、Ag,Fe,CuSO4溶液 B、Ag,FeSO4溶液,CuSO4溶液
C、Fe,Cu,AgNO3溶液 D、Cu, FeSO4溶液,AgNO3溶液
8.下列所示物品中,不是利用合成有机高分子材料制成的是( )
9.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
(1)地壳中含量最高的金属元素是 。
(2)金属具有的物理性质有: 。
(3)日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能。
由上表推断,与组成合金的纯金属相比,合金的优点一般有(填序号)
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性更好
(4)人们每年要从金属矿物资源中提取数以亿吨计的金属。根据所学化学知识,按要求写出两个生成金属的化学方程式:
① (置换反应)
② (分解反应)
10.⑴考古发掘出的铜器表面往往有一层厚厚的铜绿[主要成分Cu2(OH)2CO3],试用化学方程式解释铜绿形成的原因。
⑵为什么高档电器的铜质插孔、插头表面要镀上价格比铜昂贵碉导电性又不如铜的金?
⑶不法商贩常在金中掺入铜打制“纯金”饰品出售。如何识别这种假冒“纯金”戒指。
操作步骤
现象
分析
⑷许多资源都是不可再生的,每个公民都应树立保护资源的观念。下列做法不利于保护金属资源的是 (填选项字母)
A.采取各种有效防锈方法避免金属锈蚀
B.用塑料代替钢和其他合金制造管道
C.私挖、滥采矿物
D.回收利用铝制饮料罐
11.已知A、B、C、D、E、F为常见物质,其中A、B含有相同的元素,B、E为氧化物,C、D、F都为单质。它们相互转化的关系如右图所示(图中反应条件略去)。
(1)X在反应①中起 作用。
(2)写出有关物质的化学式:
A 、C 。
(3)若F不溶于稀硫酸,写出反应③的化学方程式 ,
该反应的基本类型是__________。与D具有相同化学性质,并能与E发生反应,且反应基本类型与③相同的物质有 。
12.铜陵被誉为我国的“铜都”。右图是铜陵铜工艺品中著名的四喜娃娃,小明找到了分别用纯铜、青铜(Cu、Sn合金)两种材料制作的四喜娃娃及用于实验的纯铜片和青铜片。
(1)怎样用化学方法区分这两种四喜娃娃
区分纯铜和青铜的实验方法是:_______________________________。
(2)四喜娃娃为什么生锈了
通过查阅资料得知,金属铜长时间放置在空气中,能够和空气中氧气等物质发生化学反应,生成铜绿[Cu2(OH)C03]。请你根据铜绿的组成推断,铜变成铜绿时,空气中的02、_______、_________________参加了反应。(填化学式)
(3)哪种四喜娃娃更容易生锈
小明发现从不同地点收集到的两个四喜娃娃中,青铜娃娃身上的锈斑比纯铜的多,他据此得出结论:青铜比纯铜更容易生锈。
他的这种推理方法是否科学 ____________。
请说出理由:_________________________。
(4)青铜四喜娃娃的铜绿中为什么会有褐色的锈斑
由于有的青铜中含杂质较多,尤其是含铁,故在铜绿间还会有斑驳的、呈褐色的氧化铁。现有一些这种含褐色的锈斑粉末,请你设计实验证明锈斑粉末中含有铁元素。
13.在焊接两根铁轨时,为确保施工质量,工程技术人员常用到一种叫做“引火铁”的反应活性材料。实验室的制备过程如下:⑴在高温条件下用普通铁粉和水蒸气反应,得到粉末状的四氧化三铁;⑵将四氧化三铁粉末在高温条件下经过与上述过程相反的反应生成“引火铁”粉末。请分别用以下两套装置,制取四氧化三铁和“引火铁”。实验中必须使用普通铁粉和稀硫酸,其他试剂和用品自选。(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)
填写下列空白:
(1)实验过程中第(1)、(2)两个相反步骤的反应方程式是:
①____________________________________ ②____________________________________
(2)在实验装置中,烧瓶B的作用是____________________。
(3)实验时试管A中加入的固体是_________,试管D处可收集到的气体是______。
(4)实验时分液漏斗E中应加入的试剂是___________,在F中加入的固体是_________,在U型管G中常加入固体氢氧化钠,其作用是__________________________。
(5)实验过程中,两套装置里所有需要加热的仪器是______(填字母)。
1、金属材料
①
D
③
②
A
X
B
C
X
E
F
B
PAGE
2
同课章节目录
